Хламидии особенности строения жизненного цикла способы окраски
Семейство Chlamydiaceae отдела Gracilicutes включает один род Chlamydia (от греч. chlamydos, плащ; название возникло из-за сходства ретикулярной клетки с оболочкой, окружающей созревающие в ней ЭТ]. В настоящее время род включает три вида: С. trachomatis, C.psittaci и С. pneumoniae.
Все виды хламидий патогенны для человека и многих животных. Заболевания, вызываемыми ими, регистрируются повсеместно и известны как хламидиозы.
Таблица 23-1. Классификация представителей рода Chlamydia
Хламидии лабильны к действию высоких температур (погибают при 60 «С за 10 мин), но длительно сохраняются при низкой температуре.
Все виды хламидий чувствительны к действию антисептиков и дезинфектантов. Под влиянием неблагоприятных факторов хламидии могут образовывать L-формы. Хламидии — «энергетические паразиты».
Хламидии неспособны самостоятельно синтезировать высокоэнергетические соединения и обеспечивать собственные потребности в энергии. Нормальное развитие хламидий возможно только в условиях внутриклеточного паразитирования.
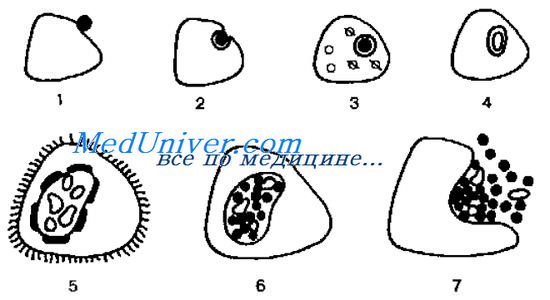
Хламидии размножаются бинарным делением. Жизненный цикл хламидии включает образование двух основных форм (рис. 23-1).
• Элементарное тельце хламидии (ЭТ) — мелкая (0,2-0,5 мкм) сферическая внеклеточная структура с трёхслойной клеточной стенкой. Метаболически малоактивно и адаптировано к внеклеточному выживанию. Элементарные тельца хламидий — инфекционные единицы, заражающие клетки. По Романовскому-Гимзе ЭТ окрашиваются в пурпурный цвет.
• Ретикулярное тельце хламидии (РТ) — репродукционная внутриклеточная форма. Представлено более крупным образованием (до 1 мкм), имеющим сетчатую структуру с тонкой клеточной стенкой. Развивается в течение 5-6 ч из ЭТ, проникшего в цитоплазму и претерпевшего структурные изменения. Первоначально из ЭТ образуется инициальное тельце (вегетативная форма), окрашивающееся в синий цвет по Романовскому-Гимзе. Затем инициальное тельце превращается в РТ.
После образования РТ хламидийная клетка начинает бинарно делиться, образуя тельца включений в виде вакуолей в цитоплазме инфицированной клетки. Тельца включений хламидий обычно располагаются околоядерно, по Романовскому-Гимзе окрашиваются в пурпурный цвет; их можно обнаружить методом световой микроскопии. В тельцах включений находятся делящиеся РТ. С. psittaci и С. pneumoniae образуют множество мелких телец включений, окружающих ядро. С. trachomatis образует одно большое тельце. Вследствие конденсации РТ образуется промежуточное тельце, напоминающее бычий глаз.
Промежуточные тельца хламидий трансформируются в ЭТ, готовые покинуть клетку. Выход ЭТ сопровождается гибелью инфицированной клетки.
Источник
Хламидии особенности строения жизненного цикла способы окраски
Хламидии — неподвижные, облигатно паразитические, кокковидные бактерии. Размножаются только внутри связанных с мембраной вакуолей в цитоплазме клеток человека, млекопитающих, птиц. Членистоногие не служат хозяевами или переносчиками. Размножение происходит в ходе уникального цикла развития.
Основными стадиями жизненного цикла хламидий являются:
• Элементарные тельца – мелкие (0,2-0,5 мкм) электронноплотные шаровидные структуры, лишенные метаболитной активности, имеющие компактный нуклеоид и ригидную клеточную стенку, которые фильтруются через бактериальные фильтры. Они являются инфекционным началом хламидий и обеспечивают их выживание во внеклеточной среде и заражение новых клеток.
• Ретикулярные тельца – более крупные (0,8-1,5 мкм), сферические образования, имеющие сетчатую структуру с тонкой клеточной стенкой и фибриллярным нуклеоидом. Они вырастают из элементарных телец внутри клеток, лишены инфекционности и, подвергаясь делению, обеспечивают репродукцию хламидий. Отсюда другое, исторически первое название ретикулярных телец – «инициальное тело». Ретикулярные тельца являются вегетативной формой хламидий.
• Промежуточные тельца – промежуточная стадия между элементарными и ретикулярными тельцами.
Жизненный цикл хламидий начинается с того, что элементарные тельца фагоцитируются клеткой-хозяином, а затем в течение нескольких часов реорганизуются, увеличиваются в размерах и превращаются в ретикулярные формы, которые размножаются путем поперечного деления. Жизненный цикл заканчивается, когда возникающие промежуточные формы уплотняются, уменьшаются в размерах и превращаются в элементарные тельца. Размножаясь внутри цитоплазматических вакуолей, хламидии образуют микроколонии (включения), окруженные мембраной. В составе микроколоний обнаруживаются все три стадии развития хламидий. После разрыва стенки вакуоли (везикулы) и мембраны клетки-хозяина, вновь образовавшиеся хламидии высвобождаются, и элементарные тельца, инфицируя другие клетки, повторяют цикл развития. В оптимальных условиях роста в эукариотических клетках жизненный цикл хламидий составляет 17-40 часов.
Хламидии хорошо размножаются в желточном мешке куриного эмбриона при температуре от 330 – 440С, а также в культурах клеток различных позвоночных. Зависимость хламидий от клеток-эукариотов объясняется их неспособностью аккумулировать и использовать энергию, так как они не могут синтезировать АТФ. В этом отношении хламидии похожи на риккетсий, в связи с чем, эти микроорганизмы также называют «энергетическими паразитами».
Своеобразие хламидий проявляется и в строении их клеточной стенки. Она лишена пептидогликана и представляет собой двухслойную мембрану, ригидность которой определяют пептиды, перекрестно сшитые дисульфидными мостиками. В остальном хламидии напоминают грамотрицательные бактерии, так как содержат гликолипиды, сходные с липополисахаридами.
Порядок Chlamydiales включает одно семейство Chlamydiaceae с единственным родом Chlamydia. Для человека патогенны виды C. trachomatis, C. psittaci, C. pneumoniae. Хламидии вызывают у людей заболевания глаз, дыхательной и мочеполовой систем и объединяются под общим названием «хламидиозы».
Методы исследования. Для микроскопического обнаружения телец включений (микроколоний) хламидий в инфицированных клетках (тканях) применяют различные методы окрашивания: Романовского-Гимзе, Маккиавелло и другие. При окрашивании по Романовскому-Гимзе они приобретают голубой или фиолетовый цвет. Кроме того, хламидии хорошо видны и в неокрашенном состоянии при микроскопии влажных препаратов под стеклом с помощью фазовоконтрастной оптической системы. В последнее время наиболее часто используется прямая реакция иммунофлюоресценции, окраска акридин –оранжевым.
Источник
Урогенитальный хламидиоз
О.И. Немченко
Эпидемиология и частота распространения
Хламидийная инфекция, вызывающая воспалительные заболевания органов репродуктивной системы, является одной из наиболее распространенных инфекций, передаваемых половым путем. За последние 10 лет частота заболеваемости выросла в 3 раза. Заболевание встречается в 2–4 раза чаще, чем гонорея, и в 7,5 раза чаще, чем сифилис. Ежегодно в мире регистрируется около 90 млн новых случаев хламидийной инфекции, в том числе в США около 5 млн, Западно-Европейском регионе 10 млн. В последние годы в России также отмечен значительный рост заболеваемости урогенитальным хламидиозом. Это связано как с истинным увеличением числа заболевших, так и с совершенствованием методов диагностики. Распространению урогенитального хламидиоза в России способствуют ограниченная информированность медицинских работников об особенностях этой инфекции и отсутствие в большинстве медицинских учреждений возможности эффективной диагностики. Кроме того, по данным ВОЗ, в 35–50% случаев хламидийная инфекция протекает под маской других заболеваний, что не позволяет вовремя применить адекватную терапию и остановить распространение инфекции.
Возбудитель урогенитального хламидиоза – Chlamydia trachomatis, обитает в эпителии мочеполовых органов, поэтому основным путем передачи инфекции являются половые контакты. Среди взрослого населения неполовые пути передачи (воздушно-капельный, бытовой и др.) существенного значения не имеют. Однако присутствие возбудителя в родовых путях женщины может стать причиной заражения и ранней гибели плода. Частота вызываемой хламидиями генитальной инфекции ежегодно возрастает, что увеличивает риск инфицирования новорожденных 9. Кроме того, бытовой путь передачи (через постельное белье, предметы туалета) может способствовать внутрисемейному распространению инфекции. Вероятность заражения хламидиозом детей колеблется, по данным разных авторов, от 40 до 70%.
Удельный вес хламидиоза среди девочек-подростков и девушек 13–19 лет, страдающих воспалительными заболеваниями, составляет, по данным разных авторов, 13–80%, причем 30–40% девочек-подростков переносят скрытую хламидийную инфекцию в течение 2–5 лет после заражения.
Хламидии часто встречаются в ассоциации с другими возбудителями, ухудшающими в значительной мере течение основного заболевания. Монохламидийная инфекция встречается в 17–30% случаев, у остальных девушек выделена хламидийно-бактериальная и хламидийно-вирусная флора. Наиболее частыми ассоциантами хламидий являются золотистый стафилококк (20,7%), грибы рода Кандида (15%), гонококк (3–5,7%). В остальных случаях обнаружено сочетание хламидий с гарднереллами, трихомонадами, уреаплазмами. Внутриклеточные паразиты существенно облегчают передачу вирусных инфекций. Вирус простого герпеса выявляется у 7,6% женщин, инфицированных хламидиями, в репродуктивном возрасте. Хламидиоз относится к кофакторам прогрессирования СПИДа.
Хламидиоз несет серьезную медицинскую, социальную и демографическую опасность, ему принадлежит ведущее место среди причин нарушения генеративной функции и бесплодия в супружестве.
Биологические свойства хламидий
Хламидии – это патогенные для человека микроорганизмы, которые являются облигатными внутриклеточными паразитами, обладающие тропизмом к клеткам цилиндрического, а возможно, и переходного эпителия. Хламидии не входят в состав нормальной микрофлоры, и их обнаружение указывает на наличие инфекционного процесса.
Впервые хламидиоз как заболевание был описан немецким ученым Юргенсоном в 1874 г. у попугаев. В 1879 г. швейцарским ученым Риттером был выявлен респираторный хламидиоз, возникший после контакта с попугаями, завезенными в Европу и Северную Америку из Южной Америки. В 1930 г. Levintal обнаружил округлые базофильные тельца в тканях больных птиц, а Lilli и Coles обнаружили эти тельца в клетках ретикулоэндотелиальной системы попугаев и людей. Возбудитель хламидиоза был выявлен Л. Гальбштадтером и C. Провачеком в эпителии конъюнктивы больных трахомой и назван “chlamydozoа” (от греческого слова chlamys – мантия, так как при окраске по Гимзе наблюдали матрикс вокруг элементарных телец) в 1907 г. Позже предлагались и другие названия в честь ученых, занимавшихся изучением данного рода микроорганизмов (миагаванелла, бедсония, гальпровия и т.п.). Современное название “хламидия” было предложено в 1945 г. Джонсом и соавт.
Согласно науке о видовом и родовом составе микроорганизмов (таксономии), ранее не классифицированные микроорганизмы, имеющие сходный с хламидиями цикл развития, были выделены в четыре дополнительных семейства в составе порядка Chlamydiales: 1) Chlamydiaceae, включающее непосредственно род Chlamydia и род Chlamydiophila, 2) Parachlamydiaceae, 3) Simkaniaceae, 4) Waddliaceae (рис. 1).
Рис. 1. Порядок Chlamydiales
В настоящее время известны 3 вида возбудителя, относящиеся к роду Chlamydia: Сhl. trachomatis, Сhl. suis, Сhl. muridarum (рис. 2). Термин “урогенитальный хламидиоз” обозначает группу болезней и симптомов, вызываемых облигатным внутриклеточным микроорганизмом Chlamydia trachomatis. Патогенные штаммы Chlamydia trachomatis дифференцированы на два биовара: trachoma (14 сероваров) и LGV 4 серовара). Поражения урогенитального тракта вызывают серотипы от Д до К.
Рис. 2. Виды возбудителей рода Chlamydia
Хламидии по своей структуре напоминают классические бактерии, но не обладают многими метаболическими механизмами, необходимыми для самостоятельного размножения. Для своего воспроизводства они используют продукты метаболизма клетки-хозяина, что и определяет их облигатный паразитизм. Хламидии способны синтезировать АТФ в очень незначительных количествах путем гликолиза и расщепления гликогена, в связи с чем они нуждаются в использовании метаболической энергии эукариотической клетки. Обязательный внутриклеточный энергозависимый от хозяина паразитизм определяет подобие хламидий и вирусов. Наличие клеточной стенки (не содержащей, однако, мурамовой кислоты) двух нуклеиновых кислот – РНК и ДНК, чувствительность к ряду антибиотиков обусловливает сходство с грамотрицательными бактериями. Хламидии не растут на искусственных питательных средах. Эти микроорганизмы размножаются внутри клеток-хозяина, обладая тропизмом к цилиндрическому эпителию слизистых оболочек, в том числе и урогенитального тракта.
Уникальность хламидий определяется своеобразным циклом развития в виде последовательного образования элементарных телец (ЭТ) – инфекционная форма и ретикулярных телец (РТ) – вегетативная форма (рис. 3). ЭТ адаптированы к внеклеточному выживанию, обладают слабой метаболической активностью. РТ разрушаются во внеклеточной среде, однако в клетке метаболически высокоактивны. Фагоцитированные ЭТ, проникая в клетку, через переходную форму превращаются в РТ, или тельца Гальберштедтера–Провачека. Цикл развития хламидий протекает в цитоплазматических включениях в течение 48–72 ч и, как правило, завершается разрывом мембраны включения. Содержимое включения с ЭТ поступает в межклеточное пространство, и далее ЭТ инвазируют новые клетки (рис. 4).
Рис. 3. Цикл развития хламидий
Рис. 4. Жизненный цикл хламидий
Неполный фагоцитоз, при котором не происходит уничтожения бактерий, обусловлен способностью ЭТ продуцировать антилизосомальные ферменты. Нелизированные лимфоцитами и макрофагами ЭТ могут циркулировать в лимфоцитарном и кровеносном русле. Данное свойство, которое является отличительной особенностью возбудителя, объясняет наличие диссеминации, торпидного, подострого и хронического течения заболевания.
Клеточная стенка хламидии состоит из внутренней цитоплазматической и наружной мембран, каждая из которых двойная. Таким образом, обеспечивается прочность клеточной стенки хламидии. Антигенные свойства хламидий определяются внутренней мембраной, которая представлена липополисахаридами. В нее интегрированы так называемые белки наружной мембраны (Outer membrane proteins – OMP). На основной белок наружной мембраны – Major Outer Membrane Protein (MOMP) приходится 60% общего количества белка. Остальная антигенная структура представлена белками наружной мембраны второго типа – ОМР 2 (рис. 5).
Рис. 5. Структура клеточной стенки Chlamydia trachomatis
Защитная реакция на начальной стадии инфекции осуществляется полиморфно-ядерными лимфоцитами. Существенную роль в защите организма играет поликлональная активация В-лимфоцитов. В сыворотке крови и секреторных жидкостях при хламидиозе обнаруживают значительное количество иммуноглобулинов IgG, IgM, IgA. Однако ведущую роль в защите от хламидийной инфекции занимают Т-хелперы, активирующие фагоцитарную активность макрофагов. Хламидии поглощаются периферическими моноцитами и распространяются в организме, моноциты оседают в тканях и превращаются в тканевые макрофаги (в суставах, сосудах, в области сердца). Тканевые макрофаги могут сохранять жизнеспособность в течение нескольких месяцев, являясь при этом мощным антигенным стимулятором, приводя к образованию фиброзных гранулем в здоровой ткани.
Хламидии способны трансформироваться в L-форму. При этом происходит изменение антигенных свойств поверхностных структур и цитоплазматической мембраны, что позволяет возбудителю ускользать от ранее наработанных иммунной системой специфических антител. Такая трансформация возможна при использовании антибактериальных препаратов с антихламидийной активностью в малых или недостаточных дозах. Также установлено, что в возникновении персистенции хламидий важную роль играют инертные в отношении хламидий антибиотики (например, группы пенициллина), сульфаниламиды, дисбактериоз кишечника и особенности факторов иммунной защиты.
Основными антигенными детерминантами, участвующими во взаимодействии хламидий с иммунной системой организма, являются липополисахариды (ЛПС) клеточной стенки, белки наружного мембранного комплекса, ключевыми из которых являются основной белок наружной мембраны и белок теплового шока (БТШ). Возможно, что в этом взаимодействии участвуют и другие поверхностные и внутренние компоненты хламидий, роль которых изучена недостаточно. Белковые антигенные структуры определяют видо- и родоспецифичность (см. табл.).
Таблица. Антигены хламидий (по P.-A.Mardh, 1990)
ЛПС представляют родоспецифический антиген хламидий. Хламидийный ЛПС содержит родоспецифичные эпитопы, антитела к которым остаются основным компонентом при диагностике хламидийных антител и антигенов в большинстве используемых в лабораториях тест-систем. ЛПС является единственным хламидийным компонентом, который возможно определить на поверхности инфицированной клетки. В процессе активного размножения хламидий возможны избыточный синтез ЛПС и выделение его в кровоток. Циркулирующие ЛПС способны неспецифически индуцировать продукцию цитокинов, что может привести к дисбалансу иммунной системы и хронизации инфекции.
Среди структурных белков клеточной стенки особое внимание исследователей в последние годы привлекает термостабильный БТШ-60 из семейства 60 кДа белков теплового шока, которому, по современным представлениям, принадлежит ведущая роль в патогенезе хронической персистирующей хламидийной инфекции. МОМР хламидий, сохраняющийся на протяжении всего жизненного цикла микроорганизма, является иммуногеном и представляет собой сложный антиген, имеющий детерминанты, специфичные не только для рода и вида, но и для серологических вариантов, определенных методом микроиммунофлюоресцентного анализа. БТШ хламидий может инициировать реакцию замедленного типа. Антитела класса IgA к БТШ хламидий доминируют у женщин с первичным бесплодием и у женщин с привычной потерей беременности. Стимулируя Т- и В-субпопуляции лимфоцитов и являясь мишенью для нейтрализующих антител, МОМР способен вызвать протективный иммунитет, что делает его возможным кандидатом для создания вакцины.
Учитывая способность хламидий ингибировать слияние фагосом с лизосомами, фагоцитоз при хламидийной инфекции непродуктивный. При этом рост хламидий в моноцитах приостанавливается в промежуточном состоянии на стадии между элементарными (ЭТ) и ретикулярными тельцами (РТ). На этом этапе в цитоплазме моноцитов обнаруживается ЛПС клеточной стенки и отсутствует МОМР. Таким образом, макрофаги представляют Т-хелперам ЛПС-антиген и не экспонируют главный протективный антиген хламидий – МОМР. Следовательно, иммунный ответ заведомо формируется к вариабельному ЛПС и оказывается неспецифическим по отношению к Chlamydia trachomatis.
Источником инфекции при урогенитальном хламидиозе является человек, болеющий острой или хронической формой заболевания с манифестным или бессимптомным течением. Распространение в организме происходит каналикулярно, трансплацентарно, лимфогенно, гематогенно, а также при участии сперматозоидов.
Для детей описывают такие основные пути заражения хламидиозом, как антенатальный (в течение беременности – трансплацентарно или при заглатывании инфицированных околоплодных вод в случае поражения хламидиями эндометрия, фаллопиевых труб, децидуальных и плодных оболочек) и интранатальный (во время родов) [9, 26]. Интранатальный путь является традиционным для инфекций, передаваемых половым путем, с инфицированием конъюнктивы глаз, а далее через носослезный канал происходит попадание возбудителя в дыхательные пути. Аналогичен механизм заражения половых органов у девочек. Однако наиболее вероятно антенатальное заражение, так как хламидии были обнаружены почти у трети детей, рожденных путем кесарева сечения в случае патологически протекающей беременности.
Возможен контактно-бытовой путь, встречающийся у девочек в основном дошкольного возраста (через постельное белье, предметы туалета), и даже половой путь передачи инфекции, свойственный для сексуально-активных подростков. Дебют заболевания у сексуально-активных подростков связан, как правило, с началом половой жизни, сменой полового партнера. Передача хламидий при половой близости от зараженного мужчины к женщине происходит в 40% случаев, от женщины к мужчине – в 32%. При заражении половым путем инкубационный период составляет в среднем 10–15 дней (от 7 до 21 дня).
Развитие, течение и исход хламидийной инфекции определяются прежде всего состоянием макроорганизма, особенностями его иммунных реакций (в том числе и генетически обусловленных), состоянием гомеостаза, наличием сопутствующей патологии и многими другими факторами, а также уникальными биологическими свойствами возбудителя, его способностью к длительной персистенции, антигенной и иммунологической мимикрии.
Необходимым условием распространения является несостоятельность защитных биологических барьеров. Клетки здорового организма обладают достаточно мощной системой биологической защиты, включающей структурную и функциональную устойчивость мембраны, антиоксидантную систему и сопряженное с ней перекисное окисление липидов, обеспечивающие завершенный фагоцитоз. Проникновение хламидии в клетку, преимущественно функционально не ослабленную, не является фагоцитозом в классическом смысле, так как возбудитель активно внедряется в нее, активно воздействуя на биомембрану клетки, подавляя ее защитные реакции и перестраивая метаболизм в выгодную для себя сторону (рис. 6).
Рис. 6. Эпителий цервикального канала, пораженный хламидиями
Обладая тропизмом к цилиндрическому эпителию, хламидии чаще всего вызывают эндоцервициты. Так, например, при патологии шейки матки процент инфицирования хламидиями составляет 61,5–75. В дальнейшем возможно распространение на эндометрий, эндосальпинкс, брюшину малого таза и др. Хламидиоз нередко является причиной первичного перигепатита, пельвиоперитонита, перисальпингита, периаппендицита (аппендикулярно-генитальный синдром Fitz-Hugh-Curtis). В нормальном многослойном плоском эпителии у взрослых женщин хламидии не способны размножаться. Однако у подростков в период пубертата нередко поражается и плоский эпителий шейки матки, влагалища.
Основным звеном патогенеза урогенитального хламидиоза является медленно протекающий рубцовый процесс: нарушение микроциркуляции и трансэндотелиального барьера, потеря клетками ворсинок, стаз и краевое стояние тромбоцитов, гипоксия и отек ткани, повреждение цитопемсиса. Вследствие усиления синтеза коллагенообразования и пролиферации фибробластов образуется рубцовая ткань, что нередко приводит к спаечному процессу в малом тазе и, в последующем, к трубному бесплодию, эктопической беременности.
По топографии поражения выделяют заболевания нижнего урогенитального тракта (хламидийный уретрит, парауретрит, бартолинит, кольпит, эндоцервицит) и восходящую инфекцию (эндометрит, сальпингит и сальпингоофорит, пельвиоперитонит, перигепатит). Согласно МКБ-10 раздел А 56), выделяют следующие варианты урогенитального хламидиоза:
А 56.0. Хламидийные инфекции нижних отделов мочеполового тракта;
А 56.1. Хламидийные инфекции верхних отделов мочеполового тракта;
А 56.8. Хламидийные инфекции, передаваемые половым путем, другой локализации.
По длительности заболевания различают свежий урогенитальный хламидиоз (с давностью заражения до 2 мес) и хронический (с давностью заражения свыше 2 мес.), хотя деление это весьма условно в связи с тем, что момент инфицирования установить, как правило, невозможно. В клинической картине свежего хламидиоза выделяют острую, подострую и торпидную (малосимптомную) стадии.
Заподозрить хламидийную инфекцию у новорожденных можно при наличии в анамнезе указаний на выявление хронических урогенитальных заболеваний у родителей: наличие патологии беременности (самопроизвольный выкидыш, угроза прерывания, поздний токсикоз, многоводие, плацентарная недостаточность, задержка развития и гипотрофия плода, преждевременная отслойка нормально расположенной плаценты, преждевременные роды), развитие во время беременности острого вульвита, кольпита.
Симптоматика урогенитального хламидиоза у новорожденных обычно более выражена, чем у взрослых, и проявляется вульвовагинитом, уретритом, цервицитом. Экстрагенитальные проявления разнообразны и по локализации, и по выраженности патологического процесса – от длительных, асимптомных ринофарингита, евстахиита, проктита до внутриутробного сепсиса, пневмонии, респираторного дистресс-синдрома, гастроэнтеропатии, миокардита, менингоэнцефалита. В анализе крови при хламидийной инфекции у новорожденных отмечаются эозинофилия (до 10–15%) и моноцитоз, небольшой лейкоцитоз и увеличение СОЭ.
Известно, что у новорожденного антитела представлены в основном материнскими IgG, уровни IgM и IgA, если не было внутриутробной инфекции, незначительны. Через 9 мес материнские IgG исчезают. IgM и IgA, присутствующие в крови ребенка, вырабатываются его собственными плазматическими клетками, поскольку эти антитела не проникают через плаценту. Количество IgG в сыворотке крови после рождения обычно достигает уровня взрослого организма в течение первого года жизни, уровень IgM – к возрасту 4 лет, а IgA – в подростковом периоде. Поэтому наличие антихламидийных антител у ребенка, титры которых имеют тенденцию к снижению, указывает на их анамнестический характер (пассивная передача антител от матери). Отсутствие у новорожденного ребенка антихламидийных антител не означает отсутствия хламидиоза и требует проведения микробиологического и повторного серологического методов обследования и наблюдения.
Особенностью проявлений приобретенного хламидиоза у детей является латентное, бессимптомное течение, в дальнейшем нередко реализующееся в манифестные формы. Хламидийная инфекция может иметь острое, персистирующее или латентное течение, меняя свой характер в процессе взаимодействия микро- и макроорганизма. При персистирующей инфекции размножение возбудителя в организме происходит постоянно, но клинических симптомов заболевания не отмечается, т.е. ребенок считается практически здоровым. При латентной (скрытой) инфекции нет чрезмерного размножения возбудителя, наблюдается постоянное антигенное воздействие, а инфицирование реализуется в заболевание в условиях снижения иммунной защиты организма.
Хламидии в основном поражают клетки цилиндрического эпителия, а также предпочитают щелочную среду. Клинические проявления хламидийного вульвовагинита неспецифичны. При монохламидиозе и хламидийно-вирусном инфицировании преобладает подострый и хронический характер течения воспаления с минимальными жалобами пациенток. Как правило, наблюдается умеренная гиперемия слизистых оболочек наружных половых органов. Выделения из влагалища носят слизистый характер. Наличие клинических проявлений, как правило, обусловлено сопутствующей бактериальной инфекцией. Выделения чаще слизисто-гнойные, нередко отмечается болезненность преддверия влагалища, инъецированность слизистых оболочек, их легкая ранимость при заборе материала. Длительно существующие вульвовагиниты приводят к формированию синехий половых губ, образованию рубцовых изменений во влагалище.
При поражении мочеиспускательного канала возможно учащенное и болезненное мочеиспускание. Хламидийный уретрит чаще всего сопровождается незначительными субъективными нарушениями. Характерен феномен “утренней капли”. При поражении парауретральных желез отмечают гиперемию их устьев и появление слизистых и гнойно-слизистых выделений после массажа уретры. Часто хламидии обитают в парауретральных ходах и криптах, образуя “неконтролируемое депо”, способствуя затяжному течению, рецидивированию и распространению.
Эндоцервицит – наиболее частое проявление хламидийной инфекции. Клетки шеечного канала секретируют щелочное содержимое, оптимальное для жизнедеятельности хламидий. Хламидийный цервицит в 84% случаев сопровождается появлением слизистых выделений без резкого запаха, характерна отечность, рыхлость слизистой оболочки. Часто больных беспокоят умеренные, жидкие бели, продолжающиеся месяцами. Выделения мутно-слизистого и гнойно-слизистого характера появляются лишь при присоединении другой бактериальной или вирусной инфекции. Эктопия шейки матки при хламидийном поражении имеет признаки воспаления: отечность слизистой оболочки, расширенная поверхностная сеть сосудов, большое количество ретенционных наботовых кист по периферии. Хламидийная инфекция тормозит процессы эпителизации слизистой оболочки, часто при кольпоскопии наблюдается атипичная зона трансформации в виде йоднегативных участков по периферии эктопии шейки матки. Цилиндрический эпителий у входа в цервикальный канал находится в состоянии отека с элементами начала гиперплазии.
Восходящая хламидийная инфекция подразумевает поражение слизистой оболочки матки, труб, яичников, околоматочных связок, брюшины, печени.
Хламидийный эндометрит развивается медленно, протекает чаще хронически, может существовать годами в связи с пребыванием хламидий в глубоких слоях эндометрия, эндометриальных криптах. Хламидийная природа эндометрита распознается при исследовании биоптатов эндометрия, при этом отмечаются значительные колебания в публикуемых процентах положительных проб – от 4 до 86,7%.
Изолированный хламидийный эндометрит встречается редко, чаще он сопровождается сальпингоофоритом. Хламидийный сальпингит – наиболее частое проявление этой инфекции. Для хламидийного сальпингита также характерно длительное стертое течение. Острое течение чаще отмечается в возрасте 20–25 лет, а в возрасте 30 лет и старше – хронически, иногда с минимальными клиническими симптомами. Пациенты могут жаловаться на боли в животе, крестцово-поясничной области. В первую очередь поражается слизистая оболочка маточных труб. Складки труб набухают, нарушается целостность эпителия, появляется ригидность труб, нарушается их перистальтика. В результате происходит уплотнение стенок, края трубных складок слипаются, нарушается проходимость маточных труб. Частота трубного бесплодия у больных хламидийным сальпингитом составляет 34–49%.
Восходящая хламидийная инфекция нередко сопровождается формированием перигепатит-синдрома Fitz-Hugh-Curtis. При этом образуются спайки между передней поверхностью печени и париетальной брюшиной. Также могут наблюдаться периспленит, периколит, периаппендицит, спаечный процесс брюшной полости другой локализации. Течение перечисленных заболеваний сопровождается повышением температуры тела, болями в животе.
При сборе анамнеза следует обратить внимание на заболевания суставов, глаз, мочеполовой системы. Устойчивая триада симптомов: уретрит, конъюнктивит и артрит характерна для синдрома Рейтера. Болезнь протекает с ремиссиями и повторными атаками. Симптомы чаще возникают последовательно. Вначале появляется уретрит, затем – конъюнктивит, а позже – артрит [9, 38, 39].
Лабораторная диагностика заболеваний, вызванных хламидиями, имеет первостепенное значение в связи с тем, что клинические проявления не патогномоничны, широкое распространение имеют атипичные и бессимптомные формы заболевания [2, 5, 40].
Согласно рекомендациям ВОЗ, следующие ситуации предполагают диагностику урогенитального хламидиоза:
•
Новорожденные при наличии диагностированной хламидийной инфекции у матери.
•
Хронические воспалительные заболевания мочеполовой системы.
• Эктопия шейки матки.
•
Нарушения менструального цикла по типу метроррагий.
• Самопроизвольные и искусственные аборты.
•
Лечебные и диагностические выскабливания слизистых оболочек шейки и тела матки, другие внутриматочные вмешательства.
• Использование внутриматочной контрацепции.
• Частая смена половых партнеров.
• Лихорадка неясного генеза и др.
А также целесообразно проводить исследования на наличие хламидий сексуально-активным девушкам-подросткам, особенно подверженным заражению хламидийной инфекцией, если они часто меняют половых партнеров и не пользуются барьерными методами контрацепции.
Трудности выявления хламидий с помощью светооптической микроскопии связаны с их малыми размерами, а также неспособностью расти на искусственных питательных средах из-за облигатного внутриклеточного паразитизма.
Учитывая, что хламидии обитают внутри клеток цилиндрического эпителия, в качестве материала для исследования используют именно соскобы (а не выделения!) со слизистой оболочки уретры, шеечного канала, прямой кишки, конъюнктивы и др. У новорожденных в качестве материала для исследования используют соскоб с конъюнктивы глаз и задней стенки глотки. У девочек – соскоб из вульвы. Для получения адекватного результата необходимо, чтобы исследуемый материал содержал достаточное количество эпителиальных клеток и минимальное количество слизи и примеси крови. Присутствие в исследуемом материале большого количества слизи и примеси крови может привести как к ложноположительным, так и к ложноотрицательным результатам. Поэтому перед забором материала из цервикального канала тампоном очищают шейку матки от слизи, затем производят соскоб зондом-щеточкой (“scrinet”, “endo-brush”, “Rovers” и т.п.) или ложечкой Фолькмана. Зонд вводят в цервикальный канал на глубину 0,5– 1,5 см. При извлечении зонда необходимо исключить его касание со стенками влагалища.
При взятии материала из уретры рекомендуется воздержаться от мочеиспускания в течение 1,5–2 ч. При наличии гнойных выделений соскоб берется через 15–20 мин после мочеиспускания. Непосредственно перед взятием материала наружное отверстие уретры необходимо обработать стерильным физиологическим раствором. Перед введением зонда в уретру проводят ее массаж о лобковое сочленение. Зонд вводят на глубину 1–1,5 см, затем совершают несколько вращательных движений. У маленьких детей материал для исследования берут только с наружного отверстия уретры.
После взятия материала зонд опускают в пробирку с транспортной средой, несколько раз ротируют и вынимают. Если время транспортировки биологического материала с момента взятия до момента его доставки в лабораторию превышает 2 ч, то пробирку следует заморозить при -20°С. Транспортировку производят в сумке-холодильнике. В замороженном виде биологический материал хранится не более 15 сут.
Среди методов идентификации возбудителя выделяют: морфологические, культуральные, иммунологические и молекулярно-биологические. Методы выявления Chlamydia trachomatis делятся на прямые и непрямые (косвенно указывающие на наличие возбудителя у пациента).
Методы прямого выявления
Морфологические методы основаны на выявлении включений хламидий, а не отдельных микроорганизмов. При окраске по Романовскому–Гимзе ЭТ окрашиваются в красный, а РТ – в синий и голубой цвета. Метод простой, доступный, однако чувствительность его невысока – 15–30%, возбудитель выявляется в основном при свежем нелеченом хламидиозе.
Более высокой специфичностью (50–98%) и чувствительностью (54–95%) обладает иммунофлюоресцентный анализ со специфическими моноклональными антителами, конъюгированными с флюоресцентным красителем (прямой метод), или вторичными антителами, конъюгированными с таким красителем (непрямой метод). Диагноз считается положительным только при выявлении ЭТ хламидий. Оценка результатов субъективна, требует высокого уровня подготовки специалиста.
Применение иммуноферментного анализа позволяет выявлять хламидийный антиген. Учитывая высокую чувствительность (80–95%) и специфичность (90%), он может быть использован в качестве скрининга.
Одним из высокоинформативных методов диагностики генитального хламидиоза является выделение возбудителя на культуре клеток (Hella L-929, Mc-Coy). Обладая высокой специфичностью и почти 100% чувствительностью (так называемый золотой стандарт), тем не менее метод имеет высокую стоимость, трудоемок, срок исполнения длителен. Сущность культурального метода заключается в принудительном заражении монослоя клеток, чувствительных к хламидиям, материалом от больного. Через 48–60 ч, соответственно циклу развития хламидий, клетки фиксируют, обрабатывают специальными реагентами и учитывают результаты под люминесцентным микроскопом (в случае использования иммунофлюоресцентного метода). Результаты учитываются по наличию специфических внутриклеточных хламидийных включений. Культуральный метод позволяет выявлять минимальное количество хламидий, содержащихся в исследуемом материале. Даже одно ЭТ сформирует цитоплазматическое включение, которое намного проще обнаружить, чем само ЭТ. Метод является качественным, достаточно найти хотя бы одно включение, чтобы считать результат положительным.
Определяются только жизнеспособные хламидии, что особенно важно для пациентов, прошедших курс лечения антибактериальными препаратами. Это основное преимущество культурального метода перед всеми другими методами выявления хламидий. Так, например, методы иммунофлюоресценции и полимеразной цепной реакции (ПЦР) позволяют выявлять все формы хламидий, в том числе и погибшие (нежизнеспособные формы хламидий могут сохраняться в тканях до 2 мес), что может служить источником ложноположительных результатов. Метод высокоэффективен, особенно в первые недели после окончания терапии. Его можно использовать в качестве критерия излеченности.
В последние годы широкое распространение получили такие молекулярно-биологические методы, как ПЦР и лигазная цепная реакция (ЛЦР), метод транскрипционного анализа, ДНК-зонды. Последнюю реакцию можно считать методом прямого определения специфической последовательности родительской ДНК. Основными мишенями при выявлении Chlamydia trachomatis являются нуклеотидная последовательность видоспецифической криптической плазмиды, последовательность основного белка внутренней мембраны, рибосомальные гены. Эти диагностические исследования требуют исключительно высокого качества реагентов и четкости соблюдения всех правил – от забора материала до интерпретации полученных результатов. По сравнению с широко используемыми в клинической практике иммунологическими тестами ПЦР-диагностика обладает рядом преимуществ: высокой специфичностью; адекватной чувствительностью, позволяющей диагностировать не только острые, но и латентные инфекции в клинически значимом титре (можно выявлять даже единичные бактерии или вирусы); возможностью идентификации возбудителя в течение 4,5–5 ч. Важной отличительной особенностью ПЦР-диагностики является относительно низкая стоимость оборудования и тест-систем для проведения анализа, которые сочетаются с универсальностью метода.
ПЦР представляет собой многократно повторяющиеся циклы синтеза (амплификации) специфической области ДНК-мишени в присутствии термостабильной ДНК-полимеразы, дезоксинуклеотидтрифосфатов, солевого буфера и олигонуклеотидных затравок (праймеров), определяющих границы амплифицируемого участка.
Методы непрямого выявления
Для подтверждения диагноза и уточнения фазы заболевания рекомендуют использовать методы обнаружения хламидийных антител в сыворотке крови, применяя следующие реакции: связывания комплемента – РСК, непрямой иммунофлюоресценции – РНИФ, микроиммунофлюоресценции – МИФ, а также иммуноферментный анализ – ИФА и рекомбинантный родоспецифический липополисахаридный ИФА – (r-ELISA; Medac, Германия). К тестам нового поколения относятся иммуноферментные диагностические системы на основе синтетических пептидов вариабельной части основного мембранного белка Chlamydia trachomatis, обеспечивающие четкую видовую диагностику хламидиозов. Это особенно важно при восходящей и персистирующей инфекции, которая поддерживает хроническое течение болезни на протяжении нескольких месяцев и даже лет и тем самым повреждает или разрушает ткани и органы.
Острая фаза заболевания характеризуется выработкой IgМ-антител. Уже через 48 ч после заражения можно обнаружить эти антитела в крови, пик IgМ отмечается к 8–10-му дню. Затем концентрация IgМ начинает снижаться. IgA-антитела появляются в этот же период, их можно обнаружить с 10-го дня. Короткий период, в который обнаруживаются и IgA-, и IgМ-антитела, соответствует разгару инфекционного процесса.
На 15–20-й день от начала болезни начинает регистрироваться диагностически значимый уровень IgG, что свидетельствует о переходе в хроническую фазу заболевания.
По мере угасания иммунного ответа происходит снижение титров антител в той же последовательности. Хламидии время от времени высвобождаются из клетки и, таким образом, вызывают образование антител. При реинфекции и реактивации возникает скачкообразный подъем титров IgG и IgA (бустер-эффект). Иммуноглобулины класса М практически отсутствуют. Появление единичных IgA-антител с постоянно низкими титрами в течение длительного времени при бессимптомном течении заболевания свидетельствует о наличии персистенции возбудителя. Постоянно определяемые низкие титры IgG-антител указывают на давно перенесенную хламидийную инфекцию. Выявление специфических IgA- и IgG-антител можно использовать для контроля над эффективностью проводимой терапии: при успешном лечении их титр снижается в 2–3 раза. Для оценки динамики титров антител у пациентов проводят исследование специфических антител с интервалом в 2–3 нед.
При оценке уровня IgМ следует учитывать возможность возникновения перекрестной гуморальной реакции на присутствующие в организме Chlamydia pneumoniе (наборы для определения IgM методом иммуноферментного анализа не обладают видовой специфичностью).
Длительно циркулирующие в низком пограничном титре IgG указывают на перенесенную хламидийную инфекцию.
Окончательная постановка диагноза зависит от определения стадии и типа инфекции, а это, в свою очередь, от присутствия антител определенного класса. Специфичность серологических методов диагностики составляет 92–99%, а чувствительность – 98%.
Верификация диагноза должна основываться на обнаружении Chlamydia trachomatis с помощью двух методов, один из которых – ПЦР.
Прямой иммунофлюоресцентный тест или ПЦР, выполненные ранее 3–4 нед после лечения, могут дать ложноположительные результаты из-за возможного сохранения нежизнеспособных микроорганизмов или их остатков. Если пациентка принимала антибактериальные препараты в течение последних 4–6 нед, проводить исследование нецелесообразно. Лабораторные исследования желательно проводить в одной и той же лаборатории, используя одни и те же диагностические тесты.
Для профилактики рецидивов, реинфекции и осложнений необходимо обследование и лечение половых партнеров, обязательное обследование через 3 и 6 мес после проведенной терапии.
Список литературы
находится в редакции
Источник













