Хирургический способ лечения тройничного нерва
Почти все пациенты вначале хорошо реагируют на лечение карбамазепином. Четкий положительный результат лечения карбамазепином может быть использован как тест, подтверждающий диагноз НТН. Поскольку карбамазепин стимулирует свой собственный метаболизм в печени посредством аутоиндукции, вначале назначается малая доза (100 мг 2 раза в день) с последующим постепенным увеличением во избежание побочных эффектов. Терапевтическая доза карбамазепина варьирует от 200 до 1200 мг в сутки. Следует подбирать самую низкую дозу, позволяющую купировать боль с минимальными побочными эффектами. Определение в крови уровня карбамазепина нецелесообразно. Существует форма выпуска в таблетках с медленным высвобождением, которая позволяет плавно достигать лечебного эффекта у ряда пациентов. Головокружение, пошатывание и сонливость относятся к наиболее распространенным осложнениям в начале лечения.
У пациентов пожилого возраста часто отмечаются затруднения мышления и забывчивость. Из-за потенциально серьезных реакций при взаимодействии с другими лекарствами пациенты должны предварительно обсуждать с врачом назначение любых препаратов во время приема карбамазепина. Наиболее опасны сочетания с пропоксифеном, циметидином, эритромицином и верапамилом. Все эти препараты могут вызвать экстремальное повышение уровня карбамазепина в крови. Карбамазепин часто вызывает легкую лейкопению и небольшие отклонения результатов функциональных тестов печени, что обычно не требует прекращения лечения. В очень редких случаях могут развиваться серьезные изменения костного мозга и печеночная недостаточность.
Окскарбазепин, новый препарат, так же эффективен, как карбамазепин и обладает менее выраженными побочными реакциями в отношении печени, гематопоэза и кожи, однако часто вызывает острую гипонатриемию. Практикующий врач должен тщательно изучить фармакологические особенности карбамазепина и препаратов этой группы, прежде чем назначить их пациенту.
Другие препараты менее эффективны. Самостоятельно или в комбинации с карбамазепином могут быть назначены фенитоин, габапентин, баклофен, клоназепам и ламотриджин.
Оперативное лечение невралгии тройничного нерва.
Примерно 50 % пациентов, получивших вначале облегчение от приема лекарственных препаратов, в дальнейшем нуждаются в хирургическом лечении НТН либо по причине постоянных или рецидивирующих болей, либо вследствие неэффективности препаратов. Некоторые специалисты, незнакомые с методами хирургического лечения, неохотно направляют пациентов для оперативного лечения и продолжают бесполезное лечение несчастных пациентов разнообразными препаратами. Не существует идеальных операций для лечения НТН, однако из большого разнообразия современных методик можно выбрать такую, которая позволит достичь длительного облегчения. К числу факторов, определяющих выбор вида оперативного вмешательства, относятся возраст, состояние здоровья и предпочтения пациента, а также готовность пойти на риск операции и побочных эффектов, опыт и предпочтения хирурга. Ниже приведены наиболее популярные операции по поводу НТН.
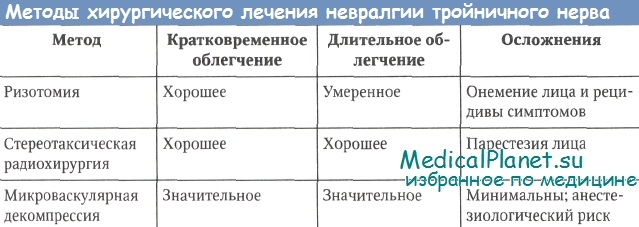
Микрососудистая декомпрессия в задней черепной ямке обычно выполняется пациентам моложе 65 лет, но иногда и более пожилым пациентам с исключительным здоровьем. Это единственная операция, которая устраняет, по мнению хирургов, наиболее распространенную причину НТН. Операция выполняется через малое отверстие в черепе, немного медиальнее сосцевидного отростка. С помощью операционного микроскопа идентифицируется тройничный нерв в том месте, где он покидает ствол мозга. При наличии компрессии или искривления нерва сосудом, маленькая хирургическая губка помещается между нервом и травмирующим сосудом. У отдельных пациентов, если не удается идентифицировать такой сосуд, обычно выполняются маленький разрез или ручная компрессия нерва. Приблизительно у 80 % пациентов после такого вмешательства наступает долгосрочное облегчение болей без сопутствующих нарушений чувствительности в области лица.
Хотя микрососудистая декомпрессия относится к большим нейрохирургическим операциям, смертность при ее выполнении опытными хирургами минимальна.
Источник
Невралгия тройничного нерва

Распространенность невралгии тройничного нерва (НТН) достаточно велика и составляет до 30 — 50 больных на 100 000 населения, а заболеваемость по данным ВОЗ находится в пределах 2 — 4 человек на 10 000 населения. По данным ВОЗ во всем мире невралгией тройничного нерва страдает более 1 миллиона человек.
Чаще это страдание встречается у женщин в правой половине лица в возрасте 50 — 70 лет. Развитию заболевания способствуют различные сосудистые, эндокринно-обменные, аллергические расстройства, а также психогенные факторы. Но чаще всего причину заболевания выяснить не удается.
Терзающие больного атаки болей в области лица (губы, глаза, нос, верхняя и нижняя челюсть, десны, язык) могут возникать спонтанно или провоцироваться разговором, жеванием, чисткой зубов, прикосновением к определенным участкам лица (триггерные точки). Их частота варьирует от единичных до десятков и сотен в день. В период обострения, чаще в холодное время года, приступы учащаются. Боль эта настолько сильна, что больные не могут сосредоточится на чем-то другом. Больные в это время находятся в постоянном напряжении, замыкаются на своих ощущениях и существуют, не замечая ничего вокруг, лишь постоянно ожидая очередного приступа. Иногда больные, не в силах терпеть больше боль, заканчивают жизнь самоубийством. Даже в периоды ремиссий больные живут в страхе, опасаясь обострения заболевания, ходят, закрывая голову даже летом, не прикасаются к больной половине лица, не чистят зубы, не жуют на стороне поражения.
Первое обращение довольно часто происходит не к неврологу, а к стоматологу. Это связано с тем, что зона распространения боли располагается не только на лице, а и в полости рта. Очень часто на пораженной стороне по ошибке удаляют здоровые зубы.
Несмотря на то, что заболевание известно давно, до сих пор нет единого мнения о причинах его возникновения.
В настоящее время многие исследователи полагают, что невралгия может провоцироваться давлением кровеносного сосуда (артерия или вена) на часть нерва, вызывая таким образом изменение оболочки нерва (демиелинизацию). Изменение оболочки нерва в свою очередь приводит к изменению прохождения нервных импульсов, вызывая появление патологической возбудимости нерва и в конечном счете к возникновению боли. Причиной локального изменения оболочки нерва может быть также и давление опухолью на нерв, давление стенкой суженного костного канала, по которому проходит нерв. Оболочка может быть повреждена и при вирусных заболеваниях (герпес) или при рассеянном склерозе.
Лечение невралгии тройничного нерва многообразно. Назначаются противосудорожные препараты, предотвращающие развитие приступа боли (карбамазепин, финлепсин, тегретол), сосудистые препараты, спазмолитики, успокаивающие препараты. Широко применяются физиотерапевтические процедуры (аппликации с парафином, токи Бернара), иглорефлексотерапия.
Для лечения невралгии применяется лазерное излучение накожно по полям в области выхода ветвей тройничного нерва из черепа.
Ряд авторов рекомендуют проведение эфферентных методов терапии (плазмаферез, гемосорбция). Несмотря на разнообразие консервативных методов лечения, включая медикаментозную тарапию, физиолечение, народную медицину, основным методом лечения на сегодняшний день остается хирургический. Операция избавляет больного от боли навсегда или на длительное время. А ведь именно боль и является основной жалобой больного.
Для избавления от боли или уменьшения боли хотя бы на короткое время широко применяются спирт-новокаиновые блокады в точки выхода веточек тройничного нерва на лице. К сожалению, даже при эффективной блокаде ее хватает на короткое время и боли возобновляются. Терапевтическая эффективность повторных блокад уменьшается с каждым разом, продолжительность ремиссии (прекращения болей) также уменьшается.
Поиски наиболее эффективного и безопасного метода хирургического лечения невралгии тройничного нерва продолжаются более столетия. Первые попытки хирургического лечения были предприняты в середине 18 века и часто носили драматический характер, кончаясь летальным исходом. Для воздействия на тройничный нерв проводилась трепанация черепа, часто сопровождающаяся опасными для жизни кровотечениями. После операции у многих больных развивались осложнения, сопровождающиеся парезами, параличами, нарушениями зрения. Даже в 50-60–е годы XX века после операций открытым доступом наблюдался большой процент серьезных осложнений, а послеоперационная смертность достигала 2-3 %. Хирургические методы лечения постепенно совершенствовались, становились все более безопасными.
В настоящее время в мире широко распространены два метода хирургического лечения.
Первый — микроваскулярная декомпрессия корешка тройничного нерва. Микроваскулярная декомпрессия заключается в трепанации задней черепной ямки, ревизии взаимоотношений корешка тройничного нерва, верхней и нижней передних мозжечковых артерий и верхней каменистой вены. При компрессии корешка сосудами их выделяют, а между сосудами и корешком помещают прокладку, предотвращающую контакт между ними и воздействие сосуда на корешок.
Однако сосудисто-нервный конфликт не всегда является причиной заболевания. Кроме того у больных, страдающих тяжелой сопутствующей соматической патологией, и больных в старческом возрасте проведение этой операции рискованно.
В настоящее время у нас и за рубежом одним из наиболее распространенных методов лечения тригеминальной невралгии является чрескожная радиочастотная деструкция корешков тройничного нерва.
Этот метод наиболее эффективен, практически не имеет серьезных осложнений. Радиочастотная деструкция базируется на физическом принципе термокоагуляции и основана на эффекте выделения тепловой энергии при прохождении через биологические ткани токов ультравысокой частоты. Электрод, подключенный к генератору тока, подводится к месту деструкции через изолированную канюлю. Интенсивность нагревания ткани зависит от ее сопротивления. Электрический ток проходит между активным или повреждающим электродом, погруженным в ткани тела, и индифферентным или рассеянным электродом. Теплопродукция, а вследствие этого и разрушение тканей, происходит только вокруг неизолированного кончика активного электрода. Основным преимуществом метода радиочастотной термодеструкции является то, что размер зоны повреждения может быть адекватно проконтролирован, а электрод с термодатчиком регистрирует температуру в зоне повреждения. Существует возможность установки точного времени повреждения, а контроль электростимуляции и уровня сопротивления позволяет правильно и точно установить электрод. Использование местной анестезии обеспечивает короткий восстановительный период, и при необходимости возможны повторные сеансы радиочастотной термодеструкции.
Критериями отбора больных для методики радиочастотной деструкции являются длительность болевого синдрома более 4-12 месяцев; нестойкий эффект или его отсутствие после проводимой медикаментозной терапии; отсутствие грубых нарушений анатомических взаимоотношений в черепе.
Нейрохирурги и в настоящее время продолжают совершенствовать существующие хирургические процедуры, стремясь к идеальной хирургической операции, которая была бы безопасна для больного, навсегда избавляла от боли, не вызывая никаких осложнений.
В последние годы появились новые подходы в лечении невралгии тройничного нерва:
- Стереотаксическая радиохирургия (гамма-нож) — это бескровный метод разрушения чувствительного корешка с помощью фокусированного гамма-излучения.
- Эпидуральная нейростимуляция моторной коры головного мозга: под кость черепа на оболочку мозга устанавливается специальный восьмиконтактный электрод. Регресс боли наступает в пределах нескольких минут и продолжается в течение многих часов после прекращения электрической стимуляции. Эффективность этого метода объясняется увеличением мозгового кровотока в подкорковых структурах.
Таким образом, на сегодняшний день медицина имеет большой набор консервативных и хирургических методов лечения невралгии тройничного нерва.
На начальном этапе заболевания, после стандартного неврологического и общего обследования, рекомендуется медикаментозная терапия, физиотерапия, блокады периферических ветвей тройничного нерва и только через несколько месяцев малоэффективного лечения показан один из нейрохирургических методов лечения.
Показания к каждому из них зависят от длительности заболевания, возраста больного, наличия сопутствующих заболеваний. Успех хирургического лечения зависит от четкой диагностики, тщательного отбора больных и строгого соблюдения хирургических технологий.
В настоящее время активно разрабатываются новые подходы к терапии невралгии тройничного нерва, в частности, неинвазивная стимуляция мозга. Отделение нейрореабилитации и физиотерапии Научного центра неврологии проводит набор пациентов, страдающих невралгией тройничного нерва, в исследование по изучению эффективности навигационной ритмической транскраниальной магнитной стимуляции. Более подробная информация об исследовании.
Источник
Современный подход к лечению тригеминальной невралгии
Тригеминальная невралгия (ТН) (синонимы: tic douloureux, или болезнь Фотергилла) является одной из самых распространенных лицевых болей (прозопалгий) и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [1].
Тригеминальная невралгия (ТН) (синонимы: tic douloureux, или болезнь Фотергилла) является одной из самых распространенных лицевых болей (прозопалгий) и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [1]. ТН является типичным примером нейропатической боли (НБ) пароксизмального характера и считается самым мучительным видом прозопалгии. ТН чаще всего имеет хроническое или рецидивирующее течение, сопровождается большим количеством коморбидных расстройств, гораздо труднее поддается лечению, чем многие другие типы хронической боли и приводит к временной или постоянной нетрудоспособности, что делает ее большой экономической и социальной проблемой [2]. Хроническая НБ оказывает значительное отрицательное воздействие на качество жизни пациентов, вызывая нарушения сна, усиление тревоги, депрессии, снижение повседневной активности [3]. Высокая интенсивность и стойкость ТН, ее особый, часто мучительный характер, резистентность к традиционным методам обезболивания придают этой проблеме исключительную актуальность. Тригеминальная невралгия — заболевание, характеризующееся возникновением приступообразной, обычно односторонней, кратковременной, острой, резкой, интенсивной, напоминающей удар электрическим током, боли в области иннервации одной или нескольких ветвей тройничного нерва [4, 5]. Чаще всего поражение возникает в зоне II и/или III ветви и крайне редко — I ветви n. trigeminus [6].
По данным ВОЗ распространенность ТН составляет до 30–50 больных на 100 000 населения, а заболеваемость — 2–4 человека на 100 000 населения. ТН чаще встречается у женщин, чем у мужчин, дебютирует на пятом десятилетии жизни и в 60% случаев имеет правостороннюю локализацию [7, 8].
Согласно Международной классификации головных болей (2-е издание), предложенной Международным обществом головной боли (2003), ТН подразделяется на классическую, вызванную компрессией тригеминального корешка извилистыми или патологически измененными сосудами, без признаков явного неврологического дефицита, и симптоматическую, вызванную доказанным структурным повреждением тройничного нерва, отличным от сосудистой компрессии [9].
Наиболее частой причиной возникновения ТН является компрессия проксимальной части тригеминального корешка в пределах нескольких миллиметров от входа корешка в мост мозга (т. н. «входная зона корешка»). Примерно в 80% случаев происходит компрессия артериальным сосудом (чаще всего патологически извитой петлей верхней мозжечковой артерии). Этим объясняется тот факт, что ТН возникает в пожилом и старческом возрасте и практически не встречается у детей. В остальных случаях таковая компрессия вызвана аневризмой базилярной артерии, объемными процессами в задней черепной ямке, опухолями мостомозжечкового угла и бляшками рассеянного склероза [1, 8, 10, 11].
На экстракраниальном уровне основными факторами, приводящими к возникновению ТН, являются: туннельный синдром — компрессия в костном канале, по которому проходит нерв (чаще в подглазничном отверстии и нижней челюсти), связанная с его врожденной узостью, присоединением сосудистых заболеваний в пожилом возрасте, а также в результате хронического воспалительного процесса в смежных зонах (кариес, синуситы); местный одонтогенный или риногенный воспалительные процессы. Развитие ТН может провоцироваться инфекционными процессами, нейроэндокринными и аллергическими заболеваниями, демиелинизацией корешка тройничного нерва при рассеянном склерозе [7, 12].
В зависимости от воздействия патологического процесса на соответствующий отдел тригеминальной системы выделяют ТН преимущественно центрального и периферического генеза. В возникновении ТН центрального генеза большую роль играют нейроэндокринные, иммунологические и сосудистые факторы, которые приводят к нарушению реактивности корково-подкорковых структур и формированию очага патологической активности в ЦНС. В патогенезе ТН периферического уровня большую роль играют компрессионный фактор, инфекции, травмы, аллергические реакции, одонтогенные процессы [7, 8, 12].
Несмотря на появившееся в последние годы большое количество обзоров литературы и метаанализов, посвященных проблеме лечения НБ [13], к которой относится и ТН, среди исследователей не существует единого мнения относительно основных принципов медикаментозной терапии этого заболевания [14]. Лечение нейропатической боли все еще остается недостаточно эффективным: менее чем у половины пациентов отмечается значительное улучшение в результате проведенного фармакологического лечения [15, 16].
Проблема терапии тригеминальной невралгии на сегодняшний день остается не до конца решенной, что связано с неоднородностью данного заболевания в отношении этиологии, патогенетических механизмов и симптоматики, а также с малой эффективностью обычных анальгетических средств и развитием фармакорезистентных форм ТН, требующих проведения хирургического лечения. В современных условиях лечебная тактика при данном заболевании включает в себя медикаментозные и хирургические методы.
Основными направлениями медикаментозной терапии являются: устранение причины ТН, если она известна (лечение больных зубов, воспалительных процессов смежных зон и др.), и проведение симптоматического лечения (купирование болевого синдрома).
Патогенетическое лечение больных с ТН включает применение препаратов нейрометаболического, нейротрофического, антиоксидантного, антигипоксантного действия. В последние годы обнаружена высокая эффективность использования метаболических препаратов в комплексном лечении НБ [8, 17]. При лечении пациентов с ТН показана высокая эффективность препарата метаболического действия Актовегина — депротеинизированного деривата из крови молодых телят. Основное действие этого препарата заключается в стабилизации энергетического потенциала клеток за счет повышения внутриклеточного транспорта и утилизации глюкозы и кислорода. Актовегин обладает также антигипоксическим эффектом, являясь непрямым антиоксидантом. Кроме того, действие Актовегина проявляется непрямым вазоактивным и реологическим эффектами за счет повышения капиллярного кровотока, снижения периферического сосудистого сопротивления и улучшения перфузии органов и тканей [17]. Такой широкий спектр фармакологического действия Актовегина позволяет использовать его в терапии ТН. В период приступа целесообразно применение Актовегина внутривенно медленно струйно или капельно в течение 10 дней в дозе 400–600 мг/сутки. В межприступном периоде препарат назначается внутрь в дозе 200 мг 3 раза в сутки на протяжении 1–3 месяцев [8]. К патогенетическому лечению больных с ТН можно отнести применение высоких доз витаминов группы B в составе поликомпонентных препаратов, что обусловлено их полимодальным нейротропным действием (влиянием на обмен веществ, метаболизм медиаторов, передачу возбуждения в нервной системе), а также способностью существенно улучшать регенерацию нервов. Кроме того, витамины группы B обладают анальгезирующей активностью. К таким препаратам, в частности, относятся Мильгамма, Нейромультивит, Нейробион, содержащие сбалансированную комбинацию тиамина (B1), пиридоксина (B6), цианокобаламина (B12). Витамин B1 устраняет ацидоз, снижающий порог болевой чувствительности; активирует ионные каналы в мембранах нейронов, улучшает эндоневральный кровоток, повышает энергообеспечение нейронов и поддерживает аксоплазматический транспорт белков. Эти эффекты тиамина способствуют регенерации нервных волокон [18–20]. Витамин B6, активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов, проявляя тем самым нейротропный эффект. Восстановление синтеза ряда медиаторов (серотонина, норадреналина, дофамина, гамма-аминомасляной кислоты (ГАМК) и активация нисходящих тормозных серотонинергических путей, входящих в антиноцицептивную систему, приводит к снижению болевой чувствительности (антиноцицептивное действие пиридоксина) [18, 21]. Витамин B12 участвует в процессах регенерации нервной ткани, активируя синтез липопротеинов, необходимых для построения клеточных мембран и миелиновой оболочки; уменьшает высвобождение возбуждающих нейротрансмиттеров (глутамата); обладает противоанемическим, гемопоэтическим и метаболическим эффектом [18, 22]. Для быстрого купирования боли и патогенетического нейротропного воздействия при ТН целесообразно использование парентеральной формы препарата Нейробион — комбинированного препарата витаминов группы B, содержащего оптимальное количество витамина B12 как в ампулированной, так и в таблетированной форме. Нейробион применяется в дозе 3 мл в сутки внутримышечно 2–3 раза в неделю — 10 инъекций (при выраженном болевом синдроме можно применять ежедневно в той же дозировке в течение 10–15 дней). Затем для усиления, пролонгирования терапевтического эффекта и профилактики рецидива заболевания назначается Нейробион в таблетированной форме в дозировке по 1 таблетке внутрь 3 раза в день в течение 1–2 месяцев [8].
Также препаратами выбора для лечения ТН являются антиконвульсанты, а карбамазепин стал одним из первых препаратов, официально зарегистрированных для лечения этого состояния [24].
В начале 90-х годов прошлого столетия появилась новая генерация противоэпилептических препаратов, и теперь антиконвульсанты обычно делят на препараты первого и второго поколения.
К антиконвульсантам первого поколения относятся фенитоин, фенобарбитал, примидон, этосуксимид, карбамазепин, вальпроевая кислота, диазепам, лоразепам, клоназепам. Препараты первого поколения практически не рассматриваются в качестве первой линии терапии НБ (за исключением карбамазепина при ТН) из-за недостаточного уровня обезболивающего эффекта и высокого риска возникновения нежелательных реакций. К наиболее частым побочным эффектам антиконвульсантов первого поколения относятся: реакции со стороны ЦНС (сонливость, головокружение, атаксия, седативный эффект или повышенная возбудимость, диплопия, дизартрия, когнитивные расстройства, ухудшение памяти и настроения), гематологические нарушения (агранулоцитоз, апластическая анемия, тромбоцитопения, лейкопения), гепатотоксичность, снижение минеральной плотности кости, кожные высыпания, гиперплазия десен, симптомы со стороны желудочно-кишечного тракта (рвота, анорексия). К антиконвульсантам второго поколения относятся прегабалин (Лирика), габапентин (Нейронтин, Габагамма, Тебантин), ламотриджин (Ламиктал), окскарбазепин (Трилептал), топирамат (Топамакс), леветирацетам (Кеппра), тиагабин (Габитрил), зонисамид (Зонегран), вигабатрин (Сабрил), фелбамат (Талокса). Эти препараты имеют более благоприятные фармакокинетические характеристики и профили безопасности, а также низкий риск лекарственных взаимодействий по сравнению с антиконвульсантами первого поколения [24, 25].
Основные механизмы действия антиконвульсантов 1-го и 2-го поколения представлены в таблице [26].
Первым антиконвульсантом, успешно используемым для лечения ТН, был фенитоин (Дифенин) [27]. Дифенин, производное гидантоина, близкого по химической структуре к барбитуровой кислоте, противопоказан при тяжелых заболеваниях почек, печени, сердечной недостаточности.
Согласно рекомендациям Европейской федерации неврологических сообществ (2009) фармакотерапия ТН основана, прежде всего, на использовании предложенного С. Блюмом в 1962 году карбамазепина (Финлепсина, Тегретола) (200–1200 мг/сутки), который является препаратом первого выбора (уровень доказательности A) [27, 28]. Противоболевое действие этого препарата обусловлено, главным образом, его способностью уменьшать проницаемость для натрия мембран нейронов, участвующих в ноцицептивных реакциях. Обычно назначается следующая схема лечения карбамазепином. В первые два дня суточная доза составляет 200 мг (по 1/2 таблетки утром и вечером), затем в течение двух дней суточная доза увеличивается до 400 мг (утром и вечером), а после этого — до 600 мг (по 1 таблетке утром, в обед и вечером). Если эффект недостаточный, то общее количество препарата в сутки может быть доведено до 800–1000 мг. У части больных ТН (около 15% в популяции) карбамазепин не оказывает анальгезирующего воздействия, поэтому в таких случаях применяется другой антиконвульсант — фенитоин.
Проведенные около 40 лет назад три плацебо-контролируемые исследования, которые включали в себя в общей сложности 150 пациентов с ТН, показали эффективность карбамазепина в отношении как частоты, так и интенсивности пароксизмов [24]. Рядом авторов было показано, что карбамазепин может уменьшить болевую симптоматику приблизительно в 70% случаев. [29]. Однако применение карбамазепина ограничено фармакокинетическими факторами и возникающими в ряде случаев тяжелыми побочными эффектами (например, синдром Стивенса–Джонсона), особенно у пожилых пациентов.
Окскарбазепин (Трилептал) имеет структурное сходство с карбамазепином, но гораздо лучше переносится пациентами и имеет гораздо меньше побочных эффектов. Обычно окскарбазепин используется в начале лечения ТН в дозе 600–1800 мг/сутки (уровень доказательности B) [30].
В качестве дополнительной терапии ТН показана эффективность ламотриджина (Ламиктала) в дозе 400 мг/сутки [31] и баклофена в дозе 40–80 мг/сутки [32], которые относятся к препаратам второй линии (уровень доказательности C). Малые открытые исследования (класс IV) свидетельствуют об эффективности применения клоназепама, вальпроата, фенитоина [33, 34]. Указанная терапия наиболее эффективна при классической форме ТН. При ТН периферического генеза в схемы лечения предпочтительно включать ненаркотические анальгетики, а в случае развития хронического болевого синдрома (более трех месяцев) показано назначение антидепрессантов (амитриптилин) [7, 12].
Габапентин (Нейронтин) — первый в мире препарат, который был зарегистрирован для лечения всех видов нейропатической боли. Во многих исследованиях была показана эффективность габапентина у больных с ТН, не отвечающих на лечение другими средствами (карбамазепин, фенитоин, вальпроаты, амитриптилин); при этом в большинстве случаев наблюдалось полное купирование болевого синдрома [35]. Терапевтическая доза составляет от 1800 до 3600 мг/сутки. Препарат принимают 3 раза в сутки по следующей схеме: 1-я неделя — 900 мг/сутки, 2-я неделя — 1800 мг/сутки, 3-я неделя — 2400 мг/сутки, 4-я неделя — 3600 мг/сутки.
Недавно были опубликованы результаты открытого проспективного 12-месячного исследования 53 пациентов с ТН, в котором оценивалась эффективность прегабалина (Лирики) в дозе 150–600 мг/сутки. Лечение прегабалином привело к обезболиванию или, по крайней мере, к 50%-му снижению интенсивности боли у 25% и 49% пациентов соответственно [36]. В другом мультицентровом проспективном 12-недельном исследовании 65 больных, резистентных к предшествующей анальгетической терапии, лечение прегабалином в средней дозе 196 мг/сутки (в подгруппе монотерапии) и 234 мг/день (в подгруппе политерапии) приводило к уменьшению интенсивности боли ≥ 50% в среднем у 60% больных, а также уменьшало степень выраженности тревоги, депрессии и нарушений сна [37]. При лечении ТН начальная доза прегабалина может составлять 150 мг/сутки в 2 приема. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сутки через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сутки) через 7-дневный интервал.
Впервые об использовании леветирацетама (Кеппра) при лечении ТН сообщили в 2004 году K. R. Edwards et al. [38]. Механизм действия леветирацетама неизвестен; имеются данные, полученные в экспериментах на животных, что он является селективным блокатором N-типа кальциевых каналов [39]. Свойства этого препарата особенно подходят для лечения пациентов с ТН с тяжелой болью, нуждающихся в быстром ответе на терапию. Фармакокинетика леветирацетама линейна и предсказуема; концентрация в плазме крови увеличивается пропорционально дозе в пределах клинически обоснованного диапазона от 500 до 5000 мг [40]. В отличие от других антиконвульсантов, особенно карбамазепина, в метаболизм леветирацетама не вовлечена система печеночного цитохрома Р450 и препарат экскретируется через почки [41]. Кроме того, данный препарат характеризуется благоприятным терапевтическим индексом и имеет незначительное число неблагоприятных побочных эффектов (что является основной проблемой при использовании препаратов для лечения ТН) [42]. Побочными эффектами леветирацетама, о которых обычно сообщают, являются: астения, головокружение, сонливость, головная боль и депрессия. В 10-недельном проспективном открытом исследовании показано, что для лечения ТН по сравнению с терапией эпилепсии были необходимы более высокие дозы леветирацетама, составляющих 3000–5000 мг/день (50–60 мг/кг/день), которые, тем не менее, не вызвали значительных побочных эффектов. Это обстоятельство свидетельствует о перспективе использования этого лекарственного средства для лечения ТН [43].
В одном отечественном исследовании отмечены положительные результаты при комбинации карбамазепина и габапентина [44].
С 1970-х годов прошлого столетия для лечения ТН стали использовать антидепрессанты [45]. В настоящее время доказана эффективность использования трициклических антидепрессантов (ТЦА) при лечении ТН [46].
До настоящего времени подбор анальгезирующей терапии НБ является скорее искусством, чем наукой, поскольку выбор препаратов осуществляется в основном эмпирически. Нередки ситуации, когда применение одного препарата оказывается недостаточно эффективным и возникает потребность в комбинации лекарственных средств. Назначение «рациональной полифармакотерапии» (одновременное применение препаратов, обладающих нейротропным, нейрометаболическим и анальгезирующим механизмами действия) позволяет повысить эффективность лечения при меньших дозировках препаратов и меньшем количестве побочных эффектов [47].
Пациентам, длительно страдающим от непереносимой боли, и при неэффективности консервативной терапии в случае классической ТН рекомендуется хирургическое лечение. В настоящее время используются следующие подходы:
1) хирургическая микроваскулярная декомпрессия [48];
2) стереотаксическая лучевая терапия, гамма-нож [49];
3) чрескожная баллонная микрокомпрессия [50];
4) чрескожный глицериновый ризолизис [51];
5) чрескожное радиочастотное лечение Гассерова узла [52].
Наиболее эффективным методом хирургического лечения ТН является метод P. Janetta, заключающийся в размещении специальной прокладки между тройничным нервом и раздражающим сосудом; в отдаленном периоде эффективность лечения составляет 80% [53–55].
В заключение заметим, что лечение ТН должно носить мультидисциплинарный характер, при этом c пациентом должны быть обсуждены выбор различных методов лечения и риски возможных осложнений.
Литература
- Карлов В. А. Неврология лица. М.: Медицина, 1991. 288 с.
- O’Connor A. B. Neuropathic pain: quality-of-life impact, costs and cost effectiveness of therapy // Pharmacoeconomics. 2009. Vol. 27, № 2. P. 95–112.
- Jensen M. P., Chodroff M. J., Dworkin R. H. The impact of neuropathic pain on health-related quality of life: review and implications // Neurology. 2007. Vol. 68. P. 1178–1182.
- Болевые синдромы в неврологической практике. Под ред. А. М. Вейна. М.: МЕДпресс-информ, 2001. 368 с.
- Love S., Coakham H. B. Trigeminal neuralgia: pathology and pathogenesis // Brain. 2001. Vol. 124, № 12. P. 2347–2360.
- Турбина Л. Г., Гордеев С. А., Зусьман А. А. Тригеминальная невралгия. Эпидемиология, патогенез, клиника, диагностика, лечение // Сборник трудов Московской областной ассоциации неврологов «Всемирный день инсульта в Подмосковье 29 октября 2009 г. »: Сб. статей. М., 2009. С. 65–70.
- Грицай Н. Н., Кобзистая Н. А. Классическая невралгия тройничного нерва и одонтогенный болевой синдром // Новости медицины и формации. 2009. № 299. С. 23–25.
- Товажнянская Е. Л. Невралгия тройничного нерва: современные аспекты комплексной терапии // Междунар. неврол. журн. 2010. № 3 (33). С. 141–145.
- Международная классификация головных болей. 2-е издание. М.: «ГлаксоСмитКляйн Трейдинг», 2003. 380 с.
- Kress B., Schindler M., Rasche D. MRI volumetry for the preoperative diagnosis of trigeminal neuralgia // Eur. Radiol. 2005. Vol. 15. P. 1344–1348.
- Rasche D., Kress B., Stippich C. et al. Volumetric measurement of the pontomesencephalic cistern in patients with trigeminal neuralgia and healthy controls // Neurosurgery. 2006. Vol. 59. P. 614–620.
- Степанченко А. В. Типичная невралгия тройничного нерва. М.: Изд. Группа «ВХМ», 1994. 39 с.
- Saarto T., Wiffen P. J. Antidepressants for neuropathic pain // Cochrane Database Syst. Rev. 2007. Vol. 4: CD005454.
- Chong M. S., Bajwa Z. H. Diagnosis and treatment of neuropathic pain // J. Pain Symptom Manage. 2003. Bd. 25. (Suppl. 5). S. 4–11.
- Dworkin R. H., Backonja M., Rowbotham M. C. et al. Advances in neuropathic pain: diagnosis, mechanism, and treatment recommendation // Arch. Neurol. 2003. Vol. 60. P. 1524–1534.
- Finnerup N. B., Otto M., McQuay H. J. et al. Algorithm for neuropathic pain treatment: an evidence based proposal // Pain. 2005. Vol. 118, № 3. P. 289–305.
- Аметов А. С., Дадаева Е. Е., Строков И. А. с соавт. Актовегин в лечении заболеваний центральной и периферической нервной системы // Рус. мед. журн. 2007. Т. 15, № 24. С. 1824–1827.
- Луцкий И. С., Лютикова Л. В., Луцкий Е. И. Витамины группы B в неврологической практике // Междунар. неврол. журн. 2008. № 2. С. 89–93.
- Ba A. Metabolic and structural role of thiamine in nervous tissues // Cell. Mol. Neurobiol. 2008. Vol. 28. P. 923–931.
- Gibson G. E., Blass J. T. Thiamin-dependent processes and treatment strategies in neurodegeneration // Antioxid. Redox Signal. 2007. Vol. 9. P. 1605–1619.
- Wilson R. G., Davis R. E. Clinical chemistry of vitamin B6 // Adv. Clin. Chem. 1983. Vol. 23. P. 1–68.
- Solomon L. R. Disorders of cobalamin (vitamin B12) metabolism: emerging concept in patophysiology, diagnosis and treatment // Blood Rev. 2007. Vol. 21. P. 113–130.
- Тригеминальная невралгия. Интернет-обзор // Междунар. неврол. журн. 2010. № 2 (32). С. 103–104.
- Wiffen P. J., McQuay H. J., Moore R. A. Carbamazepine for acute and chronic pain. Cochrane Database Syst. Rev. 2005. Vol. 3: CD005451.
- Richter R. W., Portenoy R., Sharma U. et al. Relief of diabetic peripheral neuropathy with pregabalin: a randomised placebo-controlled trial // J. Pain. 2005. Vol. 6. P. 253–260.
- Кукушкин М. Л. Неврогенная (Невропатическая боль) // Междунар. неврол. журн. 2007. № 2 (12). С. 141–145.
- Sindrup S. H., Jensen T. S. Pharmacotherapy of trigeminal neuralgia // Clin. J. Pain. 2002. Vol. 18. P. 22–27.
- Jorns T. P., Zakrzewska J. M. Evidence-based approach to the medical management of trigeminal neuralgia // Br. J. Neurosurg. 2007. Vol. 21. P. 253–61.
- Gronseth G., Cruccu G., Alksne J. et al. Practice parameter: the diagnostic evaluation and treatment of trigeminal neuralgia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the European Federation of Neurological Societies // Neurology. 2008. Vol. 71. P. 1183–1190.
- Jensen T. S. Anticonvulsants in neuropathic pain: rationale and clinical evidence // European Journal of Pain. 2002. Vol. 6 (Suppl. A). P. 61–68.
- Zakrzewska J. M., Chaudhry Z., Nurmikko T. J. et al. Lamotrigine (lamictal) in refractory trigeminal neuralgia: results from a double-blind placebo controlled crossover trial // Pain. 1997. Vol. 73. P. 223–230.
- Fromm G. H., Terrence C. F. Comparison of L-baclofen and racemic baclofen in trigeminal neuralgia // Neurology. 1987. Vol. 37. P. 1725–1728.
- Камчатов П. В. Невропатическая боль: проблемы и решения // НейроNEWS. 2009. № 4. С. 45–47.
- Attal N., Cruccu G., Haanpaa M. et al. EFNS guidelines on pharmacological treatment of neuropathic pain // European Journal of Neurology. 2006. Vol. 13. P. 1153–1169.
- Cheshire W. Defining the role for gabapentin in the treatment of trigeminal neuralgia: a retrospective study // J. Pain. 2002. Vol. 3. P. 137–142.
- Obermann M., Yoon M. S., Sensen K. et al. Efficacy of pregabalin in the treatment of trigeminal neuralgia // Cephalalgia. 2008. Vol. 28. P. 174–181.
- Perez C., Navarro A., Saldana M. T. et al. Patient-reported outcomes in subjects with painful trigeminal neuralgia receiving pregabalin: evidence from medical practice in primary care settings // Cephalalgia. 2009. Vol. 29. P. 781–790.
- Edwards K. R., O’Connor J. T., Button J. Levetiracetam for the treatment of trigeminal neuralgia // Epilepsia. 2004. Vol. 45 (Suppl. 7). P. 306.
- Lukyanetz E. A., Shkryl V. M., Kostyuk P. G. Selective blockade of N-type calcium channels by levetiracetam // Epilepsia. 2002. Vol. 43. P. 9–18.
- Patsalos P. N. Pharmacokinetic profile of levetiracetam: toward ideal characteristics // Pharmacol. Ther. 2000. Vol. 85. P. 77–85.
- Brockmoller J., Thomsen T., Wittstock M. et al. Pharmacokinetics of levetiracetam in patients with moderate to severe liver cirrhosis (Child-Pugh classes A, B, and C): characterization by dynamic liver function tests // Clin. Pharmacol. Ther. 2005. Vol. 77. P. 529–541.
- Zakrzewska J. M. Consumer views on management of trigeminal neuralgia // Headache. 2001. Vol. 41. P. 369–376.
- Jorns T. P., Johnston A., Zakrzewska J. M. Pilot study to evaluate the efficacy and tolerability of levetiracetam (Keppra®) in treatment of patients with trigeminal neuralgia // European Journal of Neurology. 2009. Vol. 16. P. 740–744.
- Степанченко А. В., Шаров М. Н. Применение габапентина при лечении обострений невралгии тройничного нерва // Боль. 2005. Т. 3, № 8. С. 58–61.
- Braune S. Evidence-based pharmacotherapy of neuropathic pain syndromes // MMW Fortschr. Med. 2004. Vol. 146, № 50. P. 49–51.
- Cruccu G. Treatment of painful neuropathy // Curr. Opin. Neurol. 2007. Vol. 20, № 5. P. 531–535.
- Hall G. C., Carroll D., Parry D., McQuay H. J. Epidemiology and treatment of neuropathic pain: The UK primary care perspective // Pain. 2006. Vol. 122. P. 156–162.
- Janetta P. Trigeminal neuralgia: treatment bymicrovascular decompression // Neurosurgery/Eds. Wilkins R., Regachary S. New York: McGrawy-Hill, 1996. P. 3961–3968.
- Perez C., Galvez R., Huelbes S. et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component // Health Qual Life Outcomes. 2007. Vol. 5. P. 66.
- Mullan S., Lichtor T. Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia // J. Neurosurg. 1983. Vol. 59. P. 1007–1012.
- Hakanson S. Trigeminal neuralgia treated by the injection of glycerol into the trigeminal cistern // Neurosurgery. 1981. Vol. 9. P. 638–646.
- Sweet W. H., Wepsic J. G. Controlled thermocoagulation of trigeminal ganglion and root for differential destruction of pain fibers. Part I: trigeminal neuralgia // J. Neurosurg. 1974. Vol. 39. P. 143–156.
- Barker F. G., Jannetta P. J., Bissonette D. J. et al. The long-term outcome of microvascular decompression for trigeminal neuralgia // N. Engl. J. Med. 1996. Vol. 334. P. 1077–1083.
- Tyler-Kabara E. C., Kassam A. B., Horowitz M. H. et al. Predictors of outcome in surgically managed patients with typical and atypical trigeminal neuralgia: Comparison of results following microvascular decompression // J. Neurosurg. 2002. Vol. 96. P. 527–531.
- Jannetta P. J. Microsurgical management of trigeminal neuralgia // Arch. Neurol. 1985. Vol. 42. P. 800.
*Первый МГМУ им. И. М. Сеченова, **МОНИКИ им. М. Ф. Владимирского, Москва
Источник

.gif)



