- Решение задач по химии в 8 классе электронный образовательный ресурс по химии (8 класс)
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Конспект урока по химии Решение расчётных задач по химическим уравнениям реакций. (8 класс)
- Типовые задачи по химии за курс 8 класса
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Общая информация
- Похожие материалы
- Рабочая программа по химии 10 класс
- Рабочая программа по химии 11 класс.(учебник Габриелян О.С.)
- Рабочая программа по химии 10 класс.(учебник Габриелян О.С.)
- Рабочая программа по химии 9 класс.(учебник Габриелян О.С.)
- Рабочая программа по химии 8 класс.(учебник Габриелян О.С.)
- Химический практикум для 8 класса
- Задачи по химии на тему » Химические элементы»(8 класс)
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Решение задач по химии в 8 классе
электронный образовательный ресурс по химии (8 класс)
Учимся решать задачи. Тема «Количество вещества. Молярный объем газов». Химия, 8 класс
Скачать:
| Вложение | Размер |
|---|---|
| uchimsya_reshat_zadachi_8kl.docx | 129.73 КБ |
Предварительный просмотр:
Учимся решать задачи 8 класс
Решение задач по теме: «Моль. Количество вещества».
n- количество вещества, ( моль , кмоль, ммоль)
m – масса, ( г , кг, мг)
M – молярная масса, ( г/ моль , кг/ кмоль, мг/ ммоль)
V – объем, ( л , м 3 , см 3 , мл)
V м – молярный объем ( л/ моль , м 3 / кмоль, мл/ ммоль) для любого газа при нормальных условиях (н.у.) равен 22,4 л/моль
N- число частиц (атомы, молекулы, ионы)
N А- постоянная Авогадро равна 6,02 . 10 23 частиц . моль -1
n= m/M n= V/V M n= N/N A
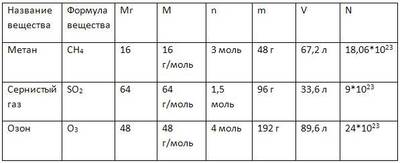
Задача 1 . Сколько молекул озона О 3 содержится в 72 г его?
1) n (О 3 )=m/ M= 72г:48г/моль=1,5моль
M(О 3 )=16 . 3= 48 г/моль
2) N (О 3 )=n N A = =1,5моль . 6,02 . 10 23 молекул . моль -1 =9 . 10 23 молекул
Ответ: N (О 3 )= 9 . 10 23 молекул
Задача 2. Какой объем занимают (при н.у.) 280 кг азота?
- n (N 2 )=m/ M= 280кг:28кг/ кмоль =10кмоль
M (N 2 ) = 14 . 2= 28 г/моль= 28кг/ кмоль
- V (N 2 )= n . V м =10кмоль . 22,4м 3 / кмоль=224 м 3
Ответ: V (N 2 )= 224 м 3
Задача 3 . Какую массу имеют 112л (при н.у.) углекислого газа?
- n (СО 2 )=V/ V м = 112л/ 22,4л/моль= 5 моль
- m (СО 2 ) = n . M= 5моль?(12+16 . 2) г/ моль= 5 . 44=220г
Ответ: m (СО 2 ) =220г
Решите самостоятельно задачи:
1. Хлориду натрия массой 5,85 г соответствует количество вещества:
1) 1 моль; 2) 0,5 моль; 3) 0,1 моль; 4 ) 0,01 моль.
2. Оксиду кальция массой 28 г соответствует количество вещества:
1) 1 моль; 2) 0,1 моль; 3 )2 моль; 4) 0,5 моль.
3. Масса 0,25 моль хлорида меди (II) равна:
1) 64 г; 2) 24,75 г; 3) 24,875 г; 4) 33,75 г.
4. Какой объем при н.у. занимают 64г оксида серы (IV)?
5 . Какую массу имеют 3 • 10 24 молекул углекислого газа (оксида углерода (IV))?
6. Какую массу имеют 44,8 л при н.у. угарного газа (оксид углерода (II))?
7. Какой объем занимают 6 • 10 23 молекул сероводорода H 2 S?
9. Какой объем при н.у. занимают 96г озона О 3 ?
10 . Сколько молекул хлора CI 2 cодержится в 284г его?
Тема: Молярный объём газов
1. 1 моль любого газа при н. у. занимает одинаковый объём, равный 22,4 л. Этот объём называется молярный и обозначается Vm.
2. Количество вещества (n) — отношение объёма газа при н. у. к молярному объёму:
n = V/Vm=> Vm измеряется в л/моль.
3. Следовательно, количество вещества
4. Дополните таблицу «Количественные характеристики веществ», делая необходимые вычисления.
5. Придумайте условие задачи, в которой нужно найти число молекул N, если известен объём V.
Найти число частиц оксида азота(II), если его объём равен 67,2 л.
Решите задачу любым способом.
6. Вычислите массу 78,4 л (н. у.) хлора.
7. Найдите объём 297 г фосгена (COCl2).
8. Вычислите массу 56 л аммиака, 10% -й водный раствор которого в медицине известен под названием «нашатырный спирт».
По теме: методические разработки, презентации и конспекты
Решение задач по химии 8 класс
Письменная работа (с ответами) по химии 8 класс состоит из 5 вариантов.
решение задачи по химии по теме кремний химия 9 класс
химия 9 класс учебник страница 185 № 3 решение задачи по теме кремний.
Элективный курс по химии 10-11 классы «Алгебраический метод решения задач по химии»
Элективный курс по химии 10-11 классы «Алгебраический метод решения задач по химии» Программа предназначена для учащихся 10—11-х классов, выбравших естественнонаучный (химия) профиль обучения в с.
Решение задач по химии 9 класс
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ.
Элективный курс по химии 10 класс «Решение задач по химии»
Элективный курс по химии 10 класс «Решение задач по химии».
Самостоятельная работа по курсу «Решение задач по химии » 11 класс.(вывод формулы вещества)
В данной работе подобраны основные типовые задачи, встречающиеся в ЕГЭ по химии.
Презентация на тему: «Решение задач по химии». 8 класс.
В презентации присутствует алгоритм решения задач по химии для учащихся 8 класса по теме «Массовая доля вещества".
Источник
Конспект урока по химии Решение расчётных задач по химическим уравнениям реакций. (8 класс)
Урок № 17. Тема урока: Решение расчётных задач по химическим уравнениям реакций.
Планируемые результаты обучения:
Личностные. Оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья; формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды.
Предметные. Знать алгоритмы решения химических задач. Уметь вычислять по заданным химическим уравнениям массу или количество вещества по известному количеству вещества или по известной массе одного из вступающих в реакцию или получающихся в результате реакции веществ.
Метапредметные. Р. Определение учебных задач, организация рабочего места. Использование информации для решения задач, формулирование проблемы и способов её решения. П. Определение объектов анализа, оперирование понятиями. К. Выслушивать мнения других, владение различными формами устных и публичных выступлений, оценка разных точек зрения.
Основные понятия: К оличество ве щества, моль, число Авогадро. Молярная масса, молекулярная масса. Расчёты по фор муле массы, количества вещества, числа структурных частиц.
Практическое задание: решение задач по теме.
Организационный момент . Приветствие. Проверка готовности к уроку.
I этап. Проблемная ситуация и актуализация знаний.
1. Вводное слово учителя. Мы продолжаем знакомиться с первоначальными химическими понятиями. Вспомните, в чём измеряется масса атомов и молекул? В чём мы измеряем массу веществ в повседневной жизни?
Как вы думаете, если на каком-либо производстве нужно получить определённое количество вещества в результате реакции, то можно ли определить, сколько веществ нужно взять для этой реакции?
(Другими словами: на заводе хотят из воды получить 320 кг. кислорода; сколько понадобится воды, для получения такой массы кислорода?)
Каковы ваши предложения?
2. Обсуждение вопроса, выдвижение предположений, гипотез, их запись на доске.
3. Совместная постановка темы («Решение расчётных задач по химическим уравнениям реакций»), целей и задач урока (научиться решать незнакомые задачи).
II этап. Решение проблемной ситуации.
1. Слово учителя. Рассказ (кратко) о решении расчётных химических задач.
Расчетные химические задачи являются арифметическими. Решение таких задач строится на использовании прямо пропорциональной зависимости между четырьмя величинами: две из них даются в условии задачи, две другие определяются по уравнению химической реакции (учащиеся умеют составлять и решать пропорцию).
Необходимо обратить внимание учеников на то, что коэффициенты в уравнении реакции показывают количество взятых и полученных веществ. Следует также обратить внимание на то, что при выборе величин, по которым будет производиться расчет, необходимо использовать для каждого вещества одинаковые единицы измерения (как по условию задачи, так и по уравнению реакции).
2. Слово учителя. Сейчас мы вместе попробуем решить нашу задачу.
С чего мы начинаем решение каждой задачи? Правильно, с оформления «Дано». Итак, что дано?
3. По подсказкам учеников учитель оформляет «Дано» на доске:
m ( O 2 ) = 320 кг.
4. Вопрос учителя. Как вы думаете, что делать дальше?
Для решения подобной задачи нужно составить уравнение реакции:
m ( O 2 ) = 320 кг. Составляем уравнение реакции:
5. Слово учителя. Мы составили уравнение, остаётся провести расчёты и найти ответ.
А. Для этого нужно определить молекулярные массы двух веществ – того, чья масса известна из условий задачи, и того, чью массу нужно найти (совместно с учениками вычисляются молекулярные массы воды и кислорода):
Mr ( O 2 ) = 16+16= 32
Mr (2 H 2 O ) = 2(1 . 2 + 16) = 36
Б. Расставляем молекулярные массы и массу кислорода в уравнении, неизвестную массу «берём за Х»:
m ( O 2 ) = 320 кг. х 320000 г
m ( H 2 O ) = ? 36 32
В. На основе данных составляем пропорцию, проводим расчёты:
Х = 320000 . 36 : 32 = 360000 г. или 360 кг.
Г. Записываем ответ.
6. Слово учителя. Итак, мы решили задачу, пользуясь для вычислений знаниями таких понятий как «масса», «молекулярная масса», «пропорция». Но подобные задачи можно решить и другим способом, оперируя такими понятиями как «моль» и «количество вещества». Решение задач таким способом подробно описано в учебнике. Давайте рассмотрим такие задачи.
7. Совместная работа с текстом учебника (стр. 45-47), знакомство с другим способом решения задач (через моли).
8. Беседа. Как вы думаете, какой из способов решения задач лучше?
Выводы – оба способа необходимо знать для решения химических задач такого рода.
9. Совместная работа, тренаж. Решение задачи 1 учебника (стр. 48).
IV этап. Самостоятельное применение знаний, самоконтроль.
Самостоятельная работа. Решение задачи 2 учебника (стр. 48), проверка решения по эталону на доске.
III этап. Рефлексия. Ответы по карточкам:
Сегодня я узнал(а) ….. Было интересно ….. Было сложно ….. Я выполнял(а) задание …. Я понял(а), что ….. Теперь я могу …. Я почувствовал(а), что …. Я приобрел(а) ….. Я научился (научилась) ….. У меня получилось….Я смог (смогла) ….. Урок дал мне для жизни ….. Мне захотелось …. Мне не понравилось ….
Домашнее задание . Подготовиться к контрольной работе по теме «Первоначальные химические понятия».
Источник
Типовые задачи по химии за курс 8 класса
Решение типовых задач
Моль. Молярная масса
Определите кол-во в-ва атомного кислорода в оксиде меди ( II ) массой 159 г.
Вычислите, какое кол-во в-ва карбоната кальция заключается в 80 г карбоната кальция.
Определите массу 3 моль нитрата кальция
Относительная атомная масса ртути равна 201. Определите массу одного атома ртути в граммах
Ответ: 
Вычислите, сколько молекул содержится в 34 г аммиака? Какова масса одной молекулы.
Ответ:
Химические формулы и расчеты по ним
Напишите формулы соединений с водородом следующих элементов: азота, кремния, серы, брома
Напишите формулы соединений с кислородом следующих элементов: Серебра(1), магния(2), фосфора(5), кремния(4), алюминия(3), марганца(7), серы(6), осмия(8)
Рассчитайте массовую долю и в процентах по массе каждого элемента в сульфате аммония.
Какая масса кальция потребуется для получения 148 г гидроксида кальция?
Определите массовую долю кристаллизационной воды в медном купоросе?
Нахождение формулы вещества по результатам анализа
Массовая доля серы в оксиде равна 40%. Определите формулу оксида.
Состав оксида элемента выражается простейшей формулой ЭО2. Известно, что для получения оксида массой 22,2 г потребовался элемент массой 15,8 г. Какой элемент образует оксид?
Вещество содержит 7,7% водорода и 92,3% углерода. Определите формулу этого в-ва, если его молярная масса составляет 26г/моль
Газовые законы. Молярный объем газа
Какую массу будет иметь N 2 объемом 60 л при н.у.?
Определим массу и объем, занимаемый при н.у. 
Какой объем занимает при н.у. углекислый газ массой 22 г?
Какой объем займет при температуре 20 
Относительная плотность галогеноводорода по воздуху равна 1,26. Определите плотность этого газа по водороду и назовите его
Плотность газа по водороду 16. Определите плотность газа по воздуху
Давление водяного пара при 25 
Расчеты по химическим уравнениям
Сколько граммов воды образуется при а) 10 г окиси мели 
Определите массу брома, которая потребуется для получения бромида алюминия массой 53,4 г.
Рассчитайте объем водорода, который выделится при растворении цинка массой 6,5 г в избытке соляной кислоты (н.у.)
Вычислите объем оксида серы (6), который надо взять для реакции с кислородом, чтобы получить оксид серы (6) массой 20 г. Массовая доля выхода продукта равна 80%. Объем рассчитайте при н.у.
Смесь медных и магниевых опилок массой 4,5 г обработали раствором соляной кислоты. В результате реакции выделился водород объемом 1,68 л (н.у.) Вычислите массовую долю меди в смеси.
К раствору, содержащему 43,6 г нитрата серебра пропустили хлороводород объемом 5л. Выпавший осадок отделили, высушили и взвесили, его масса составила 29 г. Определите выход соли, выпавшей в осадок.
К раствору, содержащему хлорид бария массой 41,6 г, прилили раствор, содержащий 35 г сульфата натрия. Рассчитайте массу полученного осадка.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 812 человек из 76 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 48 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 23 человека из 12 регионов
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
Рабочая программа по химии 10 класс
Рабочая программа по химии 11 класс.(учебник Габриелян О.С.)
Рабочая программа по химии 10 класс.(учебник Габриелян О.С.)
Рабочая программа по химии 9 класс.(учебник Габриелян О.С.)
Рабочая программа по химии 8 класс.(учебник Габриелян О.С.)
Химический практикум для 8 класса
Задачи по химии на тему » Химические элементы»(8 класс)
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5308607 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Российские адвокаты бесплатно проконсультируют детей 19 ноября
Время чтения: 2 минуты
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Российские школьники завоевали пять медалей на олимпиаде по физике
Время чтения: 1 минута
Руководители управлений образования ДФО пройдут переобучение в Москве
Время чтения: 1 минута
Российский совет олимпиад школьников намерен усилить требования к олимпиадам
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник