4.6. Химико-энзиматический способ получения лизина.
В ряде стран (Японии, США и др.) для получения лизина применяется химико-энзиматический метод, позволяющий создать высокоэффективные технологии, сочетающие в себе достоинства химического и микробиологического синтеза. Эти технологии основаны на ферментативной конверсии в лизин α-амино-ε-капролактама, который получают химическим методом из циклогексана.
Схема химико-энзиматического синтеза лизина:
В результате химического синтеза образуется рацемическая смесь D- и L-капролактама, которая направляется в реактор с ферментом гидролазой α-амино-ε-капролактама, который катализирует превращение L-капролактама в L-лизин.D-изомер капролактама затем превращается в L-изомер с помощью специфической рацемазы. При такой технологии получения лизина его содержание в реакционной смеси по завершении рабочего цикла достигает свыше 150 г/л.
Продуцентами гидролазы α-амино-ε-капролактама служат некоторые штаммы дрожжей из рода Cryptococcus,Candida,Trichosporon. Дрожжи выращивают в щелочной оптимизированной для синтезе фермента питательной среде, содержащей активаторы – ионы магния, марганца и цинка. Для ферментативной реакции превращения капролактама в лизин может использоваться клеточная суспензия дрожжевых клеток с активным ферментом, клеточный экстракт (после разрушения и отделения клеток) или очищенный фермент. Рацемазу, катализирующую превращениеD-капролактама в L-изомер, получают на основе бактерийAchromobacter,Flavobacteriumи др.
Процессы изомеризации D-капролактама в L-изомер и превращение L-капролактама в лизин можно проводить одновременно. Для этого в водный раствор D, L- капролактама вводится необходимое количество дрожжевых и бактериальных клеток, задаются оптимальный температурный режим, рН, аэрация. На выходе из реактора образуется преимущественно один продукт – L-лизин, который выделяют из смеси, очищают и сушат.
Микробиологический синтез триптофана.
Для производства триптофана применяют как одноступенчатый синтез с помощью бактериальных ауксотрофных мутантов с нарушенной регуляцией синтеза аминокислот, так идвухступенчатый синтез,включающий вначале получение предшественника триптофана, а затем его ферментативное превращение в конечный продукт – триптофан.
Схема синтеза триптофана, фенилаланина и тирозина:




У бактерий и у других организмов триптофан образуется из эритрозо-4-фосфата ифосфоенолпировиноградной кислоты через ряд последовательных реакций, включающих образование шикимовой и хоризмовой кислот, а непосредственным предшественником триптофана является антраниловая кислота.
Синтез триптофана аллостерически ингибируется конечными продуктами, которые действуют на ферменты, катализирующие начальные этапы превращений, связанные с образованием хоризмовой кислоты.
Для смещения метаболических реакций по пути преимущественного образования триптофана необходимо блокировать превращение хоризмовой кислоты в префеновую, что достигается действием мутагенных факторов. У мутантов с пониженной активностью ферментов, катализирующих превращение хоризмовой кислоты в префеновую, наблюдается повышенный синтез триптофана, но для нормального развития этих мутантов, в питательную среду необходимо добавлять дефицитные аминокислоты – фенилаланин и тирозин – в количествах, не вызывающих регуляторное ингибирование ферментов синтеза триптофана.
Для промышленного получения триптофана разработаны технологии на основе использования ауксотрофных мутантов: бактерий рода Bacillussubtilisс нарушенным синтезом фенилаланина и тирозина. Все технологические процессы организованы примерно по той же схеме, что и получение лизина с помощью мутантных штаммов коринебактерий. Ферментация длится 48 ч при 37°С, концентрация триптофана в культуральной жидкости достигает 10 г/л. После отделения культуральной жидкости от клеток бактерий она упаривается и высушивается при 110 – 120°С. Высушенный продукт называюткормовым концентратом триптофана (ККТ).
При получении высококонцентрированных препаратов триптофана культуральную жидкость подвергают дополнительной очистке. Вначале ее подкисляют соляной кислотой до рН 1,0 и затем центрифугированием отделяют образовавшийся осадок. Далее центрифугат, содержащий триптофан, пропускают через ионообменные колонки с катионитом, в результате чего происходит связывание аминокислоты и, таким образом, отделение ее от культуральной жидкости. После промывки колонок производят десорбцию триптофана 5 %-ным раствором аммиака в смеси изопропанола и воды. Элюат направляют на вакуум-выпарительный аппарат, после чего кристаллизуют аминокислоту при 4 – 8°С. Выделенную в кристаллическом виде соль триптофана промывают этанолом и высушивают под вакуумом при 60°С. Высушенный кристаллический препарат содержит не менее 99 % триптофана в виде хлорида. Осадок после отделения культуральной жидкости, содержащий клетки культуры бактерий, также высушивают и используют как высокобелковую кормовую добавку, содержащую повышенное количество триптофана.
Синтез триптофана в нашей стране производится преимущественно по двухступенчатой схеме.Вначале методом химического синтеза получают предшественник триптофана – антраниловую кислоту, которую затем с участием ферментов микробного происхождения превращают в триптофан.
Биохимическое превращение антраниловой кислоты в триптофан происходит в три этапа: на первом этапе из антраниловой кислоты с участием фосфорибозилпирофосфата (ФРПФ) образуется аминогликозид-N-(5¢-фосфорибозил)-антраниловая кислота, которая в результате внутримолекулярной перегруппировки и декарбоксилирования превращается в индол-3-глицерофосфат. На последнем этапе под действием фермента триптофансинтетазы из индол-3-глицерофосфата и аминокислоты серина образуется триптофан. В связи с тем, что в качестве активной группы у фермента триптофансинтетазы служит пиридоксальфосфат, от наличия в среде этого кофермента зависит скорость превращения антраниловой кислоты в триптофан. В качестве источника ферментов используют дрожжи.
Производственный процесс биохимического превращения антраниловой кислоты в триптофан проводится в две стадии.
На первой стадии производится наращивание биомассы дрожжей, являющихся продуцентами ферментов. Питательная среда для выращивания дрожжей готовится из свекловичной мелассы, мочевины, минеральных солей. Ферментация продолжается в течение 24 ч при 30 °С. Далее в ферментер начинают вводить спиртовой 5 %-ный раствор антраниловой кислоты и 50 %-ный раствор мочевины. Через 3 – 4 ч после добавления антаниловой кислоты в ферментер дополнительно подается углеродный субстрат – меласса в виде 25 %-го раствора. На последующих этапах ферментации периодически производится подача антраниловой кислоты и мочевины через каждые 6 ч и раствора мелассы – через каждые 12 ч. Длительность ферментации около 120 ч, а с учетом времени наращивания биомассы дрожжей – 144 ч. Содержание триптофана культуральной среде составляет 0,3 – 0,5 % (6 г/л). После выпаривания и сушки получают кормовой концентрат триптофан (ККТ), содержащий 90 % сухого вещества, 48 – 54 % белков, 1 – 3 % триптофана, 1,5 – 1,9 мг (%) витамина В1, 2,5 – 3,3 мг (%) витамина В2, 62 – 68 мг (%) витамина РР.
Синтез аминокислот с помощью ферментов.
Источник
Привет студент
Производство аминокислот
Министерство образования и науки
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Реферат
на тему «Производство аминокислот»
преподаватель кафедры микробиологии _Васин А.А.
студентка группы 10 ХИБ _Толстых Б.Г.
Содержание
Аминокислоты и их применение. 3
Получение аминокислот. 7
1. Гидролиз природных белоксодержащих субстратов. 7
2. Химический синтез. 7
3. Биотрансформацией предшественников аминокислот с помощью
микроорганизмов или выделенных из них ферментов. 8
4. Микробиологический метод. 10
Аминокислоты — структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, рада гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений (пурины, пиримидины, и пр.). В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислотами и должны поступать в организм с пищей. Незаменимыми аминокислотами являются: валин, изолейцин, лейцин. лизин, метионин, треонин, триптофан и фенилаланин. Недостаток каждой из этих аминокислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития.
Таблица 1 — Потребность человека в аминокислотах
массы тела в сутки
Пищевая ценность белка определяется сравнением доли незаменимых аминокислот в пище с этим же показателем при адекватном питании. Чем ближе обе величины, тем выше качество белка. Белки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Многие белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы — лизином и триптофаном.
Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет балансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2-4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15 — 20 %, выход продукции увеличивается на20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу.
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
1. глицин — подсластитель, антиоксидант, бактериостатик;
2 аспарагиновая кислота-усилитель вкуса, сырье для синтеза аспартама;
3. глутаминовая кислота — усилитель вкуса, препарат для лечения психических заболеваний;
4. гистидин- противовоспалительное средство; 4 метионин — пищевая и кормовая добавки;
5. цистеин — фармацевтический препарат;
6.треонин и триптофан — пищевые и кормовые добавки;
7. фенилаланин — сырье для получения аспартама;
8. лизин — пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В питательные продукты для человека также можно добавлять незаменимые аминокислоты. Это целесообразно делать или по медицинским показаниям, или в силу каких-либо соображений, когда человек питается только растительной пищей (растительными белками). Эту пищу можно оптимизировать и улучшить ее питательные свойства, сбалансировав ее по аминокислотному составу путем добавления туда лизина, треонина, метионина (например, в пищу для вегетарианцев). Кроме того, что аминокислоты имеют огромное значение для нашей пищи, они также широко используются и в традиционной клинической практике (таблица 2).
Таблица 2 Моно- и комплексные лекарственные препараты на основе аминокислот
Обладает ноотропным и седативным эффектом; снижает проявления абстиненции у больных алкоголизмом
В клинике нервных и психических заболеваний; в наркологии — для стимуляции умственной деятельности (некоторые студенты проводят терапию глицином перед экзаменами)
Иммуностимулиру ющее; усиливает неспецифическую резистентность организма
Для стимуляции репаративных процессов после тяжелых травм (в том числе переломов
Приостанавливает процесс помутнения хрусталика
В начальных стадиях развития катаракты; входит в состав глазных капель — витайодурола и
Корректирует метаболизм костной и хрящевой ткани
При артритах и артрозах
Обеспечивает формирование высших психических функций; участвует в многообразных реакциях переаминирования, (обеспечивает синтез других заменимых аминокислот); активно связывает образующиеся в процессе метаболических реакций ионы аммония, которые являются токсичными и накопление их в клетках головного мозга вызывает процесс возбуждения
В клинике нервных и психических заболеваний, а также при задержке умственного развития у детей; входит в состав комплексных препаратов для профилактики стресса, например препарат глутамивит наряду с витаминами и микроэлементами содержит также и глутаминовую кислоту
Донор метальной группы в разных биохимических реакциях. При участии метионина осуществляется синтез холина (соединение, входящее в состав клеточных мембран) из жиров; обладает липотропным и гепатропным эффектом
При циррозах и гепатитах печени и лицам преклонного возраста, у которых имеются признаки атеросклероза
Регулирует процессы регенерации в головном мозге
После травм головного мозга; инсультов и ишемического голодания головного мозга, а также при задержке умственного развития у
Регулирует обмен веществ в предстательной железе
Воспалительные болезни и гиперплазия предстательной железы
Для профилактики и коррекции возрастных изменений кожи лица и шеи
Создает благоприятную среду для метаболических процессов
Для ускорения заживления и восстановления кожных покровов
Перечень препаратов на основе аминокислот и их комплексов постоянно растет и расширяется. Очень хорошую перспективу для успешного развития имеют препараты для парентерального питания, содержащие комплексы аминокислот. Они назначаются, когда питание «естественным» образом противопоказано, так как стимулирует секрецию пищеварительных желез. Например, при остром панкреатите человек не должен ни пить, ни есть, поскольку любая стимуляция секреции может привести к самоперевариванию поджелудочной железы.
Тенденция сегодняшнего дня — использование препаратов, содержащих весь комплекс аминокислот (или, по меньшей мере, 18 из них), т.е. в оптимальном для человеческого организма соотношении. В основном это импортные препараты: аминоплазмаль, кетостерил, валин (Германия); аминостерил КЕ (Финляндия); аминосол (Югославия). Некоторые из этих препаратов помимо аминокислот содержат также глюкозу и витамины. Соотношение аминокислот в них оптимальное. В организме человека в зависимости от возраста синтезируются белки соответствующего состава, например аминокислотный состав этих препаратов для детей приближается к составу грудного молока матери, для взрослых он несколько иной.
Существуют так называемые космоцевтические медицинские препараты, для получения которых используется фармацевтическое сырье, к чистоте которого предъявляют повышенные требования. При этом известно, что особо чистыми являются вещества, полученные биотехнологическими методами, например с помощью специально выведенных штаммов-микроорганизмов.
Иллюстрацией может служить препарат эмбриобласт, получаемый из эмбриональной зубной ткани овец, содержащий как биостимуляторы (факторы роста, цитокины и др.), так и необходимый «строительный материал» — аминокислоты, нуклеотиды, витамины, минералы.
В настоящее время аминокислоты получают методами:
1) гидролиз природных белоксодержащих субстратов;
2) химическим (тонкий органический синтез);
3) биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод)
4) микробиологическим (получение L-аминокислот).
Остановимся подробнее на каждом из методов.
1.Гидролиз природных белоксодержащих субстратов
При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 — 105 °С в течение 20—48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10 — 30%). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролизаторов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
2.Химический синтез
Существенный недостаток методов химического синтеза аминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот — дорогая и чрезвычайно трудоемкая процедура.
3. Биотрансформация предшественников аминокислот с помощью
микроорганизмов или выделенных из них ферментов (химико микробиологический метод)
При получении ряда аминокислот химико-ферментативными способами используют энзимы, принадлежащие к разным классам. Эти процессы могут быть как одностадийными (конверсии), так и многостадийными. Источником ферментов для большинства процессов служат энзимы микроорганизмов — как индивидуальные, так и их природные смеси, содержащиеся ;в интактных (не растущих), высушенных и лизированных клетках, клеточных экстрактах и, наконец, в препаратах иммобилизованных клеток и ферментов.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических. Далее будут рассмотрены примеры, иллюстрирующие эти положения.
Получение L-лизина. Процесс ;получения лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) D^L-а-амино-е-капролактама, который сначала получают химическим путем из циклогексена:
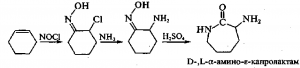
Рацемат используют в качестве субстрата, который под действием фермента L-а-амино-е-капролактамгидролазы (лактамаза) превращается в L-лизин, а оставшаяся непрореагировавшая его часть ((D-форма) переводится при воздействии рацемазы в смесь антиподов:
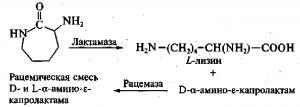
Лактамаза найдена у некоторых видов дрожжей, в частности у Candida laurentii; у них синтез фермента индуцируется добавлением субстрата (рацемической смеси), а активность энзима поддерживается при добавлении в среду ионов Mg 2+ , Мп 2+ и Zn 2+ . Раце-маза обнаружена у ряда бактерий, например у Alcaligenes obae. Для получения неочищенных ферментов целые клетки микроорганизмов обрабатывают поверхностноактивными веществами, вызывающими изменение проницаемости стенки клеток микроорганизмов-продуцентов. Разработаны иммобилизованные формы обоих ферментов. При производстве лизина в водный раствор D-,L-а-амино-s-капролактама одновременно вводят источники лактамазы и рацемазы, содержащиеся в дрожжевых и бактериальных
клетках. Процесс осуществляется при температуре 30—50 °С, рН 8,0—8,5 и оптимальном режиме аэрации. На выходе из реактора образуется преимущественно один продукт — лизин, который выделяют из смеси, очищают и сушат. Описанная технология получения лизина, распространенная в США и Японии, по завершении процесса обеспечивает содержание аминокислоты в реакционной среде свыше 150 г/л. Кроме того, созданы мутанты, у которых целевой продукт — лизин далее не вовлекается в обмен веществ, что увеличивает выход искомого продукта.
Получение триптофана. Химико-ферментативный способ получения триптофана состоит в прямой конденсации индола, аммиака и пировиноградной кислоты:
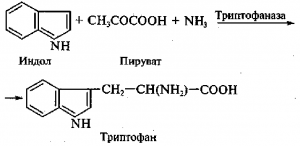
Реакцию катализирует пиридоксальзависимая триптофан-индоллиаза (триптофаназа). Фермент широко распространен в природе. Он найден у бактерий Е. coli, Bacillus albei, Proteus rettgeri и характеризуется широкой субстратной специфичностью. Кроме L-триптофана его субстратами служат L-цистеин, S-метил-цистеин, (Р-хлор-L-аланин, L-серин. Триптофаназа ускоряет реакции а,Р-элиминирования и Р-замещения, но ее действие может быть обращено и в сторону реакции конденсации. Добавление триптофана индуцирует образование фермента, а добавление индола ингибирует его синтез у бактерий, поэтому процесс получения триптофана ведут при избытке аммиака и пирувата.
Выход аминокислоты при реализации химико-энзиматического способа получения триптофана составляет 63 г/л.
Набор энзимов, использующихся для получения аминокислот, достаточно разнообразен. К их числу относятся гидролазы, дегидрогеназы, лиазы, лигазы, изомеразы. Столь же разнообразен и перечень целевых аминокислот, производимых химико-ферментативным способом (L-аспарагиновая кислота, L-аланин, L-глутамин, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фенилаланин, L-метионин). Химикоэнзиматический способ в сравнении с микробиологическим более специфичен, не требует процедуры очистки аминокислот от побочных продуктов и сточных потоков. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
4. Микробиологический синтез
Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот делают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду значительные количества какой-либо одной аминокислоты. При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов продуцировали аминокислоты во внешнюю среду, но в очень незначительных количествах. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % — дрожжи, 30 % — стрептомицеты, 20 % — бактерии и 10 % — микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов — Corynebacterium glutamicum был способен к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Токио (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе акад. А. А. Александрова.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов — микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter.
Разработка технологической схемы получения отдельной аминокислоты полностью базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Микробиологические методы производства аминокислот
Производство лизина. По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50 %. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым.
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот — лизина, метионина и треонина.
Таким образом, в процессе новообразования аминокислот из общего
предшественника одновременно с лизином возникают две другие аминокислоты — метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
Образование лизина в клетке бактерии находится под строгим метаболическим контролем. У типичных продуцентов L-лизина — Brevibacterium flavum и Corynebacterium glutamicum — фермент аспартаткиназа, открывающий метаболический путь, является аллостерическим белком, чувствительным к ингибированию по принципу обратной связи при совместном и согласованном действии побочных продуктов L-треонина и L-лизина. При накоплении треонина и лизина в избыточной концентрации ингибируется аспартаткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется.
Чтобы добиться образования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа не синтезируется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы. Поэтому при выращивании мутантных штаммов в среде, где присутствуют лимитирующие концентрации метионина и треонина, они способны образовывать избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям аллостерического ингибитора — лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 —5 мкл/л), добавляют пенициллин (2—4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы — глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5 %), пропионовой кислоты, метанола, этанола (до 1 %) и «-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты. Стерильный воздух
подается специальными турбинными мешалками . Опыты показали, что лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры клеток микроорганизма и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 — 7,2; температура 28 — 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 — 30 ч после начала ферментации. По завершении процесса ферментации (через 55 — 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. С этой целью лизин переводят в форму катиона:
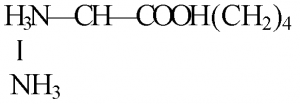
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6—2,0 (рН У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Источник












