- Химические источники тока: основные характеристики Уже более двух столетий человечество использует энергию химических реакций между различными веществами для получения постоянного тока. Принцип работы Окислительно-восстановительная реакция, протекающая между веществами, обладающими свойствами окислителя и восстановителя, сопровождаются выделением электронов, движение которых образует электрический ток. Однако, чтобы использовать его энергию, необходимо создать условия для прохождения электронов через внешнюю цепь, в противном случае она при простом смешивании окислителя и восстановителя выделяется во внешнюю среду теплом. Поэтому все химические источники тока имеют два электрода: анод, на котором происходит окисление; катод, осуществляющий восстановление вещества. Электроды на расстоянии помещены в сосуд с электролитом — веществом, проводящим электрический ток за счет процессов диссоциации среды на ионы. Принцип преобразования химической энергии в электрическую На рисунке показано, что электроды размещены в отдельных сосудах, соединенных солевым мостиком, через который создается движение ионов по внутренней цепи. Когда внешняя и внутренняя цепь разомкнуты, то на электродах протекают два процесса: переход ионов из металла электрода в электролит и переход ионов из электролита в кристаллическую решетку электродов. Скорости протекания этих процессов одинаковы и на каждом электроде накапливаются потенциалы напряжения противоположных знаков. Если их соединить через солевой мостик и приложить нагрузку, то возникнет электрическая цепь. По внутреннему контуру электрический ток создается движением ионов между электродами через электролит и солевой мостик. По внешней цепи возникает движение электронов по направлению от анода на катод. Практически все окислительно-восстановительные реакции сопровождаются выработкой электроэнергии. Но ее величина зависит от многих факторов, включающих объемы и массы используемых химических веществ, примененных материалов для изготовления электродов, типа электролита, концентрации ионов, конструкции. Наибольшее применение в современных химических источниках тока нашли: для материала анода (восстановителя) — цинк (Zn), свинец (Pb), кадмий (Cd) и некоторые другие металлы; для материала катода (окислителя) — оксид свинца PbO2, оксид марганца MnO2, гидроксооксид никеля NiOOH и другие; электролиты на основе растворов кислот, щелочей или соли. Способы классификации Одна часть химических источников тока может повторно использоваться, а другая нет. Этот принцип взят за основу их классификации. Классификация химических элементов Электродвижущая сила гальванических элементов, в зависимости от конструкции, достигает 1,2÷1,5 вольта. Для получения больших значений их объединяют в батареи, соединяя последовательно. При параллельном подключении батарей увеличивается ток и мощность. Принято считать, что первичные химические источники тока не поддерживают повторную зарядку, хотя более точно это положение можно сформулировать по-другому: ее проведение экономически не целесообразно. Резервные первичные химические источники тока хранятся в состоянии, когда электролит изолирован от электродов. Это исключает протекание окислительно-восстановительной реакции и обеспечивает готовность к вводу в работу. Они не используются повторно. Срок хранения резервных химических источников тока ограничен в 10÷15 лет. Аккумуляторы успешно перезаряжаются приложением внешней электрической энергии. Благодаря этой возможности их называют вторичными источниками тока. Они способны выдерживать сотни и тысячи циклов заряда-разряда. ЭДС аккумулятора может быть в пределах 1,0÷1,5 вольта. Их тоже объединяют в батареи. Электрохимические генераторы работают по принципу гальванических элементов, но у них для проведения электрохимической реакции вещества поступают извне, а все выделяющиеся продукты удаляются из электролита. Это позволяет организовать непрерывный процесс. Основные рабочие характеристики химических источников тока 1. Величина напряжения на разомкнутых клеммах В зависимости от конструкции единичный источник может создавать только определенную разность потенциалов. Для использования в электрических устройствах их объединяют в батареи. 2. Удельная емкость За определенное время (в часах) один химический источник тока может выработать ограниченное количество тока (в амперах), которые относят к единице веса либо объема. 3. Удельная мощность Характеризует способность единицы веса или объема химического источника тока вырабатывать мощность, образованную произведением напряжения на силу тока. 4. Продолжительность эксплуатации Еще этот параметр называют сроком годности. 5. Значение токов саморазряда Эти побочные процессы электрохимических реакций приводят к расходу активной массы элементов, вызывают коррозию, снижают удельную емкость. 6. Цена на изделие Зависит от конструкции, применяемых материалов и ряда других факторов. Лучшими химическими источниками тока считаются те, у которых высокие значения первых четырех параметров, а саморазряд и стоимость низкие. Принципы заряда аккумуляторов Среди вторичных химических источников тока большую популярность набирают литий ионные модели, которые стали массово применяться для питания электронных устройств. У них материалом положительного электрода используется LiMO2 (M Co, Ni, Mn), а отрицательного — графит. При заряде ионы лития от приложенной внешней энергии выделяются из металла катода, проходят через электролит и проникают в пространство между слоями графита, накапливаясь там. Когда энергия зарядного устройства отсутствует, а к электродам подключена нагрузка, то ионы лития в электролите двигаются в противоположную сторону. Если заряд и разряд не проводятся, то энергия в аккумуляторе не расходуется, а сохраняется. Но ее количество ограничивается свойствами применяемых материалов. К примеру, у литий-ионных аккумуляторов значение удельной электроемкости составляет 130÷150 мАч/г. Оно лимитировано свойствами материала анода. Для графита емкость выше примерно в два раза. Ученые сейчас ищут способы повышения емкости аккумулятора, изучают возможности использования химической реакции, проходящей между литием и кислородом воздуха. Для этого разрабатываются конструкции с воздушным, не расходуемым катодом, используемые в отдельных аккумуляторах. Этот метод может до 10 раз увеличить плотность энергии. Эксплуатация химических источников тока требует знания основ электротехники, электрохимии, материаловедения и физики твердых тел. Источник Химические источники тока. Виды и особенности. Устройство и работа Химические источники тока (ХИТ) — эта тема имеет высокое практическое значение. Это кардиостимуляторы, электромобили, которые пытаются сохранить экологию, портативные устройства, включая фото и видеотехнику, компьютерную технику, навигаторы. За последние годы прогресс химических источников тока произошел большой, от известных свинцовых аккумуляторов, которые постепенно вытесняются литий-ионными, литий-полимерными и другими аккумуляторами. В этой области борьба идет за мощность, емкость, которая позволяет максимально долго использовать источники тока. Дополнительным стимулом к их развитию является создание гибких источников тока. Научная составляющая в этой области лежит в плане разработки материалов для таких химических элементов. Устройство и работа Химические источники тока состоят из электродов и электролита, который находится в емкости. Электрод, на котором окисляется восстановитель, называется анодом. Электрод, на котором восстанавливается окислитель, называется катодом. В общем получается электрохимическая система. Попутным результатом такой реакции стало возникновение тока. Восстановитель передает электроны на окислитель, который восстанавливается. Электролит, который находится между электродами, нужен для прохождения реакции. Если перемешать порошки различных двух металлов, то электричество не возникнет, энергия появится в виде теплоты. Электролит необходим для упорядочения процесса движения электронов. Электролит состоит обычно из раствора соли или расплавленного вещества. Электроды имеют вид решеток или пластин из металла. При помещении их в раствор электролита получается разность потенциалов пластин. Анод отдает электроны, а катод их принимает. На поверхности возникают химические реакции. Когда цепь размыкается, то реакции прекращаются. Если реагенты закончились, то реакция также больше не идет. Если удалить один из электродов, то цепь размыкается. Из чего состоят химические источники тока В качестве окислителей применяются соли и кислородосодержащие кислоты, а также нитроорганические вещества, кислород. В качестве восстановителей применяются металлы, оксиды, углеводороды. Электролит может состоять из: Соли, щелочи и кислоты, растворенные в воде. Соли в растворе, с возможностью электронной проводимости. Расплавленные соли. Твердые вещества с подвижным ионом. Электролиты в виде матрицы. Это растворы жидкости, расплавы, которые находятся в порах электроносителя. Электролиты с ионным обменом. Твердые вещества с закрепленными ионогенными группами, с одним знаком. С другим знаком ионы подвижны. Эта характеристика позволяет создать однополярную проводимость. Гальванические элементы Напряжение на ячейке составляет 0,5-4 вольта. В химических образцах источника применяют гальваническую батарею, которая состоит из элементов. Может использоваться параллельная схема нескольких элементов. При последовательной схеме в цепь включены одинаковые батареи. Они должны обладать одинаковыми свойствами, с одной конструкцией, технологией, типоразмером. Для схемы параллельного соединения подойдут элементы с различными свойствами. Классы Химические источники тока делятся по следующим свойствам: Размерности. Конструктивным особенностям. Применяемым химическим веществам. Источнику реакции. Эти свойства создают эксплуатационные параметры источников, которые подходят для определенной области использования. Деление на классы электрохимических источников основывается на отличии в способе действия устройства. По этим свойствам их различают: Первичные источники – для однократного применения. В них заключен определенный запас веществ, который будет израсходован при реакции. Когда произойдет разряд, ячейка исчерпывает свою способность к работе. Первичные источники, основанные на химических реакциях, называются элементами. Наиболее простой элемент – это батарейка типа АА. Химические источники тока , которые имеют возможность перезаряжаться, называются аккумуляторами, это вторичные многоразовые элементы. Израсходованные химические элементы могут регенерироваться и снова накопить энергию, путем подключения к ним тока. Это называется зарядкой элементов. Такие элементы применяют длительное время, так как их легко зарядить. В процессе разряда вырабатывается электрический ток. К таким источникам можно причислить элементы питания различных видов приборов и устройств, таких как смартфоны, ноутбуки и т.д. Тепловые химические источники тока – это приборы постоянного действия. В результате их работы постоянно поступает новая порция веществ и удаляется использованный продукт реакции. В смешанных элементах находится запас реагента. Другой реагент поступает в устройство снаружи. Время действия устройства имеет зависимость от резерва первого вещества. Комбинированные элементы применяются в качестве аккумуляторов, когда имеется возможность регенерации их заряда через прохождение тока от внешнего питания. Химические источники тока, которые могут возобновлять заряд , заряжаются разными способами. В них можно заменять израсходованные реагенты. Такие источники действуют не постоянно. Свойства Основные характеристики ХИТ можно перечислить в таком виде: Разрядное напряжение. Это свойство имеет зависимость от определенной электрохимической системы. А также оказывает влияние процент концентрации электролита, температура, ток. Мощность. Разрядный ток, зависящий от сопротивления цепи. Емкость, наибольшее количество энергии, которое источник выдает при общем разряде. Запас энергии – наибольшая энергия, которая получена при полном разряде устройства. Энергетические свойства и характеристики. Для батарей аккумуляторов это число циклов заряда и разряда, без уменьшения емкости и напряжения (ресурс). Температурный интервал работы. Сохраняемый срок – наибольший допускаемый период времени от изготовления до первого разряда элемента. Время службы – наибольший допускаемый срок работы и хранения. Для элементов на топливе имеют значение сроки работы при постоянной и периодической работе. Полная энергия, отданная за все время работы. Механическая, вибрационная прочность. Возможность функционирования в любом положении. Надежная работа. Простота в уходе. Сахарная батарея Чтобы произвести литий-ионные аккумуляторы в Японии закупают материалы в других странах. Это негативно сказывается на экономическом положении страны. Поэтому ученые ищут способы изготовления аккумуляторов из того сырья, которое имеется в наличии. Таким сырьем в Японии стал сахар. Аккумулятор на сахаре в Японии по свойствам имеет надежность и энергоемкость выше обычных аналогов, и стоимость его ниже. Большой спрос на литий, который вызван резким распространением переносных аккумуляторов, озаботил производителей аккумуляторов, так как этот элемент добывается только в странах с политической нестабильностью. Это явилось вторым фактором поиска альтернативных материалов для недорогих аккумуляторов с высокой надежностью. Сахароза легко преобразуется в дешевый материал для анодного сырья в литий-ионных батареях. Сахар нагревают в условиях вакуума под давлением до 1500 градусов. Он превращается в порошок, состоящий из углерода, который может повысить заряд на 20% больше аналогичных изделий. Это явилось первым шагом в разработке дешевых батарей. Пока такие виды батарей не составляют конкуренции современным аккумуляторам. Но ученые предполагают, что в будущем подобные разработки вытеснят дорогие изделия. Требования Конструктивные особенности химических источников тока должны создавать условия, которые способствовали бы максимальной эффективности химических реакций. К таким условиям можно отнести: Недопущение утечек тока. Постоянная работа. Герметичность. Раздельное помещение реагентов. Качественное контактирование электролита с электродами. Хороший отвод тока из объекта химической реакции до наружного вывода с наименьшими потерями. К химическим элементам предъявляются требования: Повышенные значения свойств. Максимальный диапазон температуры работы. Наибольшее напряжение. Минимальная себестоимость электричества. Постоянное значение напряжения. Хорошее сохранение заряда. Безопасное функционирование. Простое обслуживание, или ее отсутствие. Долговременная работа. Эксплуатация источников тока Основное достоинство первичных элементов состоит в отсутствии надобности обслуживания. Перед работой нужно просто осмотреть их, определить срок годности. При включении в цепь нельзя путать полярность и допускать повреждения контактов. Сложные конструкции источников требуют особого ухода. Цель его заключается в удлинении срока службы до максимума. Уход за аккумуляторами требует выполнения следующих мероприятий: Обеспечение чистоты. Контроль параметра напряжения отключенной цепи. Обеспечение необходимого уровня электролита, доливки дистиллированной воды. Проверка концентрации электролита ареометром. При использовании батареек (гальванических элементов) нужно выполнять требования, которые относятся к применению электрических приборов. Сфера использования В современное время химические источники тока используются в: Транспорте. Переносных устройствах. Космической технике. Оборудовании научных исследований. Медицинских приборах. Применяются в бытовой сфере: Батарейки (сухие). Батареи аккумуляторов электроники. Аккумуляторы на автомобилях. Большое распространение нашли литиевые химические источники тока. Это обусловлено наличием у лития максимальной удельной энергии. Он отличается наиболее отрицательным потенциалом электрода из металлов. Батареи литий ионного типа опередили все другие источники по размеру значений удельной энергии. В настоящее время ученые разрабатывают различные усовершенствования литиевых аккумуляторов. Разработки ведутся в направлении получения конструкций корпуса сверхмалой толщины, которые будут использоваться для питания смартфонов и подобных им гаджетов, а также создание сверхмощных батарей аккумуляторов. В последнее время серьезные работы ученых ведутся по изобретению и модернизации топливных батарей – устройств, которые создают электрическую энергию, за счет проведения химических реакций веществ, постоянно подающихся к электродам снаружи. Для окисления берут кислород, а в качестве топлива пытаются использовать водород. На основе таких батарей уже действуют некоторые опытные образцы на электростанциях. Источник
- Химические источники тока. Виды и особенности. Устройство и работа
- Устройство и работа
- Химические источники тока состоят из электродов и электролита, который находится в емкости. Электрод, на котором окисляется восстановитель, называется анодом. Электрод, на котором восстанавливается окислитель, называется катодом. В общем получается электрохимическая система.
- Из чего состоят химические источники тока
Химические источники тока: основные характеристики

Принцип работы
Окислительно-восстановительная реакция, протекающая между веществами, обладающими свойствами окислителя и восстановителя, сопровождаются выделением электронов, движение которых образует электрический ток. Однако, чтобы использовать его энергию, необходимо создать условия для прохождения электронов через внешнюю цепь, в противном случае она при простом смешивании окислителя и восстановителя выделяется во внешнюю среду теплом.
Поэтому все химические источники тока имеют два электрода:
анод, на котором происходит окисление;
катод, осуществляющий восстановление вещества.
Электроды на расстоянии помещены в сосуд с электролитом — веществом, проводящим электрический ток за счет процессов диссоциации среды на ионы.
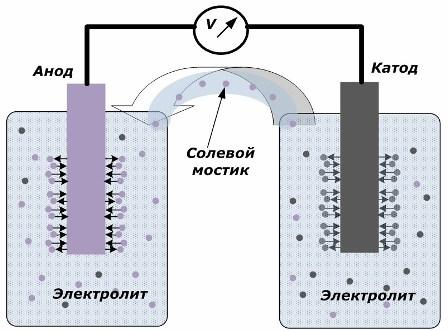
Принцип преобразования химической энергии в электрическую
На рисунке показано, что электроды размещены в отдельных сосудах, соединенных солевым мостиком, через который создается движение ионов по внутренней цепи. Когда внешняя и внутренняя цепь разомкнуты, то на электродах протекают два процесса: переход ионов из металла электрода в электролит и переход ионов из электролита в кристаллическую решетку электродов.
Скорости протекания этих процессов одинаковы и на каждом электроде накапливаются потенциалы напряжения противоположных знаков. Если их соединить через солевой мостик и приложить нагрузку, то возникнет электрическая цепь. По внутреннему контуру электрический ток создается движением ионов между электродами через электролит и солевой мостик. По внешней цепи возникает движение электронов по направлению от анода на катод.
Практически все окислительно-восстановительные реакции сопровождаются выработкой электроэнергии. Но ее величина зависит от многих факторов, включающих объемы и массы используемых химических веществ, примененных материалов для изготовления электродов, типа электролита, концентрации ионов, конструкции.
Наибольшее применение в современных химических источниках тока нашли:
для материала анода (восстановителя) — цинк (Zn), свинец (Pb), кадмий (Cd) и некоторые другие металлы;
для материала катода (окислителя) — оксид свинца PbO2, оксид марганца MnO2, гидроксооксид никеля NiOOH и другие;
электролиты на основе растворов кислот, щелочей или соли.
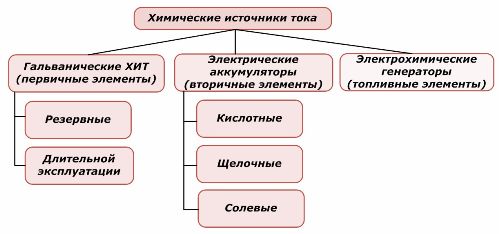
Способы классификации
Одна часть химических источников тока может повторно использоваться, а другая нет. Этот принцип взят за основу их классификации.
Классификация химических элементов
Электродвижущая сила гальванических элементов, в зависимости от конструкции, достигает 1,2÷1,5 вольта. Для получения больших значений их объединяют в батареи, соединяя последовательно. При параллельном подключении батарей увеличивается ток и мощность.
Принято считать, что первичные химические источники тока не поддерживают повторную зарядку, хотя более точно это положение можно сформулировать по-другому: ее проведение экономически не целесообразно.
Резервные первичные химические источники тока хранятся в состоянии, когда электролит изолирован от электродов. Это исключает протекание окислительно-восстановительной реакции и обеспечивает готовность к вводу в работу. Они не используются повторно. Срок хранения резервных химических источников тока ограничен в 10÷15 лет.
Аккумуляторы успешно перезаряжаются приложением внешней электрической энергии. Благодаря этой возможности их называют вторичными источниками тока. Они способны выдерживать сотни и тысячи циклов заряда-разряда. ЭДС аккумулятора может быть в пределах 1,0÷1,5 вольта. Их тоже объединяют в батареи.
Электрохимические генераторы работают по принципу гальванических элементов, но у них для проведения электрохимической реакции вещества поступают извне, а все выделяющиеся продукты удаляются из электролита. Это позволяет организовать непрерывный процесс.
Основные рабочие характеристики химических источников тока
1. Величина напряжения на разомкнутых клеммах
В зависимости от конструкции единичный источник может создавать только определенную разность потенциалов. Для использования в электрических устройствах их объединяют в батареи.
2. Удельная емкость
За определенное время (в часах) один химический источник тока может выработать ограниченное количество тока (в амперах), которые относят к единице веса либо объема.
3. Удельная мощность
Характеризует способность единицы веса или объема химического источника тока вырабатывать мощность, образованную произведением напряжения на силу тока.
4. Продолжительность эксплуатации
Еще этот параметр называют сроком годности.
5. Значение токов саморазряда
Эти побочные процессы электрохимических реакций приводят к расходу активной массы элементов, вызывают коррозию, снижают удельную емкость.
6. Цена на изделие
Зависит от конструкции, применяемых материалов и ряда других факторов.
Лучшими химическими источниками тока считаются те, у которых высокие значения первых четырех параметров, а саморазряд и стоимость низкие.
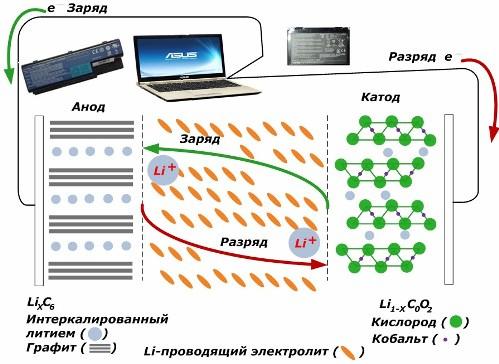
Принципы заряда аккумуляторов
Среди вторичных химических источников тока большую популярность набирают литий ионные модели, которые стали массово применяться для питания электронных устройств. У них материалом положительного электрода используется LiMO2 (M Co, Ni, Mn), а отрицательного — графит.
При заряде ионы лития от приложенной внешней энергии выделяются из металла катода, проходят через электролит и проникают в пространство между слоями графита, накапливаясь там.
Когда энергия зарядного устройства отсутствует, а к электродам подключена нагрузка, то ионы лития в электролите двигаются в противоположную сторону.
Если заряд и разряд не проводятся, то энергия в аккумуляторе не расходуется, а сохраняется. Но ее количество ограничивается свойствами применяемых материалов. К примеру, у литий-ионных аккумуляторов значение удельной электроемкости составляет 130÷150 мАч/г. Оно лимитировано свойствами материала анода. Для графита емкость выше примерно в два раза.
Ученые сейчас ищут способы повышения емкости аккумулятора, изучают возможности использования химической реакции, проходящей между литием и кислородом воздуха. Для этого разрабатываются конструкции с воздушным, не расходуемым катодом, используемые в отдельных аккумуляторах. Этот метод может до 10 раз увеличить плотность энергии.
Эксплуатация химических источников тока требует знания основ электротехники, электрохимии, материаловедения и физики твердых тел.
Источник
Химические источники тока. Виды и особенности. Устройство и работа
Химические источники тока (ХИТ) — эта тема имеет высокое практическое значение. Это кардиостимуляторы, электромобили, которые пытаются сохранить экологию, портативные устройства, включая фото и видеотехнику, компьютерную технику, навигаторы. За последние годы прогресс химических источников тока произошел большой, от известных свинцовых аккумуляторов, которые постепенно вытесняются литий-ионными, литий-полимерными и другими аккумуляторами.
В этой области борьба идет за мощность, емкость, которая позволяет максимально долго использовать источники тока. Дополнительным стимулом к их развитию является создание гибких источников тока. Научная составляющая в этой области лежит в плане разработки материалов для таких химических элементов.
Устройство и работа
Химические источники тока состоят из электродов и электролита, который находится в емкости. Электрод, на котором окисляется восстановитель, называется анодом. Электрод, на котором восстанавливается окислитель, называется катодом. В общем получается электрохимическая система.
Попутным результатом такой реакции стало возникновение тока. Восстановитель передает электроны на окислитель, который восстанавливается. Электролит, который находится между электродами, нужен для прохождения реакции. Если перемешать порошки различных двух металлов, то электричество не возникнет, энергия появится в виде теплоты. Электролит необходим для упорядочения процесса движения электронов. Электролит состоит обычно из раствора соли или расплавленного вещества.
Электроды имеют вид решеток или пластин из металла. При помещении их в раствор электролита получается разность потенциалов пластин. Анод отдает электроны, а катод их принимает. На поверхности возникают химические реакции. Когда цепь размыкается, то реакции прекращаются. Если реагенты закончились, то реакция также больше не идет. Если удалить один из электродов, то цепь размыкается.
Из чего состоят химические источники тока
В качестве окислителей применяются соли и кислородосодержащие кислоты, а также нитроорганические вещества, кислород. В качестве восстановителей применяются металлы, оксиды, углеводороды.
Электролит может состоять из:
- Соли, щелочи и кислоты, растворенные в воде.
- Соли в растворе, с возможностью электронной проводимости.
- Расплавленные соли.
- Твердые вещества с подвижным ионом.
- Электролиты в виде матрицы. Это растворы жидкости, расплавы, которые находятся в порах электроносителя.
- Электролиты с ионным обменом. Твердые вещества с закрепленными ионогенными группами, с одним знаком. С другим знаком ионы подвижны. Эта характеристика позволяет создать однополярную проводимость.
Гальванические элементы
Напряжение на ячейке составляет 0,5-4 вольта. В химических образцах источника применяют гальваническую батарею, которая состоит из элементов. Может использоваться параллельная схема нескольких элементов. При последовательной схеме в цепь включены одинаковые батареи. Они должны обладать одинаковыми свойствами, с одной конструкцией, технологией, типоразмером. Для схемы параллельного соединения подойдут элементы с различными свойствами.
Классы
Химические источники тока делятся по следующим свойствам:
- Размерности.
- Конструктивным особенностям.
- Применяемым химическим веществам.
- Источнику реакции.
Эти свойства создают эксплуатационные параметры источников, которые подходят для определенной области использования.
Деление на классы электрохимических источников основывается на отличии в способе действия устройства. По этим свойствам их различают:
- Первичные источники – для однократного применения. В них заключен определенный запас веществ, который будет израсходован при реакции. Когда произойдет разряд, ячейка исчерпывает свою способность к работе. Первичные источники, основанные на химических реакциях, называются элементами. Наиболее простой элемент – это батарейка типа АА.
- Химические источники тока , которые имеют возможность перезаряжаться, называются аккумуляторами, это вторичные многоразовые элементы. Израсходованные химические элементы могут регенерироваться и снова накопить энергию, путем подключения к ним тока. Это называется зарядкой элементов. Такие элементы применяют длительное время, так как их легко зарядить. В процессе разряда вырабатывается электрический ток. К таким источникам можно причислить элементы питания различных видов приборов и устройств, таких как смартфоны, ноутбуки и т.д.
- Тепловые химические источники тока – это приборы постоянного действия. В результате их работы постоянно поступает новая порция веществ и удаляется использованный продукт реакции.
- В смешанных элементах находится запас реагента. Другой реагент поступает в устройство снаружи. Время действия устройства имеет зависимость от резерва первого вещества. Комбинированные элементы применяются в качестве аккумуляторов, когда имеется возможность регенерации их заряда через прохождение тока от внешнего питания.
- Химические источники тока, которые могут возобновлять заряд , заряжаются разными способами. В них можно заменять израсходованные реагенты. Такие источники действуют не постоянно.
Свойства
Основные характеристики ХИТ можно перечислить в таком виде:
- Разрядное напряжение. Это свойство имеет зависимость от определенной электрохимической системы. А также оказывает влияние процент концентрации электролита, температура, ток.
- Мощность.
- Разрядный ток, зависящий от сопротивления цепи.
- Емкость, наибольшее количество энергии, которое источник выдает при общем разряде.
- Запас энергии – наибольшая энергия, которая получена при полном разряде устройства.
- Энергетические свойства и характеристики. Для батарей аккумуляторов это число циклов заряда и разряда, без уменьшения емкости и напряжения (ресурс).
- Температурный интервал работы.
- Сохраняемый срок – наибольший допускаемый период времени от изготовления до первого разряда элемента.
- Время службы – наибольший допускаемый срок работы и хранения. Для элементов на топливе имеют значение сроки работы при постоянной и периодической работе.
- Полная энергия, отданная за все время работы.
- Механическая, вибрационная прочность.
- Возможность функционирования в любом положении.
- Надежная работа.
- Простота в уходе.
Сахарная батарея
Чтобы произвести литий-ионные аккумуляторы в Японии закупают материалы в других странах. Это негативно сказывается на экономическом положении страны. Поэтому ученые ищут способы изготовления аккумуляторов из того сырья, которое имеется в наличии. Таким сырьем в Японии стал сахар. Аккумулятор на сахаре в Японии по свойствам имеет надежность и энергоемкость выше обычных аналогов, и стоимость его ниже.
Большой спрос на литий, который вызван резким распространением переносных аккумуляторов, озаботил производителей аккумуляторов, так как этот элемент добывается только в странах с политической нестабильностью. Это явилось вторым фактором поиска альтернативных материалов для недорогих аккумуляторов с высокой надежностью. Сахароза легко преобразуется в дешевый материал для анодного сырья в литий-ионных батареях.
Сахар нагревают в условиях вакуума под давлением до 1500 градусов. Он превращается в порошок, состоящий из углерода, который может повысить заряд на 20% больше аналогичных изделий. Это явилось первым шагом в разработке дешевых батарей. Пока такие виды батарей не составляют конкуренции современным аккумуляторам. Но ученые предполагают, что в будущем подобные разработки вытеснят дорогие изделия.
Требования
Конструктивные особенности химических источников тока должны создавать условия, которые способствовали бы максимальной эффективности химических реакций.
К таким условиям можно отнести:
- Недопущение утечек тока.
- Постоянная работа.
- Герметичность.
- Раздельное помещение реагентов.
- Качественное контактирование электролита с электродами.
- Хороший отвод тока из объекта химической реакции до наружного вывода с наименьшими потерями.
К химическим элементам предъявляются требования:
- Повышенные значения свойств.
- Максимальный диапазон температуры работы.
- Наибольшее напряжение.
- Минимальная себестоимость электричества.
- Постоянное значение напряжения.
- Хорошее сохранение заряда.
- Безопасное функционирование.
- Простое обслуживание, или ее отсутствие.
- Долговременная работа.
Эксплуатация источников тока
Основное достоинство первичных элементов состоит в отсутствии надобности обслуживания. Перед работой нужно просто осмотреть их, определить срок годности. При включении в цепь нельзя путать полярность и допускать повреждения контактов. Сложные конструкции источников требуют особого ухода. Цель его заключается в удлинении срока службы до максимума.
Уход за аккумуляторами требует выполнения следующих мероприятий:
- Обеспечение чистоты.
- Контроль параметра напряжения отключенной цепи.
- Обеспечение необходимого уровня электролита, доливки дистиллированной воды.
- Проверка концентрации электролита ареометром.
При использовании батареек (гальванических элементов) нужно выполнять требования, которые относятся к применению электрических приборов.
Сфера использования
В современное время химические источники тока используются в:
- Транспорте.
- Переносных устройствах.
- Космической технике.
- Оборудовании научных исследований.
- Медицинских приборах.
Применяются в бытовой сфере:
- Батарейки (сухие).
- Батареи аккумуляторов электроники.
- Аккумуляторы на автомобилях.
Большое распространение нашли литиевые химические источники тока. Это обусловлено наличием у лития максимальной удельной энергии. Он отличается наиболее отрицательным потенциалом электрода из металлов. Батареи литий ионного типа опередили все другие источники по размеру значений удельной энергии. В настоящее время ученые разрабатывают различные усовершенствования литиевых аккумуляторов. Разработки ведутся в направлении получения конструкций корпуса сверхмалой толщины, которые будут использоваться для питания смартфонов и подобных им гаджетов, а также создание сверхмощных батарей аккумуляторов.
В последнее время серьезные работы ученых ведутся по изобретению и модернизации топливных батарей – устройств, которые создают электрическую энергию, за счет проведения химических реакций веществ, постоянно подающихся к электродам снаружи. Для окисления берут кислород, а в качестве топлива пытаются использовать водород. На основе таких батарей уже действуют некоторые опытные образцы на электростанциях.
Источник