- Этилен, структурная формула, химические, физические свойства
- Физические свойства этилена (этена):
- Видео
- Получение этилена
- Химические свойства
- Реакции окисления
- Применение и использование этилена (этена):
- Этилен
- Характеристики и физические свойства этилена
- Получение этилена
- Химические свойства этилена
- Применение этилена
- Примеры решения задач
- Этилен (этен), получение, свойства, химические реакции
- Электронное и пространственное строение молекулы
- Видео
- Получение
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Получение этилена
- Примеры решения задач
Этилен, структурная формула, химические, физические свойства
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Видео
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
— дегидратация этилена при его нагревании с серной кислотой (t >150 
— дегидрирование этана при нагревании (500
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции окисления
1. Горение. Взаимодействие с кислородом
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
Приведём уравнение реакции горения алкенов в общем виде:
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
В схемах обычно изображают формулы исходного органического вещества и продукта его превращения. При этом легче проследить за изменениями органического вещества в ходе реакции. В схемах, как правило, ставят коэффициенты только перед формулами органических веществ. Формулы реагентов, под действием которых происходит превращение органического вещества, принято писать над стрелкой. В данном случае это перманганат калия (KMnO4) и растворитель (вода).
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH , то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Видео 15.1. Качественные реакции на двойную связь Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии. Так же, как и реакция с бромной водой, реакция с растворомперманганатакалияявляетсякачественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π -связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду.
Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни.
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации.
Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь.
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com
Найти что-нибудь еще? 

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена напишите уравнение реакций этилен
Источник
Этилен
Характеристики и физические свойства этилена
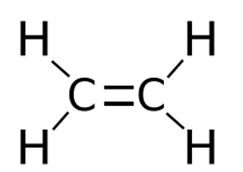
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400 o С, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
| Задание | Осуществите ряд превращений: |
этан → этен → этанол → этен → хлорэтан → бутан.
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? |
| Решение | Запишем в общем виде уравнения бромирования и гидрирования алкена: |
Рассчитаем количество вещества водорода:
n(H2) = 6,72 / 22,4 = 0,3 моль,
следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна:
что соответствует формуле C4H8.
Найдем массу брома:
M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль;
m(MnO2) = 0,3 × 160 = 48 г.
Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4).
Источник
Этилен (этен), получение, свойства, химические реакции
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sp 2 —гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Видео
Получение
- Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
- Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
- На производстве этилен получают из природного газа и при процессах пиролиза нефти.
- Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
- При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Примеры решения задач
Задание Осуществите ряд превращений: этан → этен → этанол → этен → хлорэтан → бутан. Решение Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl.
Задание Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? Решение Запишем в общем виде уравнения бромирования и гидрирования алкена: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n+2 (2). Рассчитаем количество вещества водорода: n = V / Vm; n(H2) = V(H2) / Vm; n(H2) = 6,72 / 22,4 = 0,3 моль, следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 г/моль, что соответствует формуле C4H8. Согласно уравнению (1) n(CnH2n) :n(Br2) = 1:1, т.е. n(Br2) = n(CnH2n) = 0,3 моль. Найдем массу брома: m = n×M; m(Br2) = n(Br2) × M(Br2); M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль; m(MnO2) = 0,3 × 160 = 48 г. Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4). CH2=CH-CH2-CH3 (1); CH3-CH=CH-CH3 (2); CH2=C(CH3)-CH3 (3); C4H8 (4). Ответ Масса брома равна 48 г.
Источник