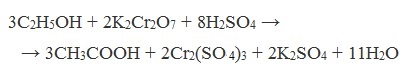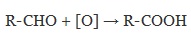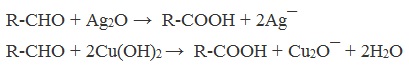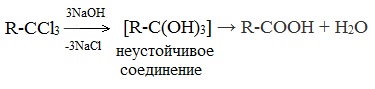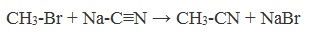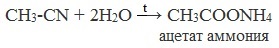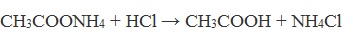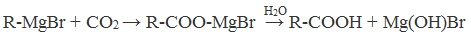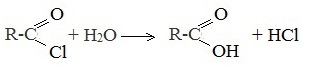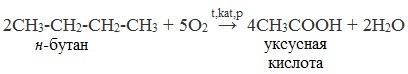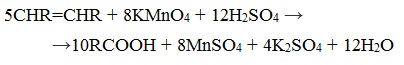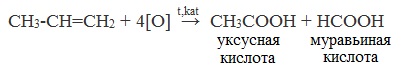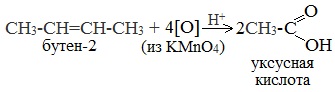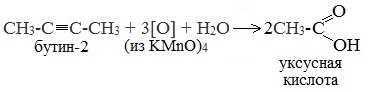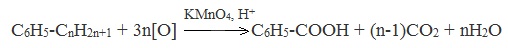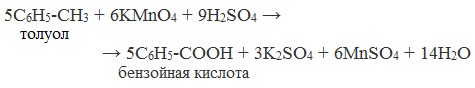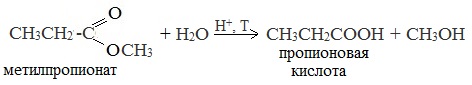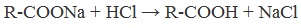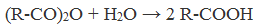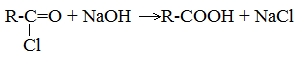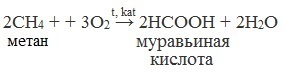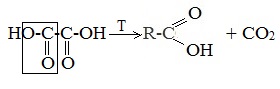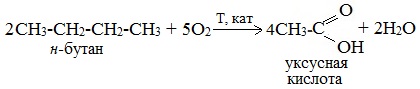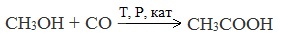- Карбоновые кислоты — номенклатура, получение, химические свойства
- Классификация карбоновых кислот
- Номенклатура карбоновых кислот
- Изомерия карбоновых кислот
- Способы получения карбоновых кислот
- Химические свойства карбоновых кислот
- Химические свойства карбоновых кислот способы получения карбоновых кислот
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
Карбоновые кислоты — номенклатура, получение, химические свойства
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН,
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота: HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.
Изомерия карбоновых кислот
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Строение карбоксильной группы:
Электронная плотность π-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
В водном растворе карбоновые кислоты диссоциируют на ионы.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Способы получения карбоновых кислот
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на силу карбоновых кислот
- Донорные группы увеличивают прочность связи кислород-водород или дестабилизируют карбоксилат анион, подавая ещё больше электронной плотности, это приводит к уменьшению силы кислот.
- Акцепторные группы уменьшают электронную плотность связи кислород-водород или стабилизируют карбоксилат анион, это приводит к увеличению силы кислот (значение рКа уменьшается).
Источник
Химические свойства карбоновых кислот способы получения карбоновых кислот
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
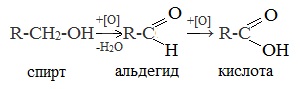
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
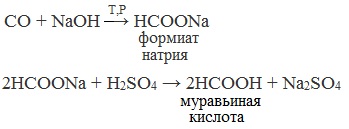
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
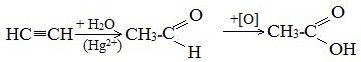
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Источник