- Ионная связь
- Катионы и анионы
- Образование ионной связи
- Характеристики ионной связи
- Характеристика ионной связи способ образования связи
- Ковалентная химическая связь
- Ионная химическая связь
- Металлическая связь
- Новости
- Ионная связь
- Механизм образования ионной связи
- Свойства ионной связи
- Еще по этой теме:
- Серная кислота
- Теперь «ХиШник» стал полностью бесплатным
- Азотная кислота
- Диены
- Правило Марковникова
- Таблицы для ЕГЭ по химии
- Внеклассное мероприятие по химии
- Формулы для решения задач по химии
- Химические профессии
- ЕГЭ по химии 2019
- Критерии оценивания ОГЭ по химии, баллы 2019
- Изменения ОГЭ по химии в 2019 году
- Подготовка к ОГЭ по химии
- Онлайн тесты по химии
- Все об ОГЭ по химии в 2019
- Тест по химии 11 класс
- Тест по химии 10 класс
- Тест по химии 9 класс
- Тест по химии 8 класс
- Водородная связь
- Подготовка к ЕГЭ по химии с нуля
- Металлическая связь
- Ковалентная связь
- Шкала перевода баллов ЕГЭ по химии 2018
- Учимся на летних каникулах
- «ХиШник» приехал на Сахалин!
- Мой сын увлёкся химией, что делать?
- Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
- О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
- Современный задачник по химии
- Выбираем репетитора по химии: инструкция
- Научиться решать задачи по химии легко: следуем инструкции
- Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
- Обновление в демонстрационной версии «ХиШника»
- Активация лицензионного ключа и первые шаги в «ХиШнике».
- Современный урок химии по ФГОС
- ХиШник в школе: ИКТ на уроках химии
- Ура! Новые планы ХиШника и подарочки
- Родина приложения «ХиШник» – Новосибирский Академгородок
- Можно ли просматривать историю решения задач учениками в онлайн-режиме?
- Можно ли заниматься в «ХиШнике» со смартфона/планшета?
- Семинар от «ХиШника» на КПК для учителей химии
- Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
- Как купить полный доступ к приложению?
- «ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
- Спасибо!
Ионная связь
Что такое ионная связь, как она образуется, каковы ее характеристики и примеры и свойства веществ с ионным типом связи рассмотрим в этом разделе.
Катионы и анионы
Отдельные атомы какого-либо элемента будут стремиться к устойчивой восьмиэлектронной структуре, теряя или приобретая электроны. Такие частицы называются ионами.
Атомы, захватившие электроны, имеют отрицательный заряд и называются анионами
Атомы, потерявшие электрон, имеют положительный заряд и называются катионами.
Образование ионной связи
При встрече анионов с катионами образуется ионная связь, а образуемое соединение называется ионным.
Ионные соединения образуются, при связывании атомов с большой разностью электроотрицательностей (как правило, более, чем 1,7).
Поэтому логично предположить, что при соединении металлов с неметаллами, будет возникать ионное соединение с ионной связью, т.к. их электроотрицательности очень различаются.
Схема образования ионной связи на примере хлорида лития
Так, при встрече атома лития (ЭО = 1,0) с атомом хлора (ЭО = 3,1) происходит переход атомов в ионы. Литий отдает свои электроны хлору, превращаясь в катион лития Li + . Атом хлора превращается в анион хлора Cl — .
Происходит образование ионной связи за счет притяжения разноименно заряженных ионов Li + и Cl —
Примеры соединений с ионной связью — NaCl, NH4Cl, BaBr2, CaO, FeSO4, Cu(NO3)2 и др.
Обратите внимание на то, что полной передачи электронов от одного атома к другому практически не происходит, поэтому корректнее было бы говорить об ионности (ионном характере) связи. Ионная связь является крайним случаем ковалентной связи.
Характеристики ионной связи
Ионная связь не имеет направленности и насыщаемости.
Ионные соединения часто имеют сходные свойства. Они стремятся образовывать группы, которые, в свою очередь, образуют еще более крупные группировки, типа LinClm. Такие образования называются кристаллами. Это происходит из-за того, что ионная связь не имеет направленности и насыщаемости.
Источник
Характеристика ионной связи способ образования связи
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
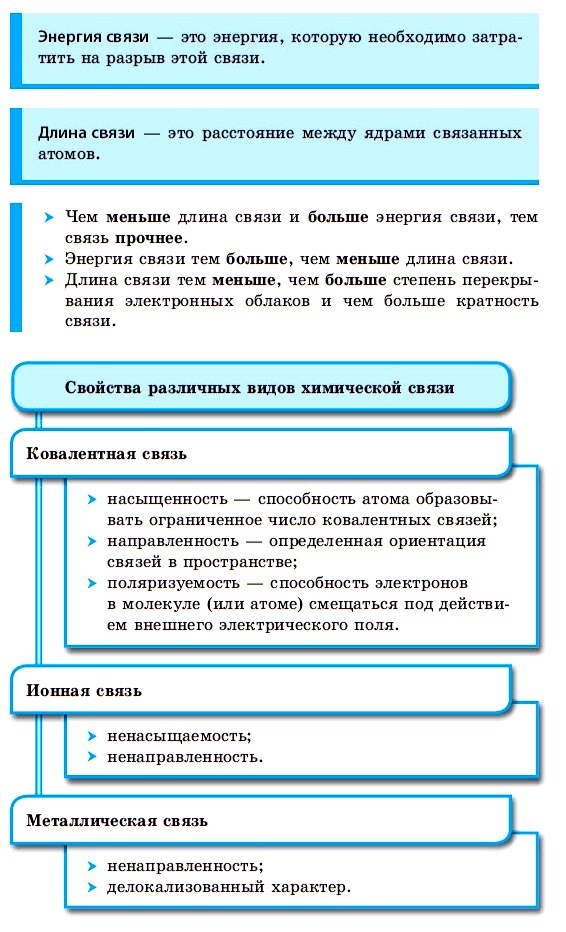
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
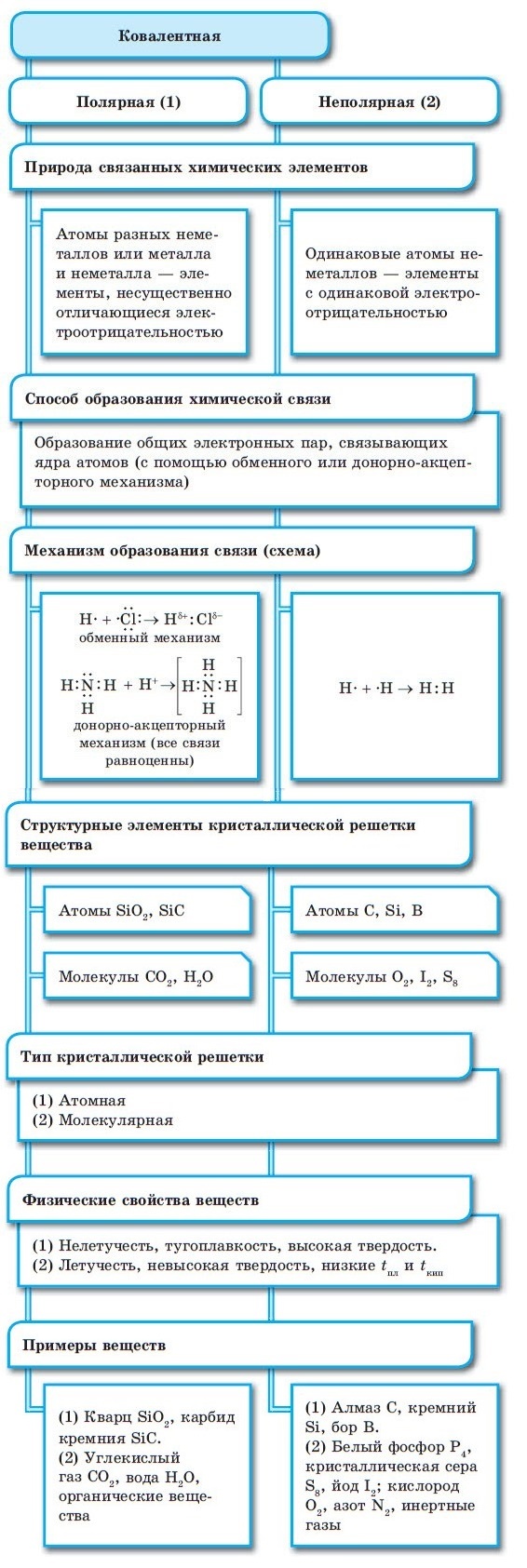
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
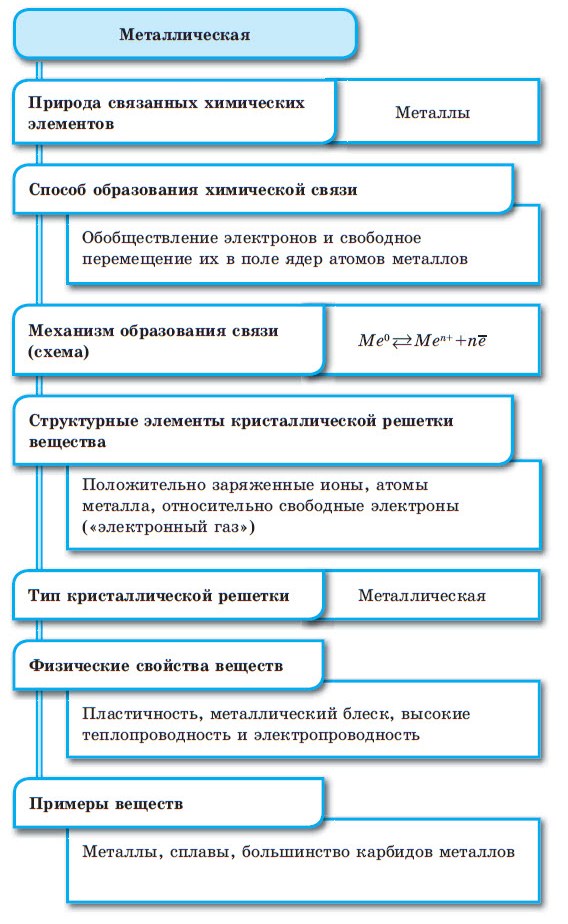
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Источник
Новости
Ионная связь
В 1916 году немецким учёным В. Касселем было выдвинуто предположение о том, что атомы, взаимодействуя друг с другом, либо отдают электроны, тем самым превращаясь в катионы, либо, наоборот, принимают их и становятся анионами. При взаимном притяжении образовавшихся “разноимённых” (несущих на себе противоположные заряды) ионов происходит образование ионной химической связи.
• Ионы – это либо отрицательно (анионы), либо положительно (катионы) заряженные частицы.
Ионная связь, как правило, возникает при взаимодействии металла и неметалла. При этом типичные соединения с ионной связью состоят из катионов металлов, находящихся в I и II группах периодической таблицы, и анионов неметаллов из VI и VII групп.
Механизм образования ионной связи
Атом неметалла, участвующий в образовании ионной связи, достраивает внешний энергетический уровень до устойчивой конфигурации, принимая электроны. Рассмотрим механизм образования ионной связи на примере хлорида натрия.
Na – щелочной металл, который располагается в первой группе таблицы Менделеева. Он имеет один электрон на внешнем (так называемом, валентном) уровне, который способен отдать, тем самым завершить энергетический уровень. Отдавая электрон, атом натрия превращается в катион.
Cl – галоген, находящийся в седьмой группе таблицы Менделеева . Он имеет семь валентных электронов на внешнем энергетическом уровне. Для заполнения энергетического уровня ему нужно принять один электрон. Принимая его, молекула хлора образует хлорид-ион (анион).
Ионы способны образовывать соединения за счёт существования между ними электростатического притяжения.
Свойства ионной связи
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Таблицы для ЕГЭ по химии
В статье представлены таблицы, необходимые при изучении химии и сдаче ЕГЭ.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Металлическая связь
Продолжаем серию статей про виды химической связи.
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Или не выбираем
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
support@hishnik-school.ru
Для СМИ:
onp@alekta.ru
Спасибо!
от 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Источник