- Потенциометрическое титрование
- Определение точки эквивалентности
- Виды потенциометрического титрования
- Кислотно-основное титрование
- Комплексонометрическое титрование
- Титрование по методу осаждения
- Окислительно-восстановительное титрование
- Лабораторные работы по теме: Потенциометрическое титрование
- Описание
- Оглавление
- 1. Лабораторная работа. Определение содержания хлороводородной и борной кислот при совместном присутствии методом потенциометрического титрования
- Потенциометрическое титрование
- Оглавление
- Теоретическая часть
- Экспериментальная часть
- Методика выполнения работы
- Обработка результатов анализа
- 2. Лабораторная работа. Определение cодержания органической кислоты в растворе и ее константы кислотности методом потенциометрического титрования
- Потенциометрическое титрование
- Оглавление
- Теоретическая часть
- Экспериментальная часть
- Методика выполнения работы
Потенциометрическое титрование
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда когда хотя бы один из участников реакции титрования является участником электродного процесса. Так, например, титрование по методу кислотно-основного взаимодействия может быть выполнено со стеклянным электродом. Определение хлорида — с хлорсеребряным и т.д. Так же, как и в других титриметрических методах, реакции потенциометрического титрования должны протекать строго стехиометрически, иметь высокую скорость и идти до конца.
Для потенциометрического титрования собирают цепь из индикаторного электрода в анализируемом растворе и электрода сравнения. В качестве электродов сравнения чаще всего применяют каломельный или хлорсеребряный.
Определение точки эквивалентности
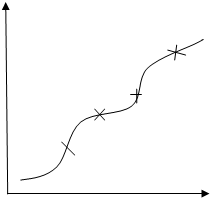
На рис. А представлена кривая титрования хлороводородной кислоты (HCl) гидроксидом натрия (NaOH). Она почти точно воспроизводит теоретическую кривую титрования сильной кислоты сильным основанием. Как видно, в точке эквивалентности происходит резкий скачок ЭДС, вызванный резким изменением потенциала индикаторного электрода. По этому скачку можно определить точку эквивалентности и потом рассчитать содержание хлороводородной кислоты.
Для нахождения точки эквивалентности часто строят дифференциальную кривую в координатах dE/dV — V (рис. Б). На точку эквивалентности указывает максимум полученной кривой, а отсчет по оси абсцисс, соответствующий этому максимуму, дает объем титранта, израсходованного на титрование до точки эквивалентности. Определение точки эквивалентности по дифференциальной кривой значительно точнее, чем по простой зависимости E — V.
Поскольку производная функции, имеющей максимум, в точке максимума равна нулю, вторая производная потенциала по объему (d 2 E/dV 2 ) в точке эквивалентности будет равна нулю. Это свойство также используется для нахождения точки эквивалентности (рис. В).
В простом и удобном методе Грана точка эквивалентности определяется по графику в координатах dV/dE-V. Перед точкой эквивалентности и после нее кривая Грана линейна, а сама точка эквивалентности находится как точка пересечения этих прямых (рис. Г). Достоинства и удобства метода Грана особенно заметны при анализе разбавленных растворов, позволяя определить точку эквивалентности с достаточной точностью вследствие линейности графика.
Виды потенциометрического титрования
Кислотно-основное титрование
В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка. Например, при титровании смеси, содержащей хлороводородную (HCl) и уксусную кислоты, на кривой титрования обнаруживается два скачка. Первый свидетельствует об окончании титрования HCl, второй скачок наблюдается при оттитровывании уксусной кислоты. Также несколько скачков имеют кривые титрования многоосновных кислот, константы диссоциации которых существенно различаются (хромовая, фосфорная и др.).
Широкие возможности анализа многокомпонентных смесей без разделения открывает применение неводных растворителей. Например, определение содержания хлороводородной и монохлоруксусной кислот в смеси титрованием водного раствора является сложной задачей в связи с трудностью обнаружения двух скачков титрования. При титровании в ацетоне оба скачка выражены достаточно четко и содержание каждой кислоты в смеси может быть рассчитано.
Комплексонометрическое титрование
Потенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом, солей цинка с цинковым и т.д. или подходящего ионоселективного электрода. Однако, многие металлические индикаторные электроды необратимы, а число ионоселективных электродов невелико.
Для комплексонометрических титрований может быть использован универсальный электрод Hg|HgY 2- или Au(Hg)|HgY 2- где Au(Hg) — амальгамированное золото; HgY 2- — комплекс ртути с анионом этилендиаминтетрауксусной кислоты. С помощью ртутного электрода этого типа могут быть оттитрованы любые ионы, которые образуют с Y 4- комплексы с константой устойчивости, не превышающей константу устойчивости ртутного комплекса. Это, например, ионы магния (Mg 2+ ), кальция (Ca 2+ ), кобальта (Co 2+ ), никеля (Ni 2+ ), меди (Cu 2+ ), цинка (Zn 2+ ) и др.
Титрование по методу осаждения
Индикаторными электродами в методах потенциометрического титрования, использующих реакции осаждения, служат металлические или мембранные электроды, чувствительные к определяемому иону или иону-осадителю. Практически по методу осаждения могут быть определены катионы серебра, ртути, цинка, свинца, анионы хлора, брома, иода и некоторые другие. Смесь галогенидов, например I — и Cl — , может быть оттитрована без разделения нитратом серебра. Серебряный электрод позволяет фиксировать два скачка в ходе такого титрования. Первый скачок свидетельствует об оттитровывании иодид-иона и может быть использован для расчета содержания этого иона, второй скачок относится к окончанию осаждения хлорид-иона. По второму скачку можно рассчитать суммарное содержание галогенидов или концентрацию хлорид-иона, если концентрация иодид-иона будет известна из данных по титрованию до первого скачка.
Окислительно-восстановительное титрование
Кривые окислительно-восстановительного титрования могут быть построены в координатах или pM — V (титранта) или E — V (титранта), если pM=-lg[M] ([M] — концентрация участника реакции, E — потенциал системы, V (титранта) — объем титранта. Кривые титрования первого типа представляют практический интерес, когда имеется индикаторный электрод, чувствительный к M. Кривые второго типа имеют более общее значение, так как любое окислительно-восстановительное титрование может быть проведено по измерению E с использованием индикаторного электрода из благородного металла, чаще всего платины.
Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. — 2-е изд., перераб. и доп. — М.:Дрофа, 2002. — 384 с., ил. — С. 202-207.
Для проведения потенциометрического титрования удобно использовать специализированные приборы — автоматические титраторы (автотитраторы).
В серии приборов МУЛЬТИТЕСТ есть специализированные автоматические титраторы ИПЛ-101-1 и ИПЛ-111-1. Эти приборы могут работать в двух режимах. При работе в режиме pH-метра/иономера прибор управляет релейными выходами, которые могут сигнализировать о выходе величины ЭДС или концентрации за ранее установленные пределы.
При работе в режиме титратора, прибор самостоятельно управляет дозирующим устройством и осуществляет титрование до конечной точки, заданной в величинах ЭДС (потенциала) или pH (pX). Блок автоматического титрования БАТ-15 для управления дозирующим устройством не требуется.
В обоих режимах работы прибор может выдавать результат измерения на аналоговый выход (на самописец или аналогичное устройство) или передавать их в компьютер.
При титровании для построения графика и обработки результатов можно использовать соответствующее программное обеспечение.
Источник
Лабораторные работы по теме: Потенциометрическое титрование
| Сайт: | Информационно-образовательная среда |
| Курс: | Аналитическая химия |
| Книга: | Лабораторные работы по теме: Потенциометрическое титрование |
| Напечатано:: | Гость |
| Дата: | Пятница, 19 Ноябрь 2021, 18:34 |
Описание
Лабораторные работы по теме: Потенциометрическое титрование
Оглавление
1. Лабораторная работа. Определение содержания хлороводородной и борной кислот при совместном присутствии методом потенциометрического титрования
Потенциометрическое титрование
Оглавление
Теоретическая часть
Потенциометрическое определение концентрации водородных ионов или величины рН основано на измерении электродного потенциала, возникающего при погружении электродов в анализируемый раствор.
Измерение электродного потенциала осуществляется с помощью систем, состоящих из двух электродов. Один из них — индикаторный (стеклянный, платиновый) электрод — чувствителен к ионам, присутствующим в растворе, и потенциал, возникающий на нем, зависит от концентрации ионов в анализируемом растворе. Другой электрод — электрод сравнения (каломельный или хлорсеребряный) — не чувствителен к ионам раствора и потенциал его постоянен.
При погружении в раствор стеклянного электрода, представляющего собой тонкослойный шарик из литиевого стекла, происходит обмен ионами между раствором и поверхностью шарика. Ионы лития проникают из стекла в раствор, а ионы водорода — из раствора в стекло. На поверхности стеклянного электрода устанавливается потенциал, величина которого определяется концентрацией водородных ионов.
Титрование хлороводородной кислоты в борной (К(Н3ВО3)=10 -7 ; рК (Н3ВО3)=9,24) осуществляется с большой точностью.
Борную кислоту по кислотно-основному методу оттитровать непосредственно нельзя из-за малой величины константы диссоциации. Однако, если к раствору после завершения титрования хлороводородной кислоты прибавить соответствующий лиганд (манит, глицерин и т.д.), усиливающий кислотные свойства борной кислоты (при этом борная кислота образует комплексную борно-глицериновую (борноманнитовую) кислоту, обладающую относительно большой константой диссоциации (К а = 10 -5 )), то ее можно определить количественно.
Экспериментальная часть
Цель работы: Ознакомиться с методом потенциометрического титрования; по результатам титрования вычислить массу навесок хлороводородной и борной кислот в анализируемом растворе.
Оборудование и реактивы:
рН-метр, электромагнитная мешалка, штатив, бюретка, 2 сосуда для титрования;
0,1000 М раствор NaOH, глицерин, растворы HCl и H3BO3 с молярной концентрацией эквивалента 0,1 моль/л.
Методика выполнения работы
Включить рН-метр. Промыть электрод и магнитную мешалку дистиллированной водой и просушить фильтровальной бумагой. Налить в сосуд для титрования раствор борной кислоты Н3ВО3 такое количество, чтобы шарик из литиевого стекла был погружен в раствор. Погруженный с сосуд электрод не должен доходить до дна на 4-6 мм. После того как показания примут устойчивые значения, записать в журнале величину рН раствора кислоты.
Найденная величина рН показывает, что в случае титрования смеси НСI и Н3ВО3 до достижения этого значения рН, борная кислота еще не вступает в реакцию со щелочью.
Затем в сосуд для титрования с раствором Н3ВО3 добавить 5 мл глицерина. Смесь размешать на магнитной мешалке. Измерить рН2
(Почему и как изменилось значение рН2 по сравнению с рН1?)
Промыть и просушить фильтровальной бумагой магнитную мешалку. Промыть электроды 2-3 раза дистиллированной водой и просушить фильтровальной бумагой.
Получить задачу для анализа. Долить содержимое сосуда, если нужно, дистиллированной водой, чтобы стеклянный шарик из литиевого стекла был погружен в этот раствор. Положить мешалку, перемешать магнитной мешалке. Определить рН.
Провести ориентировочное титрование. Для этого к содержимому в титрационный сосуд прибавить 1 мл NaOH. Перемешать. Определить рН… и так до тех пор, пока не обнаружится первый скачок рН, отвечающий оттитрованию НСI. Данные записать в таблицу 1.
Затем к раствору прибавить 5 мл глицерина. Перемешать до полного растворения. Продолжать титрование с градиентом приливания 1 мл до обнаружения второго резкого скачка рН, соответствующего значению рН конца титрования бороглицериновой кислоты. Данные ориентировочного титрования записать в таблицу:
По результатам ориентировочного титрования определите скачки рН, отвечающие оттитровыванию HCl и H3BO3.
Затем выполняют точное титрование анализируемого раствора (во втором сосуде для титрования) в тех же условиях, с градиентом приливания 0,5 мл в области скачков титрования. Данные записать в таблицу 2.
По данным титрования построить два графика в координатах:
V1 — Объем щелочи, затраченной на титрование НСI
V2 — Объем щелочи, затраченной на титрование НСI и Н3ВО3
Обработка результатов анализа
Вычисления проводят на основе построенных кривых титрования.
1. По первому скачку рН (V1) найти массу НСI во взятом для титрования объеме:
2. Найти массу Н3ВО3 (в соответствии с объемом затраченной на титрование щелочи):
По окончании работы электроды промыть 2-3 раза дистиллированной водой и оставить опущенными в стакан с дистиллированной водой. рН-метр и магнитную мешалку отключить от сети.
2. Лабораторная работа. Определение cодержания органической кислоты в растворе и ее константы кислотности методом потенциометрического титрования
Потенциометрическое титрование
Оглавление
Теоретическая часть
Потенциометрическое определение концентрации водородных ионов или величины рН основано на измерении электродного потенциала, возникающего при погружении электродов в анализируемый раствор.
Измерение электродного потенциала осуществляется с помощью систем, состоящих из двух электродов. Один из них — индикаторный (стеклянный, платиновый) электрод — чувствителен к ионам, присутствующим в растворе, и потенциал, возникающий на нем, зависит от концентрации ионов в анализируемом растворе. Другой электрод — электрод сравнения (каломельный или хлорсеребряный) — не чувствителен к ионам раствора и потенциал его постоянен.
При погружении в раствор стеклянного электрода, представляющего собой тонкослойный шарик из литиевого стекла, происходит обмен ионами между раствором и поверхностью шарика. Ионы лития проникают из стекла в раствор, а ионы водорода — из раствора в стекло. На поверхности стеклянного электрода устанавливается потенциал, величина которого определяется концентрацией водородных ионов.
Титрование хлороводородной кислоты в борной (К(Н3ВО3)=10 -7 ; рК (Н3ВО3)=9,24) осуществляется с большой точностью.
Борную кислоту по кислотно-основному методу оттитровать непосредственно нельзя из-за малой величины константы диссоциации. Однако, если к раствору после завершения титрования хлороводородной кислоты прибавить соответствующий лиганд (манит, глицерин и т.д.), усиливающий кислотные свойства борной кислоты (при этом борная кислота образует комплексную борно-глицериновую (борноманнитовую) кислоту, обладающую относительно большой константой диссоциации (К а = 10 -5 )), то ее можно определить количественно.
Экспериментальная часть
Цель работы: Ознакомиться с методом потенциометрического титрования; по результатам титрования определить содержание органической кислоты в растворе и константу кислотности рКа.
Оборудование и реактивы:
рН-метр рН-150МА, электромагнитная мешалка, штатив, бюретка, 2 сосуда для титрования.
0,1000 М раствор NaOH, органическая кислота, 10%-ный водный раствор этилового спирта.
Потенциометрическое определение концентрации водородных ионов или величины рН основано на измерении электродного потенциала, возникающего при погружении электродов в анализируемый раствор.
Методика выполнения работы
1. Приготовление раствора кислоты:
Навеску кислоты (50 мг) растворяют при незначительном нагревании в 50 мл 10%-ного водного этанола (молярная концентрация кислоты ≈ 0,01 моль/л).
2. Бюретку для титрования заполнить раствором щелочи.
3. Стакан с исследуемым раствором и маленькой мешалкой поставить на магнитную мешалку (предварительно включив ее в сеть).
4. Включить рН-метр в сеть, нажать кнопку «вкл/выкл». Для измерения рН установить кнопкой «ВЫБОР» единицы измерения «рН». Промыть электроды дистиллированной водой и погрузить в измеряемый раствор на глубину 4-5 см. Если необходимо, долить содержимое стакана дистиллированной водой, чтобы стеклянный шарик из литиевого стекла был погружен в раствор. После того как показания примут устойчивые значения, считать результат измерения с дисплея.
5. Провести титрование с градиентом приливания 0,5 мл, измеряя и записывая значение рН после каждого добавления раствора щелочи и при постоянном перемешивании раствора. Титровать до тех пор, пока значение рН не достигнет 12. Данные титрования записать в таблицу 1.
Таблица 1. Результаты потенциометрического титрования.
Источник