Способы выражения состава газовых смесей и расчет их физико-химических характеристик (Mсм, ρсм, Δг)
Автор работы: Пользователь скрыл имя, 16 Января 2014 в 00:29, практическая работа
Описание работы
Рассмотрим физические свойства природных газов.
Единицей количества вещества является моль [n] .Это такое количество вещества, в котором содержится столько же структурных элементов, сколько атомов в 12 г углерода-12.
Причем масса 1 моля вещества в граммах m численно равна его относительной (в углер. единицах) молекулярной массе М.м. Поэтому моль условно называют грамм-молем или килограмм-киломолем.
Файлы: 1 файл
5,6 Теория Фпл.doc
Практическое занятие 5
Способы выражения состава газовых смесей и расчет их физико-химических
Рассмотрим физические свойства природных газов.
Единицей количества вещества является моль [n] .Это такое количество вещества, в котором содержится столько же структурных элементов, сколько атомов в 12 г углерода-12.
Причем масса 1 моля вещества в граммах m численно равна его относительной (в углер. единицах) молекулярной массе М.м. Поэтому моль условно называют грамм-молем или килограмм-киломолем.
Молярная масса — физическая величина, равная отношению массы к количеству вещества.
Размерность в СИ — [кг/моль]. Молярная масса, выраженная в [г/моль; кг/км] численно равна относительной молекулярн ой массе. М [г/моль; кг/кмоль]=М.м
Идеальным называется газ, в котором не учитывается взаимодействие молекул и наличие у них собственного объема.
Для идеальных газов справедливы следующие уравнения состояния, связывающие между собой P, V, T газа:
Бойля- Мариотта PV = const T = const
Гей-Люссака V/T = const P = const
Шарля P/T = const V = const
По закону Авагадро 1 киломоль любого газа при Н.У. (Р = 0,101МПа=1атм, Т =273К) занимает объем 22,4 м 3 (а 1 моль — 22,4 л), называемый нормальным молярным объемом Vм. [м 3 /кмоль]
При СТ.У. (Р=0,101МПа, Т=293К) стандартный молярный объем Vм=24,05м 3 (из закона Гей-Люссака). [Vм=объем газа м 3 /1кмоль.]
Общая зависимость между параметрами для 1 моля или 1 киломоля газа:
Было установлено, что const в этом уравнении для 1 киломоля газа равно R — универсальной газовой постоянной. R=8,3*10 3 [Дж/кмоль*град]. А для n кмолей газа, занимающих объем V, обобщенное уравнение состояния — уравнение Менделеева- Клапейрона
PV=nRT или PV=GRT — для его произвольной массы G
V — объем газа [м 3 ];
G — масса газа, [кг](G=n*Mг, n-число кмолей, Mг-молекулярная масса газа);
(R =R/Mг-удельная газовая постоянная в [Дж/кг*град ]), T-абсолютная температура ( = 273 К ).
А через молярный объем Vм (т.е. для 1 моля или кмоля газа) 1 моль — 22,4 л (= 22,4 * 10-3 м3)
Плотность газа в Н.У. или СТ.У. определяется по формуле
Мг — молекулярная масса, Vм — молярный объем в Н.У. (=22.4) или СТ.У. (=24.05)
При производственных расчетах используют относительную плотность газа по воздуху
При СТ.У. ρвоздуха=1,205
Компонентный состав газовой или жидкой смеси может быть выражен в виде массовой или молярной концентрации. Сумма долей всех компонентов, составляющих смесь равна 1.
Массовая концентрация или доля i компонента в смеси определяется
где mi — масса этого компонента,
k — число компонент
Σmi— сумма всех имеющихся масс в смеси
По закону Авогадро для газов, молярная доля в Н.У. и СТ.У совпадает с обьемной.
Молярная (или объемная) доля i компонента Ni определяется как:
к- число компонентов
Σni— сумма всех имеющихся масс в смеси
На практике состав газовой смеси обычно приводят в объемных т.е. молярных концентрациях.
Если молярная концентрация компонента Ni выражена в долях, то ΣNi, равную 1 принимают за 1 кмоль.
Если молярная концентрация компонента Ni выражена в %, то ΣNi равную 100% принимают за 100 кмоль.
Массы компонент смеси, при известном молярном составе Σni [кмоль]
Массы компонентов в смеси с неизвестным абсолютным составом находят через Ni доли
Если молярная концентрация каждого газа Ni задана в долях ед., то ΣNi которая равна 1, принимают за 1 кмоль. Тогда mi компонента в [кг] приходится на 1 кмоль смеси. [кг в 1 кмоль кг * 1 кмоль ]
Если молярная концентрация каждого газа задана в %, то ΣNi , которая равна 100%, принимают за 100 кмоль. Тогда молярная доля каждого i компонента выраженная в %, численно равна числу его кмоль. Т.е Ni в % численно равно Ni в кмоль
И mi компонента [кг] приходится на 100 кмоль смеси
СН4 m=300 кг М=16,04 кг/кмоль
С3Н8 m=500 кг М=44, 097 кг/кмоль
1. Найти число молей
2. Найти молярную долю в смеси
3.Массы компонентов при известной молярной массе
4.Массы компонентов при неизвестном молярном составе
Если Ni в долях то m на 1 киломоль смеси. Если Ni в %, m на 100 киломоль.
Молярная масса в кмоль численно равна молекулярной массе.
Связь между молярной и массовой долей i компонента
Ni в долях или %, то Gi в долях ( 7 )
Мольная доля через массовую
Gi в долях или % — Ni в долях
Здесь, если массовый состав Gi выражен в %, то его ΣGi принимают за 100 кг. И для определения молярной доли каждого компонента Ni надо его массу Gi ( численно равную процентному содержанию этого компонента в смеси) разделить на его молекулярную массу Mi . Т.е. если Gi в %, то Ni — в долях единицы.
Массовые доли Gi Если даны только молярные Ni доли или %, то Gi
300 0,432 * 16,04 6,929
1200 0,432 * 16,04 + 0,307 * 30,07 + 0,261*44,097 27,669
С2Н6 = —- = 0,333 G = ———- = 0,334
C3H8 = —— = 0,417 G = ———— = 0,416
Если молярные (объемные) доли (Ni) компонент выражены в %, то средняя молекулярная масса газовой смеси
[ кг / кмоль ] ; Ni [ % ] , Mi [ кг /кмоль ] (8)
А если молярные доли выражены в долях единиц, то средняя молекулярная масса газ. смеси
Плотность смеси газов и относительную плотность смеси по воздуху определяют по формулам, аналогичным 2, 3, но где вместо Мг и ρг будут стоять Мсм и ρсм.
Δсм =ρсм /1,293 (при Н.У) или (1,205 — при С.У.)
Средняя молекулярная масса
Средняя плотность смеси
1. Ni — объемные доли компонент смеси газов в С.У в [ % ]
2. Mi — молекулярные массы компонент
метан СН4 Mi = 16, 043 [кг/кмоль]
mi — массы компонент в [кг] ф.6
Gi — массовая концентрация каждого компонента данной смеси газов в [долях]
Mсм — среднюю молекулярную массу смеси [ кг / кмоль ] ф.8
ρсм — плотность газа данного состава в С.У и Н.У [кг/м 3 ]
Δг — относительную плотность газа данного состава
Оформить в виде таблицы:
Массовый состав Gi
Внизу таблицы — среднюю Мсм, ρсм и Δг
Практическое занятие 6
Расчет приведенных параметров газа и его свойств в пластовых условиях
Для реальных газов, чтобы связать параметры состояния P, V и T, требуется вводить большое количество констант. Например, в зависимость P от V входят 5 констант, каждая из которых зависит от температуры. Поэтому имеется большое количество уравнений состояния, не достаточно точных, зато компактных, имеющих только 3 константы — например уравнение Ван-дер-Ваальса.
Экспериментально было показано, что для реальных газов в уравнение Менделеева- Клапейрона надо ввести коэффициент z
PV=znRT или PV=z T
который называется коэффициентом сверхсжимаемости газа и имеет смысл отклонения объема реального газа от идеального z=Vр/V идеального. Для идеального газа z=1
Коэффициент сверхсжимаемости является функцией приведенных давлений и температур: z = (Pпр, Tпр).
Приведенными параметрами индивидуальных газов называются безразмерные величины, показывающие во сколько раз действительные параметры состояния газа больше или меньше критических.
Приведенные параметры для смеси газов определяются по аналогич ным формулам , где вместо Pкр, Tкр, Vкр подставляют среднекритические значения для смеси Pкр.см, Vкр.см, Tкр.см, zкр.см, которые в свою очередь вычисляются по правилу аддитивности
Источник
Газовые смеси способы выражения состава смесей
Для того чтобы воспользоваться уравнением Менделеева-Клапейрона для смеси газов
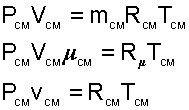 |
необходимо знать газовую постоянную RСМ и молярную массу (условную) смеси µСМ. Для смеси, как для любого идеального газа, эти две величины связаны соотношением RСМ=8314/µСМ (Дж/(кг•К)). Чтобы рассчитать эти величины, необходимо знать состав смеси газов, т.е. какие газы и в какой пропорции входят в смесь.
Состав смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей gi данного газа называется отношение его массы к массе всей смеси:
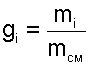 |
где mi – масса отдельного газа, входящего в смесь;
mСМ – общая масса смеси.
Очевидно, что сумма массовых долей всех газов смеси равна единице:
 |
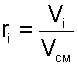 |
где Vi – объем данного газа при ТСМ и РСМ, м 3 .
Объем Vi называют парциальным объемом, это искусственно введенная величина, поскольку каждый газ, входящий в смесь, занимает весь объем смеси. Парциальный объем можно рассчитать по уравнению Менделеева – Клапейрона:
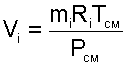 |
 |
можно получить еще одно расчетное выражение для объемной доли, поделив правые и левые части этих уравнений одно на другое:
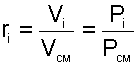 |
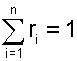 |
 |
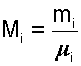 |
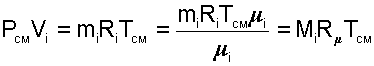 |
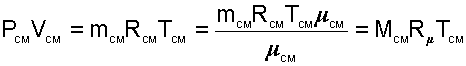 |
получим еще одно расчетное выражение для мольной доли:
 |
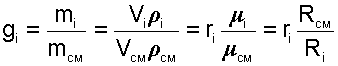 |
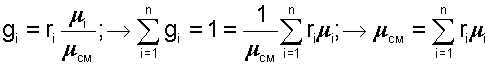 |
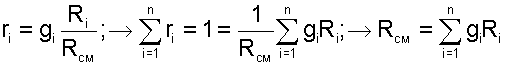 |
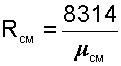 |
Для определения парциального давления данного газа в смеси можно воспользоваться выражением (4.71). В соответствии с ним
Источник
Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов и неуглеводородных компонентов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая доля, весовой состав(gi) i-го компонента – величина, нормированная на 1 в долях или на 100 %. Она характеризует отношение массы i-го компонента (mi) в системе к общей массе системы:

Молярная доля, мольный состав (Ni) i-го компонента – величина, нормированная на 1 в долях или на 100 %, характеризует отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
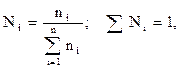

где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений (2.13–2.14) легко вывести выражения для пересчётов массового и мольного составов:

Объёмная доля i-го компонента – величина, нормированная на 1 или на 100 %, характеризует долю (Vi), которую занимает компонент в объёме системы. С учётом выражений (2.13–2.15) можно показать взаимосвязь объёмной доли с массовой и мольной долями:

Для идеального газа соблюдается соотношение – объёмная доля компонента (Vi) равна мольной доли компонента (Ni) → Vi = Ni. Этот постулат есть следствие закона Авогадро.
Нефтяной газ рассматривается как идеальная система и его состав можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и других величин.
Рассмотрим пример.
Дан объёмный состав нефтяного газа (Vi, %): CH4 – 61,3 %;
Найти: какой будет массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6).
Учитывая молекулярные массы (г/моль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, находим: gCH4 = 61,3·16/(61,3·16 + 15,4·30 + 12,1·44 + 6,8·58 + 4,4·72) =
Сумма всех долей массового состава равна 1.
Уравнение состояния
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используются давление, температура, объём.Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева–Клапейрона:

где Р – абсолютное давление, Па;
Q – количество вещества, моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м 3 /(моль×град).
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, число молекул, парциальные давления и другие, если рассматривать количество вещества в уравнении состояния газа (2.17), равное 1 молю (Q = 1 моль).
С учётом этого, уравнение состояния газа можно преобразовать следующим образом:
Если сумма молей равна единице (∑N = 1 моль), следует, что уравнение приобретает вид Þ Р·V = R·T.
Зная, что масса (m) одного моля идеального газа равна его молекулярной массе (М), умножив левую и правую части на молекулярную массу и массу газа, соответственно, получим:
Поделив обе части на V·R·T и преобразовав (2.19), получим выражение для расчёта плотности:
Р·M/R·T = m/V, m/V = M·Р/R·T, r = M·Р/R·T. (2.20)
Рассмотрим пример.
Дан один моль метана CH4.
Найти: какова будет плотность метана при н.у. и с.у.?
Решение. Зная, что молекулярная масса метана равна 16,04 г/моль и один моль метана занимает объём при н.у. 22,414 л, а при с.у. 24,055 л, находим:
Из выражения (2.20) и расчётов следует, что плотность газа с возрастанием давления будет расти, а с возрастанием температуры уменьшаться.
Плотность смеси газовых компонентов рассчитывают с учётом средней молекулярной массы смеси газа (Mсм) как отношение молекулярной массы смеси газа к его мольному объёму (Vм).
Например, для нормальных условий плотность газа будет рассчитываться по выражению:
Если плотность газа (ρо) задана при атмосферном давлении, равном 0,1013 МПа, то пересчёт её величины с учётом другого давления (Р) при той же температуре для идеального газа выполняется по формуле:
Рассмотрим другой пример.
Плотность метана при н.у. равна 0,716кг/м 3 . Определить плотность метана (СН4) при избыточном давлении, например при давлении 500 кПа и температуре 0 °С.
Решение. В этом случае общее давление (1 атм = 101,325 кПа) в системе будет равно Р = (500 + 101,325) = 601,325 кПа.
Зная, что молекулярная масса метана = 16,04 г/моль (кг/кмоль), универсальная газовая постоянная (R) = 8,314 Дж/(К·моль), температура (T) = 273,15 К, находим плотность метана по (2.20 и 2.22):
rCH4 = Р·М/R·T = 601,325·16,04/8,314·273,15 = 4,25 (кг/м 3 ),
Относительная плотность газов величина, рассчитанная по отношению к плотности воздуха, определенного при тех же условиях:
Плотность воздуха (ρвозд) при н.у. равна » 1,293 кг/м 3 , а при с.у. » 1,189 кг/м 3 .
Рассмотрим пример.
Для условий задачи, рассмотренной выше (пример раздела 2.2), рассчитать абсолютные (r) и относительные (ρ о см) плотности смеси газов, используя правое выражение (2.12) для расчета молекулярной массы (г/моль):
Мсм = 100/(36,5/16 +17,2/30 +19,8/44 +14,7/58 +11,8/72) = 26,874;
rсм = 26,874/22,414 = 1,119 (кг/м 3 );
ρ о см (н.у.) = 1,119/1,293 = 0,927.
Аналогично из (2.20) находится и выражение для мольного объёма:
Мольный объём при давлениях, равных или близких атмосферному и, для физических процессов, когда не происходит изменения числа молей в системе, оценивается соотношением:
где R – универсальна газовая постоянная;
Т – температура, К.
Рассмотрим пример.
Найти вид зависимости изменения мольного объёма газа от температуры → V = f(T).
Решение. Воспользуемся выражением (2.25) и получим объём, занимаемый одним молем идеального газа для условий задачи:
Vн.у. = 0,08206·273,15 = 22,414 (м 3 ,);
Vс.у. = 0,08206·293,15 = 24,055 (м 3 ).
Любой газ при н.у. (Т = 0 о С и Р = 100 кПа, 760 мм рт. ст.) занимает объём, равный 22,414 м 3 , а при с.у. (Т = 20 о С и Р = 100 кПа) занимает объём равен 24,055 м 3 .
С увеличением температуры мольный объём газа увеличивается. Мольный объём газов с возрастанием температуры будет расти, а с возрастанием давления уменьшаться(2.24).
У этого уравнения есть свои граничные условия. Оно справедливо для описания поведения газов при давлениях, близких к атмосферному (от 0,1 до 1,0–1,2 МПа), и при температурах ≈ 0–20 о С. При повышенном давлении газ сжимается и его состояние отличается от поведения идеальных газов.
Источник




