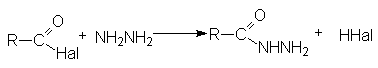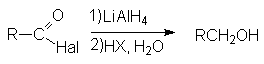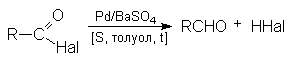Способы получения. Галогенокарбоновыми кислотами называют производные карбоновых кислот, которые в углеводородном радикале содержат один или несколько атомов галогена.
ГАЛОГЕНОКАРБОНОВЫЕ КИСЛОТЫ
Галогенокарбоновыми кислотами называют производные карбоновых кислот, которые в углеводородном радикале содержат один или несколько атомов галогена.
По природе углеводородного радикала различают алифатические, алициклические и ароматические галогенокарбоновые кислоты.
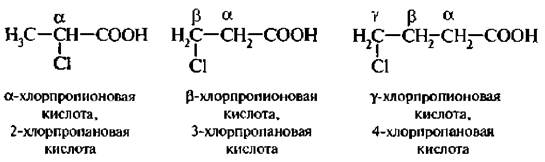
Алифатические галогенокарбоновые кислоты по взаимному расположению атома галогена и карбоксильной группы делятся на: α, β, γ, δ и т. д.
Способы получения
1. Действие галогенов на органические кислоты.
В этом случае, как правило, получают сс-галогеносодержащие карбоновые кислоты.
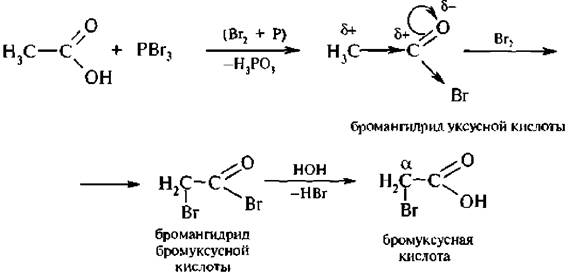
2. Реакция Геля – Фольгарда – Зелинского. Этот способ имеет бол ь-шое значение. Он заключается в действии галогена на предельные карбоновые кислоты в присутствии фосфора.
Реакция Геля – Фольгарда – Зелинского осуществляется значительно легче, чем в предыдущем случае. На первой стадии образуется бромангидрид уксусной кислоты. Бром в значительной степени усиливает смещение электронной плотности от α-утлеродного атома. Водороды при α-углеродном атоме становятся более подвижны и легко замешаются на галоген. Образовавшийся бромангидрид бромуксусной кислоты при взаимодействии с водой образует бромуксусную кислоту.
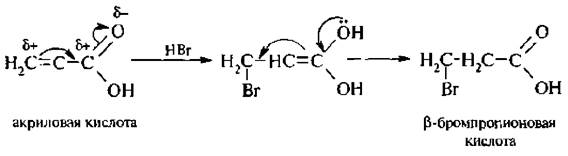
3. Действие галогеноводородов на непредельные карбоновые кислоты.
Реакция присоединения протекает против правила Марковникова.
Источник
Галогенкарбоновые кислоты.
Атомы водорода в радикале кислот способны замещаться на галоген с образованием галогенкарбоновых кислот. Примерами галогенкарбоновых кислот могут служить моно-, ди- и трихлоруксусная кислоты: СН2СlСООН, СНСl2СООН и ССl3СООН. Они являются продуктами хлорирования кислоты.
Различают кислоты с атомами галогена в a-, b-, g, d- и других положениях цепи, например:
Рассмотрим галогенирование уксусной кислоты.
При пропускании хлора в кипящую уксусную кислоту в присутствии красного фосфора образуется хлоруксусная кислота — кристаллическое вещество с tплавл=61°С:
Если продолжать пропускание хлора и повышать температуру, происходит дальнейшее замещение, приводящее к образованию дихлоруксусной и трихлоруксусной кислот:
Гомологи уксусной кислоты галогенизируются только в a-положение. Катализатором могут служить также галогениды фосфора (III):
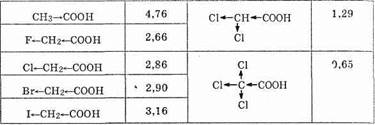
Галогенкарбоновые кислоты — более сильные, чем кислоты, не содержащие галогена.
Это видно из приведенных ниже значений рKа:
Вспомним, что силу кислоты НХ в воде, т.е. степень ее диссоциации, можно определить, рассматривая равновесие:
Константа такого равновесия выражается уравнением:
где концентрация воды является величиной постоянной, поскольку вода присутствует в избытке. Следует иметь в виду, что Кл — константа кислотности данной кислоты в воде — только приблизительно выражается таким уравнением, поскольку в нем вместо активностей используются концентрации. На величину константы кислотности влияют состав раствора, в котором находится кислота (см. ниже), а также другие факторы, но тем не менее эта величина достаточно полно характеризует силу кислоты.
Для того чтобы избежать написания отрицательных степеней, вместо величины Ка обычно пользуются величиной pKа:
Так, например, если для уксусной кислоты в воде величина Кa составляет 1,79•10 -5 , то значение рКa равно 4,76. Чем меньше рКа, тем сильнее соответствующая кислота.
Сила фторуксусной кислоты почти в сто раз выше, чем самой уксусной кислоты. Дальнейшее введение в молекулу кислоты атомов галогена еще более усиливает кислотность: трихлоруксусная кислота представляет собой уже очень сильную кислоту (см. выше).
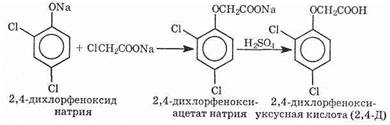
Галогенкарбоновые кислоты нашли широкое применение в органическом синтезе. Например, хлоруксусная кислота — исходное вещество в синтезе пестицида — 2,4-дихлорфеноксиуксус-ной кислоты (техническое название — 2,4-Д):
Дата добавления: 2016-01-03 ; просмотров: 2636 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Химические свойства
Реакции нуклеофильного замещения
Ацилгалогениды легко реагируют с различными нуклеофильными реагентами, причем эти реакции не требуют катализа. Общая схема этих реакций может быть представлена уравнениями
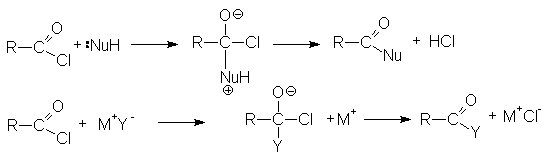
Галогенангидриды в силу своей высокой активности нашли чрезвычайно большое применение в органическом синтезе.
Важными реакциями нуклеофильного замещения по ацильному углероду являются:
Гидролиз
Взаимодействие со спиртами (этерификация)
Взаимодействие с аммиаком и аминами (аммонолиз)
- Взаимодействие с гидразином и его производными
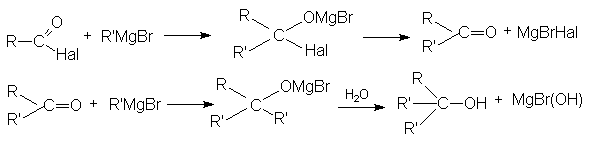
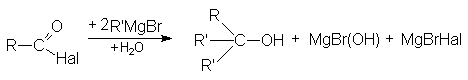
- Взаимодействие с металлоорганическими соединениями
По этому суммарно реакцию можно представить следующей схемой
- Восстановление натрийборгидридом или литийалюминий гидридом.
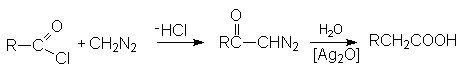
Реакция с диазометаном (реакция Арндта-Эйстерта)
Эта реакция является синтетическим средством увеличения длины углеводородных цепей органических соединений на один атом углерода.
Номенклатура, ізомерія, способи добування галогенозаміщених карбонових кислот. Кислотні властивості та їх залежність від кількості та розміщення галогену у вуглеводневому радикалі.
Галогенкарбоновыми кислотами называют производные карбоновых кислот, которые в углеводородном радикале содержат один или несколько атомов галогена.
По природе углеводородного радикала различают алифатические, алициклические и ароматические галогенкарбоновые кислоты.
Алифатические галогенокарбоновые кислоты по взаимному расположению атома галогена и карбоксильной группы делятся на: а, ?, Y, А и т. д. К гетерофункциональным карболовым кислотам относятся производные карбоновых кислот, в углеволоролном радикале которых один или несколько атомов водорода заметены на другие атомы или атомные группы: галоген, гидроксигруппу, альдегидную группу, кетонную группу, аминогруппу. Гетерофункциональные карбоновые кислоты — это бифункциональные соединения, они обладают свойствами карбоновых кислот и свойствами того класса органических соединений, который определяет заместитель в углеводородном радикале.
Название галогенкарбоновые кислоты производят от назв. карбоновых кислот с указанием числа атомов галогена и их положения относительно карбоксильной группы, например С1СН2СООН-хлоруксусная к-та, СН2С1СНС1СООН — 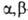
Способы получения галогенокарбоновых кислот.
1. Действие галогенов на органические кислоты.
2. Реакция Геля — Фольгарда — Зелинского. Это г способ имеет большое значение. Он заключается в действии галогена на предельные карбоновые кислоты в присутствии фосфора. Реакция Геля — Фольгарда — Зелинского осуществляется значительно легче, чем в предыдущем случае. На первой стадии образуется бромангирид уксусной кислоты. Бром в значительной степени усиливает смещение электронной плотности oт а-углеродного атома. Водороды при углеродном атоме становятся более подвижны и легко замешаются на галоген. Образовавшийся бромангидрид бромуксусной кислоты при взаимодействии с водой образует бром уксусную кислоту.
Галогенокарбоновые кислоты более сильные кислоты, чем карбоновые. Введение галогенов в молекулу увеличивает силу кислот. Сила кислот зависит от величины дробного положительного заряда на атоме углерода карбоксильной группы. А величина 6+ увеличивается с введением галогенов, которые обладают отрицательным индуктивным эффектом.
Например, трихлоруксусная кислота по силе приравнивается к серной кислоте. Значит, сила кислоты зависит от количества атомов галогена в углеродном радикале. Кроме того, сила кислоты зависит от положения галогена в цепи. Поскольку индуктивное смешение эффективно на протяжении четырех — пяти G-связей,галогенокарбоновые кислоты более сильные, чем ?-, a?— сильнее, чем у-галогенокарбоновые кислоты.
Для галогенокарбоновых кислот характерны реакции по карбоксильной группе и реакции с участием атома галогена.
По карбоксильной группе они образуют все функциональные производные карбоновых кислот: соли, сложные эфиры, ангидриды, галогенангидриды, амиды и др. Алифатические галогенокарбоновые кислоты, подобно галогеналканам, вступают в реакции замещения галогена по механизму нуклеофильного замещения. Причем, подвижность галогена зависит от взаимного расположения галогена и карбоксильной группы. Карбоксильная группа, как электроакцепторная группа, увеличивает подвижность атома галогена в молекуле. Галоген в положении менее подвижен, а положении влияние карбоксильной группы практически не сказывается.
Галогенокарбоновые кислоты находят широкое применение для получения окси- и аминокислот, широко используются в органическом синтезе лекарственных препаратов, бромизовалериановой кислоты — бромизовал — это снотворный препарат.
Источник
Галогенкарбоновые кислоты способы получения
3.2. Гидроксикислоты (спиртокислоты, фенолокислоты)
Гидроксикислоты – это производные карбоновых кислот в молекуле которых помимо карбоксильной группы содержится одна или несколько гидроксильных групп. Для них вводятся понятия основность и атомность. Основность определяется числом карбоксильных групп в молекуле, а атомность – общим числом гидроксильных групп, включая гидроксильную группу карбоксила.
Для названия гидроксикислот наряду с заместительной номенклатурой широко применяются тривиальные названия. По заместительной номенклатуре ИЮПАК за родоначальную структуру принимается кислота, а положение гидроксильной группы в молекуле обозначают буквами греческого алфавита или цифрами.
По положению гидроксильной группы относительно карбоксильной гидрокислоты делятся на α , β , γ и т. д.
3.2.1. Способы получения
1. Окисление гликолей. Для проведения этой реакции берется такое количество окислителя, чтобы не затронуть вторую гидроксильную группу.
2. Гидролиз галогенкарбоновых кислот.
Эти способы дают возможность получать α , β , γ , δ -оксикислоты.
3. Омыление циангидринов альдегидов и кетонов.
Обычно этим способом получают α -оксикислоты.
4. Восстановление оксокислот
3.2.2. Физические свойства
Это вязкие бесцветные жидкости или кристаллические вещества, хорошо растворимые в воде.
3.2.3. Химические свойства
Гидроксикислоты обладают более сильными кислотными свойствами, по сравнению с незамещенными карбоновыми кислотами.
Сила кислоты зависит от положения гидроксильной группы в молекуле и уменьшается в следующем порядке: α > β > γ > δ , то есть α -гидроксикарбоновые кислоты более сильные, чем β -, а β – сильнее, чем γ и т. д.
Со стороны гидроксильной группы проявляется -/-эффект. За счет этого увеличивается δ + заряд на углероде карбоксильной группы. По мере удаления гидроксильной группы от карбоксильной снижается ее влияние и сила кислоты уменьшается.
Оксикислоты образуют все производные по карбоксильной группе и вступают в реакции с участием спиртового гидроксила.
Кто хорошо знает свойства спиртов и кислот, тот легко усвоит свойства оксикислот. К примеру, по СООН-группе гидроксикислоты образуют хлорангидриды, сложные эфиры, соли, ангидриды и др.:
В реакцию со спиртами, прежде всего, вступает карбоксильная группа и образуется сложный эфир, затем может вступить и ОН-группа с образованием диэфира.
С участием гидроксильнои группы гилроксикислоты алифатического ряда вступают в реакции, характерные для спиртов:
В результате взаимного влияния гидроксильнои и карбоксильной групп появляются и новые свойства у оксикислот.
3.2.3.1. Специфические свойства оксикислот
1. Отношение оксикислот к нагреванию. Оксикислоты в зависимости от положения ОН-группы по разному себя ведут при нагревании. Это позволяет отличить α, β, γ и другие оксикислоты друг от друга.
а) α- гидроксикислоты:
В случае α- оксикислот происходит взаимодействие между двумя молекулами кислоты, при этом выделяются две молекулы воды, и образуется циклический сложный эфир, который называется лактидом.
б) β- гидроксикислоты:
На α- углеродном атоме электронная плотность уменьшается, вследствие чего водород становится подвижен – отщепляется молекула воды и образуется непредельная кислота. Таким образом β- окси-кислоты образуют α, β- непредельные кислоты.
в) γ- гидроксикислоты:
При нагревании γ- гидроксикислоты претерпевают внутримолекулярную циклизацию с образованием циклических сложных эфиров, которые называются лактонами.
2. Расщепление α- гидроксикислот . Для α- оксикислот характерна еще одна специфическая реакция. При действии концентрированной серной кислоты α- оксикислоты разлагаются с разрывом С–С связи:
В этих условиях, как правило, образуется муравьиная кислота и соответствующий альдегид или кетон. Образовавшаяся муравьиная кислота при действии концентрированной серной кислоты и нагревании разлагается с вьшелением оксида углерода (II) и воды. Это реакция используется для определения α- гидроксикислот.
Источник


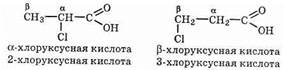
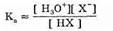
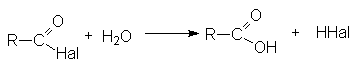 Гидролиз
Гидролиз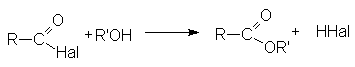 Взаимодействие со спиртами (этерификация)
Взаимодействие со спиртами (этерификация)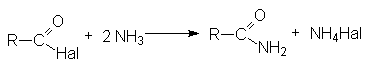 Взаимодействие с аммиаком и аминами (аммонолиз)
Взаимодействие с аммиаком и аминами (аммонолиз)