- Фтор электролитический способ получения
- Получение фтора на производстве
- Получение фтора
- Содержание
- История
- Происхождение названия
- Распространение в природе
- Физические свойства
- Электронное строение
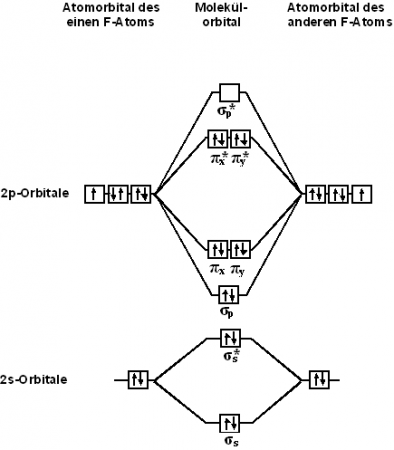
- Строение молекулы
- Кристаллы
- Изотопный состав
- Ядерные свойства изотопов фтора
- Магнитные свойства ядер
- Химические свойства
- Получение
- Лабораторный метод
- Промышленный метод
- Хранение
- Применение
- Ракетная техника
- Применение в медицине
- Биологическая и физиологическая роль
- Токсикология
Фтор электролитический способ получения
Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗОМ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Литий, фтор и магний не могут быть получены электролизом растворов. При электролизе растворов вместо лития и магния на катоде будет выделяться водород, а вместо фтора на аноде — кислород.
Поэтому для получения этих веществ нужно подвергать электролизу расплавы.
Серебро может быть получено из растворов солей серебра.
Источник
Получение фтора на производстве
Получение фтора

В лабораторных условиях фтор получают также как и на производстве электролизом, но связи высокой токсичностью фтора получают крайне редко при использовании специального оборудования.
Фтор — один из самых химически активных элементов. Поэтому долгое время после его открытия не удавалось получить элементарный фтор в заметных количествах. При нормальных условиях фтор представляет собой двухатомный газ, обладающий большим сродством ко многим веществам и являющийся сильнейшим окислителем.
Впервые элементарный фтор был получен в 1886 г. Муассаном электролизом жидкого фтористого водорода, по-видимому, содержащего примеси влаги и KF. Высокая токсичность фтора долгое время заставляла относиться к использованию его с большой осторожностью, тем более, что и источник фтора — фтористый водород — представляет собой существенную опасность в обращении с ним.
В больших количествах фтор стали получать только в последнее время, когда появились крупные потребители фтора для получения различных фторопроизводных.
Стандартный потенциал разряда иона фтора при 25° С равен 2,85 в. Поэтому получение фтора возможно лишь в отсутствие в электролите всех других анионов.
Элементарный фтор в настоящее время получают электролизом безводной HF из расплавленного электролита, содержащего в качестве электропроводящей добавки KF.
На рис. 2 представлена диаграмма состояния системы фторид калия — фтористый водород. На этом рисунке пунктирные кривые указывают на давление паров HF при соответствующих составах электролита и температуре их плавления. Нижняя пунктирная кривая отвечает давлению паров HF, равному 50 мм рт. ст., средняя —100 мм рт. ст. и верхняя — 250 мм рт.ст. С целью наименьшего загрязнения анодного газа фтористым водородом и уменьшения потерь последнего наиболее рациональными составами электролитов являются KF»HF (около 25% HF) и KF•2HF (около 40% HF). В первом случае электролиз возможен при температуре около 250° С, а во втором — около 100° С. Процесс электролиза сводится к разложению HF и выделению на аноде фтора, а на катоде водорода.

Исследовалось влияние добавок фторидов натрия, лития, рубидия, цезия к бифториду калия на физико-химические свойства последнего. Оказалось, что добавки NaF, LiF, RbF, CsF мало влияют на температуру плавления, плотность и электропроводность электролита и на уменьшение давления паров HF над ним. А так как всякое усложнение состава электролита вызывает дополнительные усложнения в контроле его и поддержании состава при электролизе, то существенных технико-экономических преимуществ подобные добавки к электролиту не дают.
Безводный HF тока не проводит. С ростом содержания KF и с повышением температуры удельная электропроводность системы KF — HF возрастает, составляя для бифторида KF • HF при 250° С и для KF • 2HF при 100°С, величину около 0,18 ом -1 • см -1 . Плотность электролита при 100° С около 1 ,9 г/см 3 .
Рис. 2. Диаграмма плавкости системы KF—HF.
При разработке технологии получения фтора оказалось сложным подобрать химически стойкие материалы для электролизера и, особенно, для анодов; приготовлять чистый безводный фтористый водород, необходимый для подпитки электролита по мере разложения в нем HF при электролизе; выработать и соблюдать строго технологический режим электролиза.
В первый период развития промышленного получения фтора в качестве электролита применяли бифторид калия KF • HF, а электролиз вели при 250° С. В этом случае оказались пригод ными для корпуса электролизера, катодов и диафрагм красная медь и магниевые сплавы, а для катода красная медь и железо. Единственно устойчивыми анодами являются графитовые.
Железо оказывается достаточно химически стойким к сухим фтору и фтористому водороду при температурах ниже 150° С. Поэтому отвод анодного газа возможен по железным трубопроводам.
Для пуска электролизера и сохранения электролита в расплавленном состоянии необходим внешний подогрев и поддержание постоянного состава электролита около 25% HF периодической или непрерывной подачей его в электролит.
При плотности тока на электродах около 0,08 а /см 2 и напряжении 10—12 в выход по току достигает 80%.
В последнее время стали применять более кислый и легкоплавкий электролит, состоящий из 40 вес. % HF и 6 0 вес. % KF. В этом случае электролиз возможен при температуре около 100° С.
В отношении давления паров HF и электропроводности электролита оба состава практически равноценны. При работе на втором составе отпадает внешний обогрев электролизеров. Для изготовления корпуса ванны, диафрагм и катодов можно применить железо . В этих условиях трудно подобрать материал для анодов, так как графит в данном случае не стоек, никель — растворим. Достаточно стойким оказался специальный сорт неграфи тированных угольных электродов.
Технологические показатели процесса получения фтора электролизом сплава типа KF • 2HF при 100° С являются близкими к таковым для электролиза бифторида KF • HF при 250° С. Следует лишь отметить, что диапазон возможного колебания содержания HF в более кислом электролите возрастает почти в 2 раза, как это видно из диаграммы состояния системы KF • HF. Это облегчает соблюдение требуемого технологического режима электролиза в отношении температуры.
При электролизе, в том и другом электролите, возникает иногда анодный эффект, для борьбы с которым рекомендуется иметь невысокую анодную плотность тока и добавлять в электролит фторид лития в количестве около 2% от веса электролита. В электролите недопустимы заметные количества примесей влаги, сульфатов, хлоридов и силикатов. В их присутствии выход по току резко снижается.

Ванна гер метично закрыта сверху стальной крышкой, изолированной от корпуса и имеющей в центре прямоугольные отверстия, которые закрыты второй крышкой с приваренной к ней диафрагмой-колоко лом. Колокол погружен на 100—150 мм в электролит и является гидравлическим затвором от попадания фтора в катодное пространство. Фтор выводится через отверстие 3 в крышке над колоколом и поступает по стальным трубопроводам в общий коллектор.
Рис. 3. Электролизер для получения фтора:
1— ввод HF; 2— предохранительный клапан; 3— вывод флора; 4 — вывод водорода; 5 —изолятор анода; 6 — изоляционная прокладка; 7 — диафрагма колокол; 8 — уровень электролита; 9 — пароводяная рубашка; 10 — катоды; 11— аноды.
Катоды — плоские стальные листы, перфорированные или из вертикальных полос для улучшения циркуляции электролита, подвешиваются с двух сторон каждого анодного блока с внешней стороны колокола. Токоподвод к ним обеспечивается сваркой их с внешней крышкой электролизера. В катодной крышке имеется отверстие для ввода трубки-барботера У, через которую подается HF для подпитки электролита, предохранительный клапан 2 и отверстие для вывода водорода 3 в общий коллектор катодного газа. Корпус имеет пароводяную рубашку 9 для нагревания при пуске и охлаждения при работе электролизера.
При анодной плотности тока около 0,1 а/см 2 и катодной — около 0,15 а/см 2 электролизер имеет напряжение 9—11 в и выход по току около 90%. На 1 г фтора расходуется 50 кг KF • HF, 1200 кг безводного HF и около 22 000 квт • ч электроэнергии. Имеются указания в литературе [25] на конструкцию электроли зера для получения фтора с полым угольным анодом. Фтор, выделяющийся на аноде, проникает через поры в угле во внутреннюю полость анода и удаляется по медной трубке, выполняющей одновременно роль анодного токоподвода.
При сборке и работе электролизера рекомендуется обращать внимание на хороший электрический контакт между анодом и медным проводником, с которым он соединен. Расположение катодов должно быть такое, чтобы поверхность анодов была предельно использована. Расстояние между электродами должно обеспечить надежное разделение фтора и водорода. Оно достигает 3 см или меньше. Для удобства ремонта электролизера или замены какой-либо части его должна быть обеспечена возможность легкого извлечения анодного комплекта без повреждения остальных частей ванны.
Электролизер помещается в изолированную кабину и снабжается приборами для: а) измерения температуры; б) определения уровня расплава; в) подачи автоматического сигнала в случае анодного эффекта или короткого замыкания; г) измерения тока и напряжения на ванне; д) указания разности давлений фтора и водорода. Все приборы вынесены в специальный коридор управления. Аппаратчику необходимо иметь принадлежности для устранения возникающих неполадок, защитные очки и одежду.
В США во время войны были построены ванны на 2000 а, а в Германии до 3000 а. Имеются электролизеры, работающие на токе 8000—10 000 а.
Получаемый из электролизеров анодный газ содержит от 5 до 15% HF (в зависимости от температуры и кислотности), от 0 ,5 до 1% кислорода, около 1% инертных газов, а также следы моноокиси фтора. Кроме того, фтор и водород захватывают брызги электролита, который загрязняет трубопроводы. Очистку фтора от HF осуществляют в два приема. Сначала газ охлаждают до —70° С для конденсации HF, а затем оставшееся его количество поглощают твердым фторидом натрия, с которым HF образует кислую соль. При нагревании кислая соль разлагается и регенерированный HF вместе с конденсированным HF при — 70° С возвращается в электролизеры. Таким путем может быть получен газ с содержанием 98—98,5 F2 до 0,5 % О2 и около 1% примесей инертных газов.
Статья на тему Получение фтора
Источник
| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
(молярная масса)
(первый электрон)
ж.: 1,516 −188 г/см³,
тв.: 1,7 −228 г/см³ или 1,810 −225 г/см³
β -фтор: a = 5,5314(15)
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространение в природе
- 3 Физические свойства
- 3.1 Электронное строение
- 3.1.1 Строение молекулы
- 3.2 Кристаллы
- 3.3 Изотопный состав
- 3.3.1 Ядерные свойства изотопов фтора
- 3.3.2 Магнитные свойства ядер
- 3.1 Электронное строение
- 4 Химические свойства
- 5 Получение
- 5.1 Лабораторный метод
- 5.2 Промышленный метод
- 6 Хранение
- 7 Применение
- 7.1 Ракетная техника
- 7.2 Применение в медицине
- 8 Биологическая и физиологическая роль
- 9 Токсикология
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
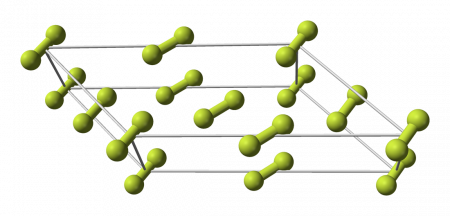
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α -фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм , b = 0,32701(7) нм , c = 0,72651(17) нм , β = 102,088(18)° , Z = 4 , d = 1,98 г/см 3 с объёмом элементарной ячейки 0,12726(5) нм 3 (при 10 К);
- β -фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K , кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm 3 n, параметры ячейки a = 0,65314(15) нм , Z = 8 , d = 1,81 г/см 3 с объёмом элементарной ячейки 0,27862(11) нм 3 (при 48 К ), решётка изотипична γ -фазе O2 и δ -фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β -фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см 3 , и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см 3 .
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в 17 O | 5/2 | 4,722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2,094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
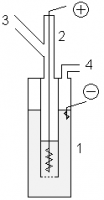
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Источник