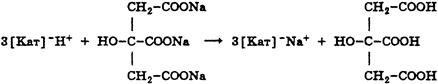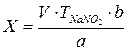- 3 Расчет количественного содержания лекарственных веществ в титриметрических методах анализа.
- 4. Расчет содержания лекарственного вещества в граммах (х) в 1 мл инъекционного раствора
- 5. Расчет содержания лекарственного вещества с учетом постановки контрольного опыта в прямом титровании
- 6. Расчет объема титранта при количественном определении лекарственных средств
- Расчеты при титровании
3 Расчет количественного содержания лекарственных веществ в титриметрических методах анализа.
Для расчета количественного содержания веществ используется несколько формул в зависимости от вида титрования (прямое, обратное и заместительное).
При прямом и заместительном титровании для определения концентрации вещества (С) в процентах пользуются формулой:
V – количество титрованного раствора, израсходованного на титрование определяемого веществ (мл);
Tc – титр соответствия (г/мл);
K – поправочный коэффициент титранта;
a – навеска вещества в г или объем в мл лекарственной формы
В случае проведения контрольного опыта при прямом титровании концентрацию вещества определяют по формуле:
Vк.o – объем контрольного опыта
При обратном титровании используют два титранта, один из которых берется в избытке. Расчет выполняют по формуле:
V1 – объем титранта, прибавленного в избытке;
V2 – объем второго титрованного раствора, израсходованного на титрование избытка первого;
К1 и К2 – поправочные коэффициенты первого и второго титранта соответственно.
В ряде случаев при выполнении обратного титрования проводят контрольный опыт. Концентрацию определяемого вещества при этом вычисляют по формуле:
Vк.o – объем контрольного опыта;
V – объем титранта, израсходованный на титрование анализируемого лекарственного вещества;
К– поправочный коэффициент второго титранта.
В случае разведения навески, взятой для анализа, концентрацию вещества в процентах можно вычислить, используя формулы:
Vм.к – объем разведенного раствора (объем мерной колбы);
Vn – объем взятый для анализа из разведенного раствора (объем пипетки).
В практике фармацевтического анализа очень часто встречается задача расчета предварительного объема (Vпр) титранта, который будет затрачен на титрование определенной навески препарата. Формулу для расчета Vпр получают из формул (8 -14) математически их преобразуя. Например, из формулы (8) получаем формулу:
Рассчитайте количественное содержание кальция хлорида, если 0,8241 г навески препарата помещают в мерную колбу на 100 мл и доводят водой до метки. На анализ взяли 25 мл полученного разведения, израсходовано на титрование 19,2 мл 0,05моль/л раствора трилона Б с К = 0,9931.
1 мл 0,05моль/л раствора трилона Б соответствует 0,01095 г кальция хлорида.
Из условий задачи следует, что это прямое комплексонометрическое титрование с разведением. Следовательно, для расчетов используем формулу (12):
С = 19,2*0,01095*0,9931*100*100 = 101,34%
Рассчитайте количественное содержание лекарственной формы: раствор фенола 2% -200 мл, если на титрование 1 мл навески (разведение 10:100) методом обратной броматометрии израсходовано 1,30 мл 0,1моль/л раствора тиосульфата натрия с К = 1,00. На проведение контрольного опыта израсходовано 2,60 мл титранта 0,1 моль/л раствора натрия тиосульфата.
1 мл 0,1 моль/л калия бромата соответствует 0,001568 г фенола.
Из условий задачи следует, что это обратное титрование с разведением и с контрольным опытом. Следовательно, для расчетов используем формулу (13):
С = (2,60-1,30)*1*0,001568*100*100 = 2,04%
Рассчитайте предварительный объем титранта 0,1 моль/л р-ра натрия тиосульфата при количественном определении (экспресс-анализ) лекарственной формы: р-р глюкозы 10% -150 мл методом обратной йодометрии, если навеска лекарственной формы равна 1 мл (разведение 1:10).Объем контрольного опыта равен 1,91 мл, поправочный коэффициент 1,0112.
1 мл 0,1 моль/л раствора йода соответствует 0,0090 г глюкозы.
Из условий задачи следует, что это обратное титрование с разведением и с контрольным опытом. Следовательно, формулу для расчета Vпр получают из формулы (13) математически ее преобразуя:
V = 1,95 __ ___10* 1*1_______ = 0,85 мл
Источник
4. Расчет содержания лекарственного вещества в граммах (х) в 1 мл инъекционного раствора
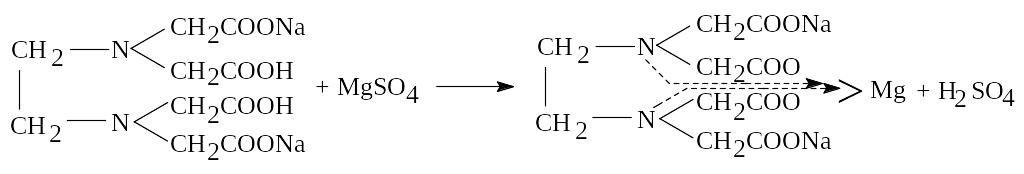
Пример 4.1. Сделайте заключение о качестве раствора магния сульфата 25% для инъекций, если на титрование 1 мл препарата израсходовалось 20,00 мл раствора трилона Б (0,05 моль/л) с К 1,000. Согласно ФС, в 1 мл препарата должно быть от 0,242 г до 0,258 г магния сульфата. М.м. магния сульфата 246,48.
Заключение: раствор магния сульфата 25% для инъекций соответствует требованиям ФС.
5. Расчет содержания лекарственного вещества с учетом постановки контрольного опыта в прямом титровании
V зад – объем титранта, пошедший на титрование в основном определении, мл;
V к.оп. – объем титранта в контрольном опыте, мл.
Пример 5.1. Сделайте заключение о качестве бендазола гидрохлорида (дибазола) по количественному содержанию с учетом требований ФС, если на навеску 0,1482 г предварительно высушенной субстанции израсходовалось 6,15 мл раствора кислоты хлорной (0,1 моль/л) с К 1,000. На контрольный опыт пошло 0,12 мл титранта. Бендазола гидрохлорида (дибазола) в высушенной субстанции должно быть не менее 99,0%. М.м. дибазола 244,73.
0,02447 (6,15 – 0,12) 100
Заключение: бендазола гидрохлорид (дибазол) по количественному содержанию соответствует требованиям ФС (99,0-100,5%).
6. Расчет объема титранта при количественном определении лекарственных средств
у — содержание лекарственного вещества в граммах во взятой для анализа
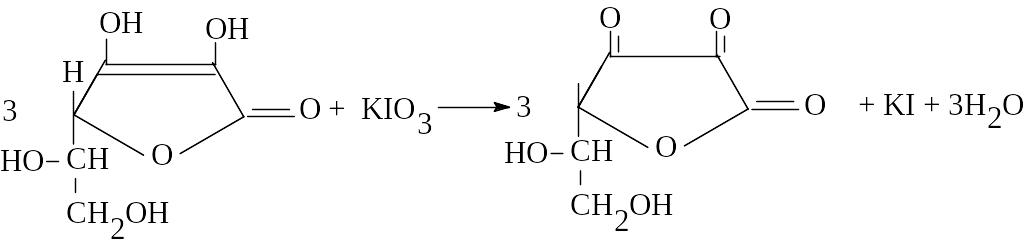
Пример 6.1. Рассчитайте, какой объем раствора калия йодата (0,1 моль/л) УЧ (1/6 KBrO3) свяжется с навеской кислоты аскорбиновой 0,1005 г. М.м. кислоты аскорбиновой 176,13.
в т. экв.: KIO3 + 5KI + 6HCl 3I2 + 6KCl + 3H2O
fэкв (кислоты аскорбиновой) = 1/2
Пример 6.2. Какой объем раствора калия перманганата (0,1 моль/л) УЧ (1/5 KMnO4) с К 1,000 израсходуется на титрование 1 мл 3% раствора пероксида водорода? М.м. пероксида водорода 34,01.
2) Находим содержание H2O2 в граммах в 1 мл 3% раствора:
3 г – в 100 мл 3 1
у – в 1 мл у = ———-= 0,03 г
Пример 6.3. Какой объем раствора натрия гидроксида (0,1 моль/л) израсходуется на титрование 0,10 г порошка состава:
Кислоты ацетилсалициловой 0,3 г
М.м. кислоты ацетилсалициловой 180,16.
fэкв (кислоты ацетилсалициловой) = 1
2) Находим содержание кислоты ацетилсалициловой в 0,10 г препарата:
0,3 г – в 0,4 г смеси 0,3 0,1
у – в 0,1 г смеси у = —————= 0,075 г
Источник
Расчеты при титровании



Концентрацию индивидуального лекарственного вещества рассчитывают в процентах. Концентрацию ингредиента в смеси или его содержание рассчитывают в тех единицах, в каких данный ингредиент выписан в прописи.
1. При прямом титровании концентрацию индивидуального лекарственного вещества или ингредиентов смеси в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают но формуле:
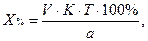
где 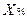
V – объем титрованного раствора, мл;
К – коэффициент поправки на титрованный раствор;
Т – титр по определяемому веществу (титриметрический фактор пересчета);
а – масса (г) или объем (мл) анализируемого лекарственного вещества или масса (объем) лекарственной смеси.
Содержание ингредиентов лекарственной смеси в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
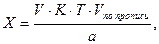
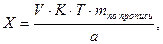
где X – масса определяемого лекарственного вещества, г;
V – объем титрованного раствора, мл;
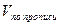
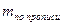
а – объем (мл) или масса (г) лекарственной формы, отобранные для анализа;
К – поправочный коэффициент.
Если при анализе порошка или жидкой лекарственной формы предварительно делали разведение и для титрования использовали часть полученного разведения (А), то концентрацию определяемого вещества в процентах рассчитывают по формуле;
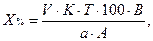
где В – объем мерной колбы, мл;
А – объем разведенного раствора, отобранный для титрования (аликвотная доля), мл. Остальные обозначения – см. формулу (3).
При необходимости выразить содержание анализируемого вещества в граммах в числитель вместо цифры 100 подставляют величину общей массы ( 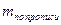
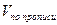
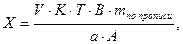
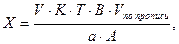
2. При обратном титровании (или титровании по избытку) концентрацию ингредиентов в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают по формуле;
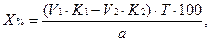
где 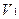
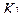
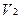
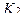
Содержание ингредиентов в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
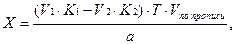
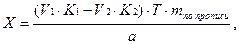
где 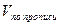
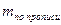
В экспресс-анализе иногда проводят контрольный (холостой) опыт при прямом и обратном способах титрования. Контрольный опыт в случае прямого титрования проводят при:
— алкалиметрическом титровании веществ в мазях (контрольный опыт проводится с мазевой основой, обладающей собственной кислотностью);
— алкалиметрическом титровании с использованием растворителей, обладающих кислотными свойствами (спирт, ацетон);
— комплексонометрическом титровании в малых количествах солей 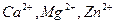
— нитритометрическом определении малых количеств лекарственных веществ 0,02 М раствором натрия нитрита с использованием внутренних индикаторов.
В приведенных примерах концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
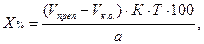
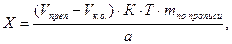
где 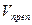
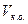

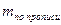
При прямом ацидиметрическом титровании некоторых лекарственных веществ контрольный опыт проводится с целью сравнения перехода окраски индикатора в точке эквивалентности в анализируемом и контрольном растворах. В этом случае количество титрованного раствора, израсходованное на титрование в контрольном опыте, при расчетах не учитывается.
В экспресс-анализе проводить контрольный опыт в случае обратного титрования необходимо при:
— йодометрическом определении некоторых лекарственных веществ;
— броматометрическом определении препаратов группы фенолов;
— при йодхлорметрическом определении метилурацила, этакридина лактата;
— перманганатометрическом определении натрия нитрита.
Концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
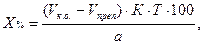
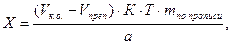
где 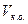
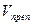
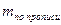
Кроме того, контрольный опыт ставят, если необходимо отфильтровать осадок и титровать избыток раствора в аликвотной части фильтрата. В этом случае расчет ведут по формулам:
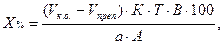
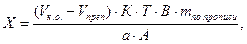
где В – объем мерной колбы, мл;
А – объем фильтрата, взятого на титрование, мл. Остальные обозначения – см. формулы (12) и (13).
3. При косвенном (заместительном) титровании расчет ведут, как при прямом титровании, но титриметрический фактор пересчета определяют не по титруемому заместителю, а по определяемому веществу. Например, при пропускании через катионитную колонку натрия цитрата образуется эквивалентное количество лимонной кислоты, которую титруют стандартным раствором натрия гидроксида. При расчете титр определяют по натрия цитрату, а не по лимонной кислоте.
f = 1/3, Mf (цитрата) = 86 г/моль.
В расчетную формулу титра по определяемому веществу подставляют молярную массу эквивалента натрия цитрата и концентрацию натрия гидроксида.
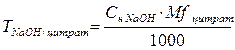
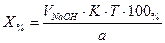
4. При определении по разности лекарственные вещества титруют суммарно общим для них методом, а затем один из компонентов анализируют другим методом, при котором второй компонент не мешает определению. Вычисление по разности включает несколько вариантов в зависимости от типа протекающих реакций.
Если при титровании разными методами М (1/z) анализируемых веществ не меняются, то объем титрованного раствора (V1), пошедший на титрование вещества, определяемого по разности, рассчитывают по алгебраической разности между объемом, затраченным на титрование суммы веществ (Vc), и объемам другого титрованного раствора (V2), израсходованного на титрование второго вещества:
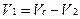
Такой расчет справедлив, если при титровании использовали одинаковые массы (объемы) лекарственной смеси и одинаковые концентрации титрованных растворов.
Соответственно содержание ингредиентов рассчитывают по формуле:
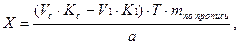
где 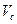
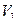
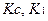
Т – титр по определяемому веществу;
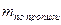
a — точная навеска (г) или объем (мл) лекарственной формы, взятых для анализа.
Например, в лекарственной смеси состава:
Кальция хлорида 0,5
Калия йодида 2,0
Калия бромида 3,0
Воды очищенной до 100,0
Кальция хлорид и калия йодид можно определить каждый раздельно. Для определения калия бромида титруют сумму галогенидов и содержание калия бромида рассчитывают по разности, пользуясь формулой:
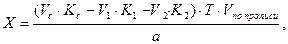
где 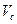
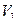
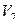
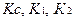
Т – титр по определяемому веществу;
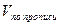
a — точный объем лекарственной формы, взятой для анализа, мл.
Если на определение одного ингредиента и на суммарное определение компонентов смеси взяты разные массы, то для расчета содержания второго ингредиента их необходимо привести к одной массе. Например, анализируется микстура состава:
Кальция хлорида 3,0
Калия бромида 2,0
Воды очищенной до 100,0
На суммарное титрование галогенидов взят объем а1, определение же кальция хлорида проводили в объеме а. Количество калия бромида (Х) вычисляют по формуле:
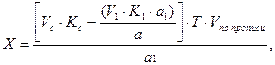
Для суммарного раздельного определения ингредиентов лекарственной смеси часто используют разные методы, при которых молярная масса эквивалентов препаратов различны. Например, анализируется микстура состава:
Натрия гидрокарбоната 2,0
Воды очищенной до 100,0
Гексаметилентетрамин определяют методом йодхлорометрии: Мf = M ∙ 1/4.
Сумму гексаметилентетрамина и натрия гидрокарбоната титруют 0,1 моль/л раствором хлористоводородной кислоты. При титровании кислотой молярная масса эквивалента гексаметилентетрамина равна молекулярной массе. В таких случаях при расчете содержания препарата, определяемого суммарно, необходимо приведение к одному эквиваленту. Так, расчет количества натрия гидрокарбоната в данной смеси проводят по формуле:
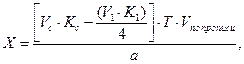
где 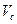
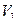
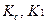
Т – титр по определяемому веществу;
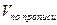
a — точный объем лекарственной формы, взятой для анализа, мл.
Если раздельное и суммарное титрование ингредиентов проводится в разных массах и одновременно при различии молярных масс эквивалентов, то при расчете компонента, определявшегося суммарно, необходимо приведение к одному эквиваленту и к одной массе. В приведенной выше прописи гексаметилентетрамин определяют методом йодхлорометрии в 1 мл микстуры, а суммарное титрование компонентов смеси проводят в 5 мл.
В этом случае содержание натрия гидрокарбоната (Х) рассчитывают по формуле:
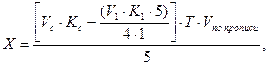
где 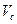
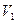
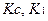
Т – титр по определяемому веществу;
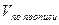
a — точный объем (5 мл) лекарственной формы, взятой для анализа.
5. Реверсионное титрование.
Данный метод предусматривает титрование стандартного раствора (титрованного раствора) анализируемым раствором. Расчет производят общепринятым способом: в знаменатель ставят количество жидкой лекарственной формы, пошедшее на титрование, а в числитель — объем титрованного раствора.
Например, при экспресс-анализе нежелательно определять натрия нитрит фармакопейным методом. Прямое же титрование в кислой среде дает заниженные результаты, так как из натрия нитрита образуется легко разрушающаяся азотистая кислота. В данном случае лучше взять точный объем титрованного раствора калия перманганата (V), прибавить к нему серную кислоту и по каплям титровать анализируемой микстурой (а) до обесцвечивания раствора.
Вопросы для самоконтроля:
1. Какие растворы называются титрованными? Укажите их назначение.
2. Каковы способы выражения концентрации титрованных растворов?
3. Каковы наиболее употребительные концентрации титрованных растворов?
4. Приведите определение молярности, титра, титра по определяемому веществу.
5. Как рассчитывается титр по определяемому веществу? Где используется эта величина? Поясните смысл определения титра по определяемому веществу на конкретных примерах из ФС: натрия хлорида и др. Выведите расчетную формулу для определения массовой доли вещества в граммах, процентах.
6. Что такое контрольный опыт и почему при установке титра проводят контрольный опыт?
7. Назовите два способа определения концентрации титрованного раствора.
8. Выведите расчетную формулу для определения концентрации титрованного раствора по первому способу – по точной массе (навеске) химически чистого вещества, используя данные 5 вопроса.
9. Выведите расчетную формулу для определения концентрации титрованного раствора по второму способу – по титрованному раствору известной концентрации. Какой закон лежит в основе этой формулы?
10. Как вычисляют поправочный коэффициент к молярности (К) для приготовленных титрованных растворов? Каково его назначение?
11. Как поступают в случае отклонения поправочного коэффициента более чем 0,98 – 1,02?
12. Как поступают в случае укрепления титрованного раствора?
13. Как поступают в случае разбавления титрованного раствора?
14. Что такое фактор эквивалентности и молярная масса эквивалента вещества? Как рассчитываются эти величины в реакциях различного типа?
15. Каковы условия хранения титрованных растворов? Напишите уравнения реакции, объясняющие помутнение титрованного раствора натрия тиосульфата при хранении.
16. По какой формуле рассчитывают концентрацию вещества в процентах при прямом способе титрования?
17. По какой формуле рассчитывают концентрацию вещества в процентах при обратном способе титрования?
18. Что такое заместительное титрование, приведите примеры.
Источник