Формальдегидный способ определения солей аммония
Методы кислотно-основного титрования применяют в контроле производства в химической, текстильной, пищевой промышленности, в технологии пластмасс и волокон, удобрений, в металлургии и т.д.
Методами кислотно-основного титрования определяют концентрацию сильных и слабых кислот, сильных и слабых оснований, в том числе кислых и основных солей. Возможно также определение веществ, не обладающих кислотно-основными свойствами, но вступающих в реакцию с кислотами или основаниями. Содержание этих веществ обычно определяется методами прямого титрования, хотя в некоторых случаях используются методики обратного титрования и титрования по замещению.
Определение жесткости воды . Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния ( f э =1/2) и выражают в ммоль/л. Различают карбонатную , или устранимую, жесткость и постоянную . Карбонатная жесткость определяется содержанием в воде гидрокарбонатов. При кипячении они разлагаются
И жесткость воды устраняется или уменьшается. При кипячении вместе с карбонатами происходит соосаждение и некоторых других солей, поэтому устранимая жесткость несколько превышает карбонатную.
Постоянная жесткость вызывается наличием в воде других солей, кроме гидрокарбонатов, и при кипячении не уменьшается. Сумма карбонатной и постоянной жесткости воды составляет общую жесткость. Карбонатную жесткость определяют титрованием воды соляной кислотой в присутствии метилового оранжевого
Если на объем воды V ( H 2 O ) мл затрачено V ( HCl ) мл соляной кислоты нормальной концентрации C ( HCl ), то карбонатная жесткость воды равна C ( HCl ) × V ( HCl ) × 1000 / V ( H 2 O ).
Постоянную жесткость определяют методом обратного титрования. К отмеренному объему воды добавляют титрованный раствор Na 2 CO 3 и выпаривают досуха. Карбонаты кальция и магния при этом выпадают в осадок. Сухой остаток растворяют в воде, не содержащей CO 2 , и в полученном растворе определяют количество Na 2 CO 3 , не вошедшего в реакцию осаждения карбонатов. Если к объему воды V ( H 2 O ) мл добавили V ( Na 2 CO 3 ) мл Na 2 CO 3 нормальной концентрации C ( 1 /2 Na 2 CO 3 ) и на титрование избытка Na 2 CO 3 израсходовали V ( HCl ) мл соляной кислоты нормальной концентрации C ( HCl ), то постоянная жесткость воды равна

Этим методом определяют именно постоянную жесткость воды, а не общую, так как на осаждение карбонатов кальция и магния, присутствующих в воде в виде гидрокарбонатов, Na 2 CO 3 не расходуется. Для определения жесткости воды в последнее время успешно применяют также комплексонометрические методы.
Определение солей аммония и азота в органических соединениях по Кьельдалю . Ион аммония NH 4 + – очень слабая кислота, поэтому прямое титрование его в растворе с кислотно-основным индикатором невозможно. Определяют соли аммония обычно методом обратного титрования и титрования по замещению.
В одном из методов обратного титрования к анализируемому раствору добавляют избыток точно отмеренного стандартного раствора NaOH и нагревают до полного удаления NH 3 из раствора, после чего оставшееся количество щелочи определяют титриметрически с метиловым оранжевым. Фенолфталеин в качестве индикатора не рекомендуется, так как возможно искажение результата за счет взаимодействия щелочи с CO 2 . Массу аммиака рассчитывают по формуле
В другом варианте метода обратного титрования к анализируемому раствору соли аммония добавляют избыток щелочи, и выделившийся аммиак отгоняют в определенный заведомо избыточный объем титрованного раствора кислоты. Количество кислоты, оставшейся в растворе после взаимодействия с аммиаком, определяют титрованием щелочью по метиловому оранжевому. Применение фенолфталеина и других индикаторов с pT >7 недопустимо, так как в реакцию могут вступить ионы аммония, присутствующие в растворе. Результат анализа рассчитывают по формуле обратного титрования
Отгонка аммиака используется в широко известном методе определения азота в органических соединениях по Кьельдалю. В простейшем варианте этого метода пробу обрабатывают при нагревании концентрированной серной кислотой в присутствии солей ртути (катализатор), в результате чего органические соединения окисляются до CO 2 и H 2 O , а азот переходит в NH 4 HSO 4 . После охлаждения к остатку добавляют раствор щелочи и отгоняют NH 3 в отмеренный объем титрованного раствора кислоты, а затем определяют избыток кислоты, не вошедшей в реакцию с аммиаком, и рассчитывают массу азота в пробе по формуле обратного титрования. Методом Кьельдаля можно определять азот в аминах, аминокислотах, алкалоидах и многих других азотсодержащих соединениях. Некоторые соединения можно проанализировать методом Кьельдаля только после предварительного разложения или восстановления хлоридом олова ( II ) или цинковой пылью (азосоединения, производные гидразина и т.д.).
Поглощать выделяющийся аммиак можно раствором борной кислоты. Образующийся борат-ион легко титруется соляной кислотой (по метиловому оранжевому) в присутствии избытка борной. Этот прием можно рассматривать как титрование по замещению.
Еще одним методом определения ионов NH 4 + является формальдегидный метод, основанный на реакции иона аммония с формальдегидом
Количество образующейся кислоты, согласно уравнению реакции В реакции образуется также уротропин (CH2)6N4. , эквивалентно количеству солей аммония. В анализируемый нейтральный раствор вводят формальдегид, и выделившуюся кислоту титруют щелочью по фенолфталеину, так как реакция ионов аммония с формальдегидом обратима, но в слабощелочном растворе идет до конца. На практике часто приходится заранее определять поправку на муравьиную кислоту HCOOH , присутствующую в формальдегиде. Результат анализа рассчитывают по формуле

Определение фосфора . Согласно данным, приведенным в разделе 2.7.2, фосфорная кислота может быть оттитрована как одно- или как двухосновная. При добавлении CaCl 2 в раствор фосфорной кислоты образуется трехзамещенный малорастворимый фосфат кальция, и выделяется эквивалентное количество ионов водорода, благодаря чему фосфорная кислота титруется как трехосновная. Пирофосфорная кислота H 4 P 2 O 7 титруется как двухосновная.
Для определения фосфора в рудах, концентратах и продуктах различной технологической переработки часто используют молибдофосфатный метод с титриметрическим окончанием. В азотнокислой среде фосфор осаждается молибдатом аммония в виде желтого осадка молибдофосфата аммония ( NH 4 )3[ PMo 12 O 40 ], который после фильтрования и промывания растворяется в избытке титрованного раствора NaOH
Избыток щелочи оттитровывается кислотой в присутствии фенолфталеина. В реакции титрования, кроме избытка NaOH, принимают участие ионы PO 4 3– и молекулы NH 3 , что вызывает дополнительный расход кислоты в количестве 4 H + на каждый атом фосфора. Молярная масса эквивалента фосфора в этом методе будет составлять поэтому M ( 1 /23 P ). Малая величина эквивалентной массы в значительной степени компенсирует многие методические недостатки этого способа, связанные с неполнотой оттитровывания аммиака в точке конца титрования с фенолфталеином, улетучиванием аммиака при титровании, поглощением CO 2 из воздуха и т.д.
Определение спиртов . Спирты и многие другие органические вещества могут быть определены методом кислотно-основного титрования по замещению. При анализе спирта ROH к пробе добавляют определенный объем раствора уксусного ангидрида ( CH 3 CO )2 O в пиридине или другом подходящем растворителе, в котором легко и быстро протекает реакция между спиртом и ангидридом
После окончания этой реакции к раствору добавляют воду для перевода оставшегося ангидрида в кислоту
И титрованием щелочью определяют общее количество уксусной кислоты, образовавшейся в результате обеих реакций.
Вторую такую же порцию раствора уксусного ангидрида растворяют в воде и вновь определяют количество образовавшейся уксусной кислоты. При взаимодействии уксусного ангидрида со спиртом из одной молекулы ангидрида получается одна молекула уксусной кислоты, а при растворении ангидрида в воде – две молекулы кислоты. Разница в объемах щелочи, затраченной на титрование, дает возможность рассчитать массу спирта

где V 1 – объем щелочи, израсходованный на титрование кислоты, которая образовалась при растворении ангидрида в воде после реакции со спиртом; V 2 – объем щелочи, израсходованный на титрование кислоты, которая образовалась при растворении ангидрида в воде.
Источник
Лекция 16. Определение аммиака в солях аммония
Ключевые слова: кривая титрования, обратное титрование, метод Кьельдаля, заместительное титрование, формальдегидный метод.
Катион аммония NH4 + проявляет очень слабые кислотные свойства, за счет гидролиза: NH4 + + H2O 
Процесс характеризуется константой гидролиза:
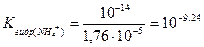
Поскольку константа очень мала, на кривой титрования соли аммония щелочью скачок отсутствует и его прямое титрование щелочью с применением рН-индикатора невозможно. Поэтому для определения аммиака (NH3) в солях аммония (NH4 + ) применяют косвенные методы анализа: обратное титрование или заместительное титрование.
В первом вариантеметода обратного титрования к анализируемому раствору добавляют избыток точно отмеренного титрованного раствора NaOH и нагревают до полного удаления NH3 из раствора.
Окончание удаления аммиака (≈30 мин) определяют по влажной индикаторной бумаге, ее вносят в пары над нагреваемой колбой с раствором. По окончании удаления всего аммиака индикаторная бумага не синеет.
Оставшееся количество щелочи определяют титрованием стандартным раствором кислоты (например, HCl) в присутствии метилоранжа.
Фенолфталеин в качестве индикатора не применяется, так как возможно искажение результата за счет взаимодействия щелочи с СО2.
Расчет результатов анализа проводят по закону эквивалентов.
1 способ. Если известны концентрации растворов кислоты и щелочи, по результатам титрования рассчитывают объем щелочи (VNaOH(остаток)), пошедший на реакцию с кислотой (HCl), по соотношению
где NNaOH – нормальная концентрация рабочего раствора щелочи; NHCl – нормальная концентрация рабочего раствора кислоты; VHCl – объем рабочего раствора кислоты, пошедший на титрование в присутствии метилоранжа; VNaOH – избыточный объем добавленного рабочего раствора щелочи.
Объем раствора щелочи, пошедший на реакцию с NH4Cl, равен разности:
где nэкв — количество эквивалентов указанных веществ, моль.
2 способ. Щелочь (NaOH) расходуется на взаимодействие с двумя веществами (NH4Cl и HCl), поэтому справедливо соотношение
Если концентрация щелочи неизвестна, в ходе анализа проводят контрольное титрование, в котором определяют объем кислоты (VHCl(контр)), необходимый для полной нейтрализации объема щелочи, взятого на анализ (VNaOH). В этом случае:
Массу аммиака (m(NH3)) рассчитывают по формуле
где M(ЭNH3) =17 г/моль – молярная масса эквивалента NH3.
Пример.К навеске соли аммония добавили 30,00 мл 0,1024 н раствора щелочи, прокипятили до полного удаления аммиака, после чего оттитровали 10,50 мл 0,09876 н раствора соляной кислоты. Рассчитать массу аммиака и массу азота, содержащегося в образце.
В широко известном методе определения азота в органических соединениях по Кьельдалю используется второй вариант метода обратного титрования. Методом Кьельдаля можно определять азот в аминах, аминокислотах, алкалоидах, белках, пищевых продуктах и многих других азотсодержащих соединениях. Пробу органического вещества обрабатывают при нагревании концентрированной серной кислотой, в результате чего органические соединения окисляются до СО2 и Н2О, а азот переходит в (NH4)2SО4. После охлаждения к остатку — анализируемому раствору соли аммония — добавляют избыток щелочи:
Выделившийся аммиак отгоняют в точно измеренный избыточный объем (VHCl) титрованного раствора кислоты.
Количество кислоты, оставшейся в растворе после взаимодействия с аммиаком, определяют титрованием щелочью c метилоранжем.
Применение фенолфталеина и других индикаторов с рТ > 7 недопустимо, так как в реакцию могут вступить ионы аммония, присутствующие в растворе. Результат анализа рассчитывают по закону эквивалентов для обратного титрования:
где VHCl – избыточный объем рабочего раствора кислоты;
VNaOH – объем рабочего раствора щелочи, пошедший на титрование в присутствии метилоранжа.
Одним из самых точных методов определения солей аммония является формальдегидный метод заместительного титрования. Он основан на реакции
В результате реакции в количестве, эквивалентном соли аммония, образуется сильная кислота (HCl), которую титруют раствором щелочи в присутствии фенолфталеина
HCl + NaOH → NaCl + H2O.
Необходимо применять индикатор с рТ≈9, поскольку в результате реакции образуется слабое основание— гексаметилентетрамин ((CH2)6N4), и точка эквивалентности лежит при рН > 7.
Кроме того, формальдегид может быть загрязнен муравьиной кислотой в результате его окисления кислородом воздуха:
Муравьиная кислота также оттитровывается раствором щелочи с образованием формиата натрия, водный раствор которого имеет щелочную реакцию. Для введения поправки на содержание муравьиной кислоты проводят «холостой опыт» титрования образца формальдегида раствором щелочи в присутствии фенолфталеина.
CHOOH + NaOH → CHOONa + H2O.
Объем щелочи, пошедший на титрование образца формальдегида (VNaOH(мк)), вычитают из объема, пошедшего на титрование исследуемого раствора (VNaOH). Содержание аммиака рассчитывают по соотношению
Контрольные вопросы
1. Почему невозможно прямое титрование катионов аммония щелочью?
2. Метод обратного титрования для определения содержания аммиака в
3. В каком случае и для чего проводят контрольное титрование щелочи?
4. Определение азота в органических соединениях по методу Кьельдаля.
5. Метод заместительного титрования (формальдегидный метод) для
определения содержания аммиака в солях аммония.
6. Что такое «холостой опыт» и для чего его проводят?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 159 – 161.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.126 — 128.
Источник






