Стерилизация фильтрованием
Растворы термолабильных веществ стерилизуют фильтрованием с помощью мембранных и глубинных фильтров, задерживающих микроорганизмы и их споры. В настоящее время этот метод очистки находит все более широкое применение и при изготовлении многих инфузионных растворов, которые затем будут подвержены окончательной стерилизации.
Стерилизация фильтрованием имеет преимущества благодаря высокой производительности при использовании фильтрующих установок, удобству в работе (по сравнению с тепловой и химической стерилизацией), безопасности для персонала, сохранению стабильности лекарственных веществ в процессе стерилизации. Однако данный метод стерилизации целесообразен только в случае изготовления лекарственных форм в асептических условиях с последующей фильтрацией в ламинарном потоке воздуха.
Глубинные фильтры. Фильтры этой группы характеризуются сложным механизмом задержания и в большинстве случаев непостоянным размером пор. К глубинным относят следующие виды фильтров:
фильтры из керамики — (бактериальные фильтры ГИКИ) или из фарфора в виде полых цилиндров, запаянных с одной стороны. Свечи имеют поры размером 3 — 4 мкм; фильтрация через них возможна под давлением, а чаще — с использованием вакуума. Процесс фильтрации длительный, фильтры трудно очищать от механических включений, микроорганизмов и лекарственных веществ, в глубине стенок фильтра возможно развитие микрофлоры; при появлении в них невидимых микротрещин возникает опасность микробного загрязнения растворов;
стеклянные фильтры с размером пор около 2 мкм, которые изготавливаются из сваренных стеклянных зерен в виде пластинок или дисков, закрепленных в стеклянных сосудах. Фильтрация через них осуществляется под разрежением. Недостатком стеклянных фильтров является их хрупкость: в процессе работы возможны сколы частиц и попадание стеклянной пыли в раствор. Поэтому после их использования необходимо применять мембранную фильтрацию, а для защиты фильтров от крупных частиц перед ним устанавливают предфильтр из ваты и марли. Все это затрудняет применение стеклянных фильтров в аптечной практике;
фильтры толщиной 2 —6 мм из волокнистых материалов (ваты медицинской гигроскопичной, фильтровальной бумаги марки Ф-1М с порами величиной 19 мкм, марли, ткани из хлопка, шерсти, сетки из натурального шелка, синтетических волокон, стекловолокон, асбеста) и др. Чем толще фильтр, тем больше он задерживает частиц. Эти фильтры устойчивы к высоким температурам, фильтрация с их использованием высокопроизводительна. Размер пор этих фильтров разный; механические включения, микроорганизмы задерживаются на пересечении волокон и адсорбируются. Однако нарушение температурного режима, изменение столба жидкости, рН, удар могут привести к проникновению микроорганизмов и загрязнению профильтрованных растворов. Кроме того, при длительной фильтрации растворов (более 8 ч) в глубине фильтра микроорганизмы могут прорастать, что приводит к контаминации раствора. Отрыв волокон фильтра из асбеста или стекловолокна также вызывает загрязнение фильтрата. Поэтому фильтры из стеклянных и асбестовых волокон для стерилизации внутренних растворов запрещены к применению.
Для фильтрации стерильных растворов объемом не менее 100 мл в настоящее время используют «Комплект фильтрующий погружной П-40М», фильтрующие и процеживающие элементы которого выполнены из специальной тканной металлической сетки мелкоячеистой структуры и с металлической окантовкой. В последнее время глубинные фильтры вытесняются мембранными.
Мембранные фильтры. Фильтры этой группы характеризуются ситовым механизмом задержания микроорганизмов и постоянным размером пор.
Полупроницаемые мембранные фильтровальные элементы изготавливают из эфиров целлюлозы (АЦ, ЭЦ, нитроцеллюлозы), регенерированной целлюлозы, ПВХ, акрила, нейлона и других полимеров методом спекания, отливки, растягивания.
Мембраны для фильтрующей стерилизации представляют собой тонкие полимерные диски различного диаметра, толщиной 10 — 30 мкм, порами размером 0,1 — 10 мкм. В фармацевтической технологии применяют:
v мембранные фильтры «Владипор» из ацетата целлюлозы типа МФА № 3 и 4 с порами размерами 0,25 — 0,35 и 0,35 — 0,45 мкм;
v мембраны марки МФА-А № 1, задерживающие частицы размером 0,2 мкм и более, марки МФА-А № 2 — размером 0,5 мкм и более (применяют для фильтрации воды);
v мембраны «Владипор» типа МФЦ на основе регенерированной целлюлозы с порами четырех размеров: 0,15, 0,2, 0,45, 0,6 мкм;
v фильтрационные капроновые мембраны «Мифил» с порами размером 0,2 мкм;
v полиядерные лавсановые фильтры с порами размером от 0,02 до 5 мкм;
v мембраны «Владипор» типа МФА-МА № 1 — 10 с порами размером от 0,05 до 1 мкм (для фильтрации воды).
Медицинское научно-производственное предприятие «Экс-пресс-ЭКО» (г. Обнинск) выпускает комплекты фильтрационные аптечные КФА-«Э-Э» (из фторопласта марки Ф4) с порогом задержания частиц 0,2; 0,5; 1,0; 5,0; 10,0 мкм для микрофильтрации инъекционных растворов.
Мембранные фильтры могут стерилизоваться насыщенным паром или антисептиками. Для задержки крупных частиц и предотвращения быстрого забивания пор используют предфильтры с более крупными порами (из специальных сортов картона, полимерных материалов, фильтровальной бумаги).
Фильтрацию растворов через мембранные фильтры проводят под вакуумом или под давлением. В последнем случае расфасовку фильтрата во флаконы проводят одновременно с фильтрацией. При вакуумной фильтрации расфасовку проводят после ее окончания.
Для стерилизации фильтрацией используют установки, включающие емкость с приготовленным раствором, фильтродержатель, емкость для фильтрата и источник избыточного давления (насос). Применяют фильтродержатели двух типов: пластинчатые и фильтрпатроны с одним или более трубчатыми фильтрами.
Непосредственно перед фильтрованием и после стерилизации частей установки проводят испытание мембранного фильтра на герметичность и целостность с помощью теста «Точка пузырька» (согласно ГФ XI). После фильтрации тест повторяют. Стерилизацию фильтрованием и дозирование раствора во флаконы проводят в асептических условиях.
Для фильтрации небольших объемов используют установку стерилизующей фильтрации инъекционных растворов УФИ-12.
Эффективность стерилизации проверяют прямым посевом пробы фильтрата в питательную среду.
Источник
Cтерилизация фильтрованием
Фильтрование через мелкопористые фильтры — механический способ избавления растворов от нерастворимых образований с малым поперечником частиц, каковыми могут считаться микробные клетки и споры. Государственная фармакопея XI включает этот метод стерилизации для стерилизации термолабильных растворов. Материалом для изготовления фильтров при этом являются такие материалы, как неглазурованный фарфор (керамика), стекло, асбест, пленки, пропитанные коллодием, и другой пористый материал.
В данное время используются фильтры различных конструкций, глубинные и мембранные (размеры их пор не превышают 0,3 мкм).
Глубинные фильтры бывают керамическими и фарфоровыми (размер пор 3—4 мкм), стеклянными (размер пор около 2 мкм), бумажно-асбестовыми (с диаметром пор около 1—1,8 мкм), мембранными (ультра) и др.
Механизмы задержания микробных агентов глубинными фильтрами бывают ситовыми, адсорбционными, инерционными. При фильтрации задерживаются частицы, размер которых меньше диаметра пор фильтра. Керамические фильтры (свечи) различаются величиной пор. На практике чаще всего используются бактериальные фильтры ГИКИ (ГИКИ — Государственный институт керамических изделий) двух типов: Л-5 и Ф-5. Эти фильтры изготавливаются в виде полых цилиндров, закрытых с одного конца, и с отверстием — с другого. Если фильтрование осуществляется в условиях вакуума, то фильтруемый раствор просачивается через стенки внутрь свечи, а затем выводится наружу.
При вакуумном фильтровании используются свечи Беркефельда.
При фильтровании раствор под давлением предварительно фильтруется, а затем вводится внутрь бактериологического фильтра и, просачиваясь через него, попадает в стерильный сосуд.
При фильтровании растворов под давлением используют свечи Шамберлена. Диаметр керамических фильтров составляет 3—4 мкм.
Фарфоровые фильтры согласно положениям Государственной фармакопеи XI перед применением должны быть простерилизованы термическим способом.
Продолжительность фильтрования должна составлять не более 8 ч.
Недостатками фильтрования через фарфоровые свечи является, во-первых, значительная длительность процесса, во-вторых, потеря части раствора в порах толстого фильтра при трудоемкости процесса очистки фильтров.
Стеклянные микропористые фильтры чаще, чем другие мелкопористые фильтры, употребляются в аптечном производстве.
В стеклянных сосудах закрепляются фильтры, имеющие вид дисков или пластинок (изготовленных из зерен стекла с диаметром до 2 мкм). Для фильтрования при помощи вакуума удачной моделью являются стеклянные бактериологические фильтры-воронки, впаянные в колокол, производимые в Германии на заводах Шотта. В боковой поверхности колокола имеется трубка, посредством которой создаются условия вакуума. Фильтруемые растворы пропускаются через стеклянные пластины с диаметром пор 0,7—1,5 мкм (фильтр-воронку). Далее стерильный фильтрат поступает в склянку, расположенную внутри колокола под фильтром-воронкой. Перед применением фильтры-воронки стерилизуют паром при избыточном давлении при температуре 120 °С в течение 20 мин или воздушным методом при температуре 180 °С в течение 1 ч.
После использования фильтрационные пластины промываются струей дистиллированной воды. Если с поверхности пластин требуется удалить не только механические частицы, то проводят химическую очистку: пластины на 10—12 ч погружают в смесь равных частей 2%-ного раствора натрия или калия нитрата и перхлората в концентрированной кислоте серной, подогретой до температуры 100 °С (образовавшиеся продукты реакции растворимы в воде и не адсорбируются фильтром). По возможности для каждого раствора применяют отдельный фильтр. При длительном сроке эксплуатации керамических и фарфоровых фильтров существует угроза образования микротрещин, прорастания микроорганизмов, а качество стерилизации оказывается ненадежным.
Бумажно-асбестовые фильтры применяются в фильтре Сальникова в виде пластин. Фильтр Сальникова представляет собой металлическую раму, встроенную между двумя дисками. В аптеках лечебно-профилактических учреждений и заводских производствах часто используются фильтры Зейца (немецкого производства).
В качестве фильтрующих поверхностей в этих фильтрах устанавливаются пластины из клетчатки и асбеста с диаметром пор 1—1,8 мкм. Так как данные фильтры в своем составе имеют волокнистые элементы, существует возможность отделения части волокон и попадания их в стерилизуемый раствор.
Поэтому для стерилизации инъекционных растворов бумажно-асбестовые фильтры не рекомендуются, так как введение волокон в составе инъекции может повлечь патологические реакции со стороны организма человека.
Для стерилизации инъекционных растворов наиболее подходящими являются микропористые мембранные фильтры. Механизм задержания микробных клеток — ситовый. Размер пор этих фильтров постоянен. Изготавливаются мембранные фильтры из полимерных материалов в виде тонких пластин толщиной 100—150 мкм. При стерилизации больших объемов растворов принято использовать одновременно два типа фильтров, различающихся между собой диаметром пор. Сначала стерилизуемый раствор пропускают через более крупные поры предфильтра, а затем через фильтр со средним диаметром пор — около 0,3 мкм.
Разработкой составов полимерных материалов для различных видов микропористых фильтров занимаются в Научно-исследовательском институте медицинских полимеров и Научно-исследовательском институте синтетических смол. Одной из недавних таких разработок является мембранный фильтр “Владипор”, изготавливаемый из ацетата целлюлозы типа МФА, для стерилизации растворов, имеющих рН в пределах от 1,0 до 10,0. 10 типов “Владипора” различаются между собой размерами пор (от 0,05 до 0,95 мкм). Для стерилизации растворов лекарственных веществ применяют фильтры МФА-3 с размером пор 0,25—0,35 мкм и МФА-4 с размером пор 0,35—0,45 мкм. Перед применением фильтры МФА стерилизуют насыщенным водным паром при избыточном давлении и температуре 120 °С или сухим горячим воздухом при температуре 180 °С. Применимы радиационный метод или стерилизация ультрафиолетовой радиацией.
Разработаны полимерные фильтры в виде пленок с цилиндрическими порами — ядерные фильтры, а также прошла испытания установка для стерилизующего фильтрования (УСФ-293-7), позволяющая за 20 мин отфильтровать и расфасовать во флаконы по 400 мл 20 л раствора.
Установки для стерилизующего фильтрования состоят из следующих элементов:
фильтродержателя;
Фильтродержатели бывают в основном пластинчатые (круглые или прямоугольные) и в виде патронов с одним или несколькими трубчатыми фильтрами.
Непосредственно перед фильтрованием проводят стерилизацию фильтра в держателе и емкости для сбора фильтрата насыщенным водным паром при температуре 120 °С или горячим воздухом при температуре 180 °С.
Стерилизация фильтрованием очень удобна и экономически выгодна для использования в аптечных условиях (например, для стерилизации глазных капель (особенно с витаминами), которые готовят в аптеках в большом количестве). Другим преимуществом по сравнению с методами термической стерилизации является возможность стерилизации термолабильных веществ. Таким образом, стерилизация фильтрованием — перспективный метод стерилизации инъекционных растворов, глазных капель, жидких лекарственных форм для новорожденных и детей до 1 года.
Источник
Стерилизация фильтрованием
Стерилизация фильтрованием применяется в тех случаях, когда субстраты не выдерживают нагревания, в частности, для сред, содержащих белки, для сывороток, некоторых антибиотиков, витаминов, летучих веществ, например, некоторых углеводородов. Этот прием довольно широко используется для стерилизации куль-туральной жидкости, когда необходимо освободить ее от клеток микроооганизмов, но сохранить все содержащиеся в ней продукты обмена в неизмененном виде. Способ заключается в фильтровании жидкостей через специальные фильтры, имеющие мелкопористые перегородки и поэтому задерживающие клетки микроорганизмов. Причем здесь имеет место не только механическая задержка, но и адсорбция микроорганизмов па стенках (поверхностях), ограничивающих поры, вследствие того, что большинство микроорганизмов в водных суспензиях несет на своей поверхности отрицательным заряд, а фильтры изготавливаются из изложи-1ельно заряженных материалов. Если изготовить фильтр из электроотрицательного материала, например, из обожженного гипса пли алебастра, то многие микроорганизмы будут легко проходить через него. Поры фильтров должны быть достаточно мелкими не только затем, чтобы обеспечить механическую задержку клеток, но и для того, чтобы микроорганизмы оказались в сфере действии электрического заряда стенок. Диаметр пор определяет область

применения фильтров. Фильтры с относительно крупными порам: применяют для очистки (фильтрования) воды от планктонных организмов, для отделения более крупных микроорганизмов от мелких. Чем мельче поры фильтра, тем более пригоден он для стерилизации. Пригодность фильтров для стерилизации испытывают путем пробной фильтрации через них суспензии какого-либо мелкого микроорганизма, например, Pseudomonas pyocyaneum; Serratia marcescens. Для проверки на стерильность фильтрат в большом количестве высевают на питательную среду. Если в течение пяти дней тест-организм не вырастет, фильтры могут быть использованы для стерилизации. Как правило, бактериальные фильтры пропускают вирусы и бактериофаги.
Бактериальные фильтры изготавливаются из различных материалов. Они имеют различную форму и разный диаметр пор. обычно указанный на упаковке фильтра или в прилагаемом паспорте. Нередко фильтры выпускаются под определенными номерами и марками. Каждый номер или марка соответствуют определенному размеру пор. В настоящее время для стерилизации наиболее широко используются два типа фильтров: мембранные фильтры и фильтры Зейтца.
Мембранные фильтры готовят из коллодия, ацетата, целлюлозы и других материалов. Они представляют собой диски, напоминающие бумажные, толщиной около 0,1 мм. Диаметр мембранных фильтров может быть разный. Отечественная промышленность выпускает мембранные фильтры диаметром 35 мм. В зависимости от размеров пор они обозначаются № 1, 2, 3, 4 и 5 (табл. 5).
Для стерилизации наиболее пригоден фильтр № 1. Кроме перечисленных, выпускается еще так называемый «предварительный фильтр». Он предназначен только для фильтрации.
Фильтры Зейтца — это плотные диски, изготовленные из смеси асбеста с целлюлозой. С увеличением содержания целлюлозы пористость фильтра возрастает. Верхняя поверхность дисков фло-кулирована. Отечественные асбес-
товые фильтры обозначаются марками Ф2 и СФ. Стерилизующими являются фильтры марки СФ. Помятые асбестовые пластинки, а также пластинки с надломами и трещинами для работы непригодны.
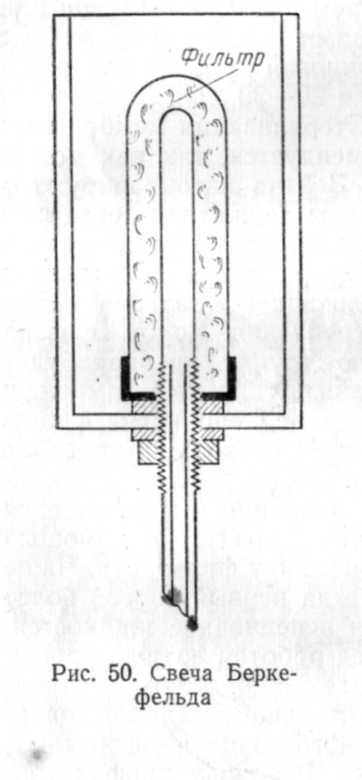
Кроме того, для стерилизации применяются фильтры, изготовленные из каолина с примесью кварцевого песка («свечи» Шам-берлана), из инфузорной земли («свечи» Беркефельда, рис. 50) и из других материалов. Свечи Шамберлана различаются по размерам пор и степени пористости. Фильтры с обозначением L наибо-
лее пористые. Они пропускают все бактерии. Свечи L,bis и L2 задерживают клетки только крупных бактерий. Свечи L3 задерживают споры столбняка и палочку дифтерии. Затем в порядке уменьшения размеров пор свечи обозначаются от L5 до L13. Свечи, предназначенные, главным образом, для фильтрации воды, обозначаются F и В, причем, по своей пористости свечи F соответствуют
L5, а свечи В—L7. Форма свеч Шам-берлана может быть разной. Свечи Беркефельда имеют обозначения W, N и V, что соответствует диаметрам пор 3—4, 5—7 и 8—12 мк.
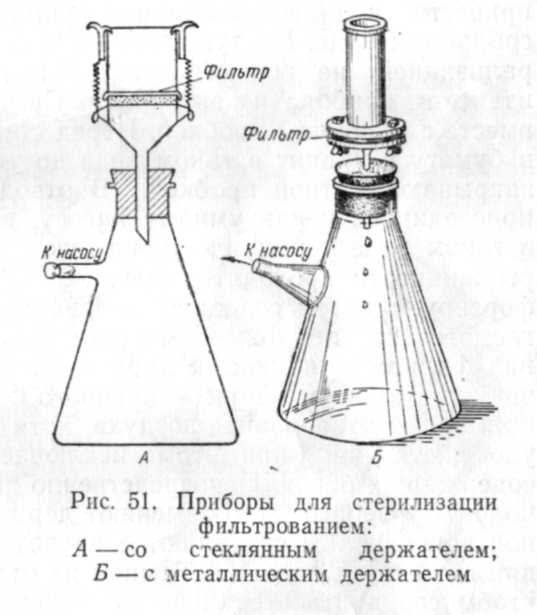
Работа с бактериальными фильтрами осуществляется следующим образом. Фильтр должен быть закреплен в специальном держателе, который вставляется в приемник фильтрата. Обычно приемником является колба Бунзена. Для мембранных фильтров имеются многочисленные держатели, приспособленные для фильтрования различных объемов жидкостей. Есть, например, держатель, изготовленный целиком из стекла, в котором в качестве опоры фильтра используется крупнопористый стеклянный диск. Есть металлические держатели. Держатели для фильтров Зейтца изготавливают в большинстве случаев из нержавеющей стали. Асбестовая пластина крепко зажимается винтами между верхней (цилиндр без дна) и нижней (воронкообразный тубус) частями держателя (рис. 51). Опорой для асбестового диска служит сетка или пористая пластинка из нержавеющей стали. Трубка фильтра,
По которой стекает фильтрат, через резиновую пробку проходит в колбу Бунзена. Нередко весь этот прибор в собранном виде называют фильтром Зейтца. Свечи Шамберлана вставляют непосредственно в резиновую пробку. Перед употреблением фильтры, их держатели и приемник фильтрата должны быть простерилизо-ваны. Мембранные фильтры можно стерилизовать, поместив их в дистиллированную воду, автоклавированием при 1 атм 15 мин или длительным кипячением. Сосуд с фильтрами должен быть закрыт ватной пробкой. Держатель вместе с резиновой пробкой заворачивают в бумагу и автоклавируют при 1 атм 20—30 мин. Прибор собирают непосредственно перед работой. Стерилизация мембранных фильтров вместе с держателем не рекомендуется, так как может привести к их повреждению. Фильтры Зейтца автоклавируют в собранном виде. Но туго завинчивать винты держателя перед сте-рализацией не рекомендуется. Винты подтягивают только после изъятия прибора из автоклава. Свечи стерилизуют в автоклаве вместе с резиновой пробкой. Перед стерилизацией их заворачивают в бумагу и хранят в таком виде до употребления. Колбу Бунзена закрывают ватной пробкой. В отводную трубку, которая будет присоединена к вакуумному насосу, вставляют ватный тампон, и в таком виде приемник стерилизуют. Через мелкопористые фильтры жидкости проходят медленно. Поэтому обычно фильтрование форсируют путем создания на фильтре перепада давления, достигаемого либо приложением повышенного давления к находящейся над фильтром жидкости, либо откачиванием воздуха с помощью вакуумного насоса, присоединенного к приемнику фильтрата. Чаще применяют откачивание воздуха, хотя иногда первый способ более удобен, так как при этом исключается вспенивание жидкостей, содержащих белок. Непосредственно перед работой ватную пробку колбы Бунзена быстро заменяют держателем с фильтром, а отводной конец колбы соединяют с предохранительной склянкой, находящейся перед насосом. Тампон из отводного конца не вынимают, чтобы сохранить стерильность приемника. Разливку профильтрованных сред производят в стерильных условиях в заранее просте-рилизованную посуду. Так же, как и при термической стерилизации, разлитые среды 2—3 суток выдерживают при 30° С. Если в них обнаружится рост микроорганизмов, среды готовят заново.
Мембранные и асбестовые фильтры рассчитаны на одноразовое использование. Свечи после использования сначала промывают дистиллированной водой, просасывая ее в направлении, обратном фильтрованию. Затем фильтры заливают на ночь концентрированной серной кислотой, содержащей небольшие количества нитрата натрья и хлорнокислого калия. На следующий день их многократно промывают дистиллированной водой, а затем кипятят в воде для удаления растворенного воздуха. Свечи не следует мыть смесью двухромовокислого калия с серной кислотой, так как хромат адсорбируется на фильтре, что может привести к повреждению фильтра и испортить фильтрат. Нельзя обрабатывать фильтры кон-
центрированными растворами щелочей, так как это может увеличить размеры пор. Для очистки свеч от посторонних частиц органического происхождения их можно прокаливать в муфельной печи.
Следует учитывать, что состав жидкостей, прошедших через бактериальные фильтры, может меняться вследствие адсорбции на фильтрах ряда веществ, таких, например, как некоторые жирные кислоты, белки, полисахариды и др. В результате среды могут оказаться непригодными для культивирования данных микроорганизмов. Возможность и степень адсорбции веществ на фильтре определяется химической природой фильтра, размерами его пор, временем фильтрования.
СТЕРИЛИЗАЦИЯ СТЕКЛЯННОЙ ПОСУДЫ
Основным способом стерилизации стеклянной посуды является стерилизация горячим воздухом. Она осуществляется в сушильных шкафах при температуре 165—170° С в течение двух часов. При этом погибают и вегетативные клетки, и споры микроорганизмов.
Сушильные шкафы (рис. 52) делают из термостойких материалов — обычно из металла и асбеста. Внутри шкафа имеются одна-две полки, а наверху отверстие, в котором с помощью пробки укрепляют термометр. У стенки шкафа или вблизи греющей поверхности температура всегда значительно выше, чем внутри, поэтому ртутный шарик термометра должен находиться внутри шкафа на расстоянии 6—8 см от верхней стенки. Наверху имеется также отверстие для вентиляции, которое при стерилизации закрывают. У шкафов с электрическим нагревом имеются регуляторы, обеспечивающие поддержание необходимой температуры.
Подготовка посуды к стерилизации. Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильно-
сти после прогревания. Посуду развертывают непосредственно перед употреблением.
На рис. 53 показан процесс подготовки пипеток к стерилизации. В концы пипеток, которые берутся в рот, вставляют ватные
тампоны. Пипетки заворачивают в длинные полоски бумаги, шириной 4—5 см. Обмотку начинают с конца, который опускают в среду. Постепенным движением бумаги по спирали оканчивают обмотку у того конца, который берется в рот. Завернутые пипетки для предохранения бумаги от загрязнения и разрывов перед стерилизацией обычно заворачивают по нескольку штук вместе или помещают их в специальные металлические или картонные пеналы. Каждую чашку Петри лучше завертывать отдельно; можно завертывать и вместе по 2—3 штуки. Шпатели также стерилизуют завернутыми в бумагу; каждый шпатель заворачивают отдельно. Колбы, пробирки и трубки Бурри закрывают ватными пробками. На пробки можно надеть бумажные колпачки, предохраняющие горлышко от пыли.
Посуду, подготовленную для стерилизации, загружают в сушильный шкаф не слишком плотно, чтобы обеспечить некоторую циркуляцию воздуха и равномерный, надежный прогрев стерилизующегося материала. Сушильный шкаф при стерилизации должен быть закрыт. Если шкаф не снабжен терморегулятором, необходимо все время следить за температурой, так как при понижении ее не осуществится стерилизация, а при нагреве выше 175°С бумага и пробки начинают разрушаться. По окончании стерилизации шкаф че открывают до тех пор, пока температура в нем не упадет до 100—70°С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться.
Посуду можно стерилизовать и в автоклаве.
СТЕРИЛИЗАЦИЯ ИНСТРУМЕНТОВ И ПРИБОРОВ
Мелкие металлические инструменты (петли, иглы, пинцеты, ножницы) стерилизуют прокаливанием в пламени непосредственно перед использованием. На пламени кратковременно обжигают горлышки колб, пробирок, бутылок, а также ватные пробки при пересевах культур и разливе сред. В пламени погибают и клетки, и споры микроорганизмов.
Приборы для культивирования микроорганизмов, а также детали к этим приборам, резиновые пробки и шланги стерилизуют автоклавированием. Предметы, подлежащие стерилизации в автоклаве, завертывают в бумагу.
Некоторые предметы (металлические инструменты, мембранные фильтры) иногда стерилизуют длительным кипячением в дистиллированной воде. Однако этим способом с целью стерилиза-ции в микробиологической практике пользуются редко в связи с тем, что длительное кипячение может повредить обрабатываемый материал, а уменьшение времени кипячения может не обеспечить стерилизацию, так как споры некоторых микроорганизмов
сохраняют жизнеспособность даже после кипячения в течение нескольких часов.
Предметы, изготовленные из термолабильных пластмасс, например, центрифужные пробирки, стерилизуют ультрафиолетовыми лучами. Время облучения устанавливают экспериментально. Оно зависит от мощности используемой бактерицидной лампы и расстояния между лампой и объектом. После облучения предметы до использования следует хранить в стерильной посуде.
Стерилизацию предметов из термолабильных пластмасс можно производить и окисью этилена.
Способы стерилизации питательных сред, посуды и других лабораторных материалов обобщены в табл. 6.
Источник