Мир анальгетических препаратов
Поделиться:
Когда мы просим провизора или фармацевта посоветовать что-то обезболивающее, то вместо простого ответа зачастую слышим множество непростых вопросов. Что болит? Как долго? У кого? Была ли язва? «Неужели нельзя сказать четко и ясно?» — закрадывается невольная мысль. К сожалению, и в самом деле определиться с анальгетиками не так просто.
Лекарства против боли — какие они?
Даже фармакологи путаются в огромном количестве анальгетиков, и потому разные справочники приводят разные типы классификации обезболивающих лекарств. Однако все источники сходятся в одном: анальгетики — это огромная группа препаратов, которые купируют боль, не вызывая при этом анестезию.
К обезболивающим препаратам относятся:
- опиоидные анальгетики;
- парацетамол;
- специфические анальгетики;
- нестероидные противовоспалительные препараты (НПВП);
- антимигренозные препараты.
Пять обширных подгрупп — действительно, есть над чем задуматься. Чтобы уделить основным обезболивающим хотя бы несколько слов, понадобится немало времени и строк. В помощь фармацевтам и, конечно же, потребителям мы начинаем цикл статей, посвященный обезболивающим препаратам, и в первой поговорим об опиоидах, парацетамоле и менее известных специфических анальгетиках.
Опиум для народа
Начнем с «тяжеловесов», которые, к счастью, требуются лишь в самых сложных случаях, — наркотических анальгетиков. Морфин, так же как и большинство других опиоидов (кодеин, фентанил и т. д.), работает за счет стимуляции опиоидных рецепторов, что приводит не только к выраженному обезболиванию, но и к ряду побочных эффектов.
Эйфория, душевный комфорт и прочие «радужные» последствия вместе с быстрым привыканием стали причиной того, что лекарства эти сегодня находятся за семью печатями. Кстати, за свою вполне длительную фармкарьеру я ни разу не держала в руках «настоящий» наркотический анальгетик. Конечно, если не считать таковым знаменитый трамадол.
Трамадол под брендовым наименованием Трамал начал завоевывать мир в 90-е годы, хотя был выпущен на родине, в Германии, еще в 1977-м. По механизму действия он несколько отличается от морфина и иже с ним. Трамадол активирует опиатные рецепторы, а заодно способствует повышению уровня некоторых медиаторов, в частности серотонина, норадреналина и др.
В отличие от опиоидов трамадол имеет синтетическое происхождение: он представляет собой смесь двух стереоизомеров, которые имеют различную анальгетическую активность и дополняют действие друг друга. Подавляющее большинство фармакологических справочников не относят трамадол к наркотическим анальгетикам, выделяя ему почетное место в подгруппе опиоидных ненаркотических обезболивающих.
Читайте также:
Нестероидные противовоспалительные препараты
И все же препарат имеет множество побочных эффектов, легко вступает во взаимодействие с другими лекарствами, может способствовать развитию привыкания, а потому его применение жестко контролируется в большинстве стран мира, в том числе и в России.
Парацетамол: безопасность под вопросом?
Один из самых популярных и, казалось бы, хорошо переносимых анальгетиков — парацетамол. Однако переносимость его в последнее время вызывает все больше споров в среде фармакологов.
Парацетамол, или ацетаминофен, — анальгетик, купирующий легкую и умеренную боль различного происхождения: боль на фоне остеоартроза, головную боль, боль в спине и др. Кроме того, он применяется в качестве жаропонижающего средства, в том числе у младенцев и беременных женщин.
Исследования показали, что применение парацетамола во время беременности не увеличивает риск врожденных пороков развития, в связи с чем препарат используют и в акушерской практике. Но голоса оптимистов все чаще стали заглушаться мнением скептиков. Так, появилась информация о том, что прием парацетамола во время беременности повышает риск развития астмы у ребенка в будущем.
В 2013 году стало известно, что частый прием препарата чреват хоть и очень редкими, зато крайне опасными кожными побочными реакциями. Доказано, что передозировка парацетамола может привести к фатальному повреждению печени.
В общем, невинный образ «безвредного лекарства» сегодня несколько подпорчен, и тем не менее парацетамол занимает одну из ведущих позиций в когорте анальгетиков и до сих пор считается одним из самых безопасных.
На разные случаи жизни
Следующая подгруппа включает несколько разномастных рецептурных обезболивающих препаратов.
В категории малоизвестных анальгетиков:
- Флупиртин — мощный неопиодный анальгетик центрального действия, применяется для лечения умеренной и тяжелой головной, периодической боли, боли после травм и при злокачественных новообразованиях. Не вызывает привыкания.
- Трициклические антидепрессанты, особенно амитриптилин, прекрасно справляются с болью, однако нельзя забывать, что к основному антидепрессивному эффекту в придачу они имеют множество побочных.
- Некоторые противоэпилептические средства, в частности карбамазепин, габапентин и прегабалин. Точный механизм их анальгетического действия пока остается неясным, однако эти препараты способны эффективно лечить нейропатическую боль, в том числе и тяжелую.
Разумеется, «нестандартные» анальгетики не предназначены для массового применения, но в практике врачей самых разных специализаций они могут быть незаменимыми. Этот факт еще раз подтверждает азбучную истину: во избежание развития побочных эффектов и других неприятностей боль должен лечить доктор, а не соседка или рекламная красавица.
И наибольшая опасность таится в самолечении препаратами, доступными для широкого применения, — НПВП, о которых мы с вами поговорим в следующей статье.
Товары по теме: [product strict=»парацетамол»](парацетамол), [product strict=»флупиртин»](флупиртин), [product strict=»амитриптилин»](амитриптилин), [product strict=»карбамазепин»](карбамазепин), [product strict=»габапентин»](габапентин)
Источник
5. Фармакологические методы обезболивания.
Фармакологические принципы лечения боли представлены в таблице 5.
Фармакологические препараты могут влиять на боль, действуя на различных уровнях нервной системы — рецепторном, проводниковом, на уровне задних рогов спинного мозга, ствола мозга, коры больших полушарий. В основу выбора лечения, например острой боли, положен следующий принцип (Вейн A.M., 1999). При слабой боли рекомендуют использовать ненаркотические аналгетики, нестероидные противовоспалительные препараты, вспомогательную терапию. При умеренной боли — слабые опиаты и также вспомогательную терапию. И, наконец, при сильной боли — опиаты, вспомогательную и комбинированную терапии, например, сочетание опиоидных аналгетиков с нестероидными противовоспалительными препаратами, что уменьшает возможность развития наркотической зависимости.
Все обезболивающие (анестезирующие) средства разделены на три большие группы (Авдей Л.В., Данусевич И.К., 1976) -средства общего, местного и комбинированного действий.
Для общего обезболивания (общей анестезии) используются средства для ингаляционного (эфир, фторотан, закись азота, циклопропан) и неингаляционного наркозов (пропанйдид, тиопентал натрия, натрий оксибутират, кетамин).
Издавна боль связывают с сознанием, нарушение которого должно сказываться и на ощущении боли. При нарушении сознания невозможна перцепция. Изменение сознания достигается использованием ингаляционных и неингаляционных наркотических средств, влияющих на корковые и подкорковые центры. На фоне выключения сознания и всех видов чувствительности, исчезновения условных и безусловных рефлексов сохраняется деятельность жизненно важных центров, необходимых для сохранения жизни.
Считают, что действие наркотиков в ЦНС так же, как и нейролептиков типа седуксена, обусловлено подавлением восходящей системы ретикулярной формации за счет изменения физико-химических свойств в цитоплазме клетки, а также угнетением межнейронной (синаптйческой) передачи. При этом возникает функциональная дезинтеграция ЦНС, устраняется активирующее влияние ретикулярной формации на кору мозга и таким образом снижается уровень ноцицептивной афферентации.
К группе зеществ общего обезболивания относятся .также наркотические и ненаркотические аналгетики, особенностью действия которых является уменьшение или устранение боли без выключения сознания и угнетения других видов чувствительности. Наркотические аналгетики группы морфина или его аналогов — морфин, промедол, фентанйл, альфетанил, суфентанил, реми-фентанил, притромид, мепиридин, просидол, омнодон, трамадол, кодеин и др. — особенно широко используются при сильных хронических болях, например, при болевых синдромах травматического, ишемического, опухолевого происхождения и в послеоперационном периоде (Лебедева Р.Н., Никода ВВ., 1998). Однако их существенным недостатком является лекарственная зависимость, что ограничивает применение этих препаратов (Машков-ский М.В., 1980; Жоров В.Ц., 1984; Харкевич Д.А., 1988). В нашей стране наибольшее распространение получили такие наркотические аналгетики, как промедол, омнопон, морфиц.
Наркотические аналгетики вызывают обезболивание за. счет связи с опиатными рецепторами различных уровней ЦНС Причем, морфин оказывает аналитический эффект, связываясь с µ- и κ-опиатными рецепторами. Интересно, что морфиновая и акупунктурная аналгезия сопровождается снижением в 1,5 раза содержания ГАМК в ретикулярной формации и ядрах шва и примерно на такую же величину увеличением ее уровня в центральном сером околоводопроводном веществе (Беляев Ю.Е., Васильев Ю.Н., 1984).
Считают, что наркотические аналгетики усиливают нисходящие антиноцицептивные влияния и прямо угнетают синапти-ческие образования спинного мозга на уровне пре- и постсинаптических образований. При этом уменьшается интенсивность болевой импульсации в супраспинальные отделы мозга, вследствие чегс-Тюнижается болевой порог и подавляются эмоционально-поведенческие реакции на болевое воздействие. По данным В.И.Мамчур (1988), развитие «наркотического» сна (при введении кетамина, тиопентала натрия, оксибутирата натрия, сочетаний типа диазепам — кетамин, дроперидол — фентанил) обусловлено преимущественно изменениями адрен-, дофамин- и опиат-, ергическими и в меньшей степени серотонин-, ацетилхрлин- и ГАМК-ергическими системами.
Полным антагонистом наркотических аналгетиков является налаксон. Он связывается с опиоидными рецепторами, блокирует их, устраняя, таким образом, эффекты опиоидных аналгетиков. Поэтому налаксон может использоваться для прекращения действия опиоидов, особенно при их передозировке.
В последние годы большое внимание уделяется анестетикам (кетамину), оказывающим влияние на опиатные структуры ЦНС не только как экзогенные опиаты, но и как средства для общей анестезии, стимулирующие антиноцицептивную систему организма через нейроэндокринные механизмы (Женило В.М., 1988).
Велика роль NMDA-рецепторов в развитии болевых синдромов, особенно в возникновении гипералгезии и аллодинии. Известно, что возбуждающие аминокислоты (аспартат, глутамат, а также нитрооксид) активируют NMDA-рецепторы, вызывая перевозбуждение ноцицепторов и способствуя формированию ней-ропатического болевого синдрома. Считают, что нитрооксид взаимодействует с NMDA-рецепторами ЦНС и способствует развитию мигренозной боли. Антагонистами NMDA-рецепторов, в частности, является и кетамин, который в последние годы широко используется для лечения острых, в т.ч. и послеоперационных болей, а также некоторых видов хронической боли: центральной, фантомной, посттравматической и постгерпетической, при орофациальных болевых синдромах.
Кроме кетамина, антагонистическое влияние на возбуждающее действие аминокислот оказывает и сирдалуд, который является в то же время агонистом α-адренорецепторов.
Согласно современным представлениями, кроме вышеуказанных эффектов, кетамин вызывает «диссоциативный» наркоз из-за его преимущественной блокады таламо-кортикальных связей И дезорганизации афферентной чувствительности мозга и одновременно активирует опиатные и серотонинергические рецепторы мозга.
Исследования катехоламинов и их предшественников в тканях гипоталамуса, коры головного мозга и лимбических структурах показали, что кетамин своими карбоксильными группами блокирует группы тиоЛового фермента моноаминооксидазы, что сопровождается накоплением в синаптических образованиях мозга норадреналина (Женило В.М. с соавт., 1987). Повышение кон-центрации норадреналина в синаптической щели активирует преимущественно антиноцицептивную систему путем, вероятно, выделения из Пресинатггических образований энкефалинов и эндор-финов.
Ненаркотические аналгетики — это, прежде всего так называемые нестероидные противовоспалительные препараты. К ним относят производные пиразолона (аспирин, амидопирин, аналгин, бутадион, кеторолак, диклофенак), салициловой Кислоты (ацетилсалициловая кислота, салицилат натрия* салициламид, метил-салицилат), индола (индометацин), цинхоновой кислоты (цинко-фен), анилина (феноцитин, Парацетамол). Все они обладают анал-гезирующим, жаропонижающим и противовоспалительным действиями. Хотя установлено, что аналгезирующий эффект более характерен для производных пиразолона, а жаропонижающий — для салициловой кислоты. По мнению Л.В.Авдей и Й.К.Данусевич (1976), аналгезирующее действие наиболее присуще для аналгина и амидопирина и оно резко усиливается в комбинации с барбитуратами, кодеином, салицилатами.
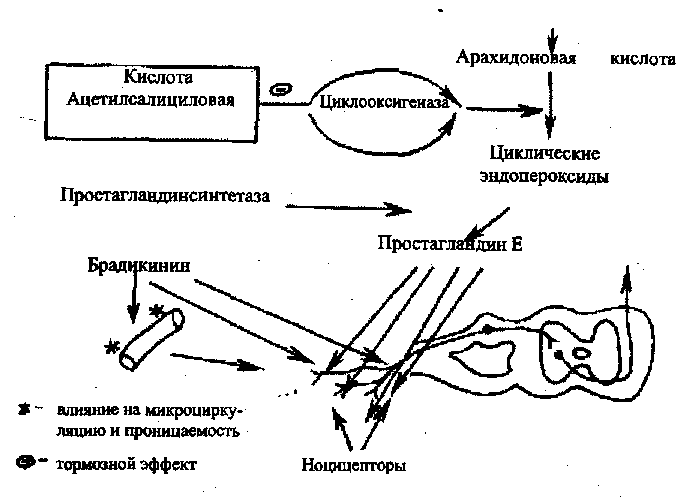
Противовоспалительные средства, действуя на различные звенья патогенеза и уменьшая воспаление, нивелируют боль. Следовательно, эти препараты влияют на боль опосредованно, т.е. налицо их периферический эффект. Такой аналгетической активностью обладают противовоспалительные средства нестероидного строения (ацетилсалициловая кислота, бутадион, индоме-тацин, ибупрофен, вольтарен, нопроксен, кетопрфон и др.). Анал-гетический эффект салициловой кислоты и других нестероидных препаратов обусловлен блокадой фермента циклооксигеназы; глюкокортикоиды блокируют фосфолипазу А2, следствием чего и является уменьшение образования простагландинов и антибради-кининовая активность (рис. 14). Одновременно с этим снижается проницаемость мембран сосудов, что уменьшает роль механического фактора боли.
Рис. 14 Механизм аналгетического действия ацетилсалициловой кислоты (Харкевич Д.А., 1988)
Учитывая возможную блокаду синтеза простагландинов в ЦНС при воспалении, не исключают и центральное действие ненаркотических аналгетиков (Благоразумова Г.П. с соавт., 1987). Считают, что механизм действия ненаркотических аналгетиков связан с угнетением подкоркового центра в области таламуса, в месте переключения на третий нейрон, а также, как уже говорилось, с их противовоспалительным эффектом (уменьшением проницаемости клеток, сосудов, образования медиаторов, особенно простагландинов). Кортикостероиды, обладая противовоспалительным действием, обеспечивают и аналитический эффект.
Ненаркотические аналгетики эффективны только при невралгических, мышечных, суставных, зубных, головных болях и не оказывают влияние на боль при травме, ожоге, заболеваниях . внутренних органов.
Средства местного обезболивания (местной анестезии) временно устраняют боль за счет местного действия, не нарушая сознания и мышления. Они обладают способностью понижать возбудимость афферентных нервных окончаний и блокируют проведение импульса по нервным волокнам. К местным анестетикам относится анестезин, новокаин, бентаин, ксикаин (лидокаин), тримекаин, пиромикаин, липовокаин, совкаин. Все они подавляют способность генерировать потенциал действия, угнетают ионную проницаемость, тормозят аксональный транспорт белков (Мохорт Н.А., 1986). На уровне синапса местные анестетики тормозят транспорт нейромедиаторов и натрия через мембраны синаптосом и обратный захват норадреналина и холина синапто-сомами.
По другим данным (Авдей Л.В., Данусевич И.К., 1976), местные анестетики вызывают обратимую денатурацию белков, нарушают окислительно-восстановительные процессы в цикле Кребса, тормозят образование медиаторов ацетилхолина и норадреналина.
Кроме того, такие местные анестетики, как дикаин и кокаин являются антагонистами алгогенов типа гистамина и серотонина.
При анализе действия местных анестетиков обнаружено выключение в первую очередь болевой, а затем тактильной, температурной, вкусовой и обонятельной чувствительности.
Местные анестетики разрушаются путем гидролиза, часть инактивируется в печени и только некоторые выделяются в неизмененном виде.
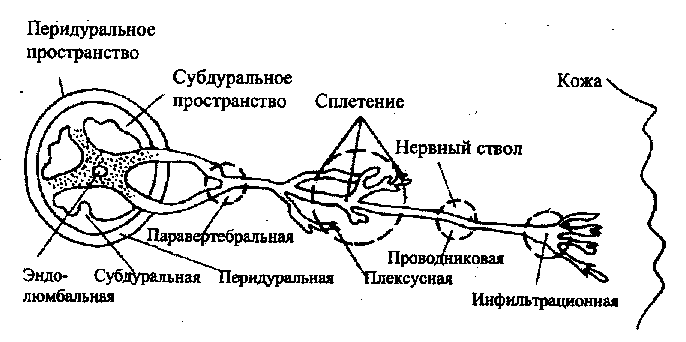
Выделяют поверхностную или терминальную, инфильтрационную, проводниковую, спинно-мозговую местные анестезии. Все они представлены на рисунке 15.
Рис. 15. Виды местной анестезии (Авдей Л.В., Данусевич И.К., 1976)
К средствам комбинированного действия относятся нейролептики (транквилизаторы, анксиолитики, М- и Н-холинолитики, антигистаминные препараты, антидепрессанты), противосудо-рожные средства.
Известно, что боль является сложным психофизиологическим феноменом, для которого характерны психо-эмоциональные изменения. Психотропные средства — транквилизаторы бензодиа-зипинового ряда (дезипрамин, имипрамин, амитриптилин, траза-дон и др.) подавляют эмоциональные проявления боли. Антидепрессанты в дозах, не вызывающих атаксию и миорелаксацию, оказывают неспецифическое болеутоляющее действие. Это сопровождается подавлением эмоций у больных, уменьшением эмоциональной напряженности, особенно в период ожидания боли, изменением психологического отношения к ней. В основе механизма действия антидепрессантов лежит блокада пресинаптического захвата серотонина, норадреналина или обоих нейроме-диаторов, которые потенцируют аналгетическое действие эндорфинов (Пассарелли Ф. с соавт., 1986; Arnoff G., Evans W., 1985).
Согласно последним данным (Valverede О. et al., 1994), три-циклические антидепрессанты осуществляют свое влияние через возбуждение эндогенной опиоидной системы с последующей активацией норадреналин- и серотонинергических лутей. По данным Т.Г.Вознесенской и А.М.Вейн (2000), антидепрессанты стимулируют серотонинергические нисходящие антиноцицептивные влияния или ингйбируют обратный захват серотонина в пресинаптической мембране. Это подтверждается высокой эффективностью антидепрессантов, особенно ингибиторов обратного захвата серотонина при лечении хронической боли (Вейн A.M., 1999).
Антигистаминные препараты вызывают блокаду гистаминовых рецепторов или, разрушая гистамин, уменьшают или полностью прекращают его алгогенное действие.
Учитывая важную роль в функционировании антиноцицеп-ции возбуждения центральных α2-адренорецепторов, становится понятной высокая эффективность использования агонистов α2-адренорецепторов (клофелина, сирдалуда и др.) (Николаев А.В., 2000). Поэтому при лечении хронической боли, в т.ч. у инкурабельных онкологических больных особенно эффективно комплексное использование α2-адреномиметиков с аналгетиками.
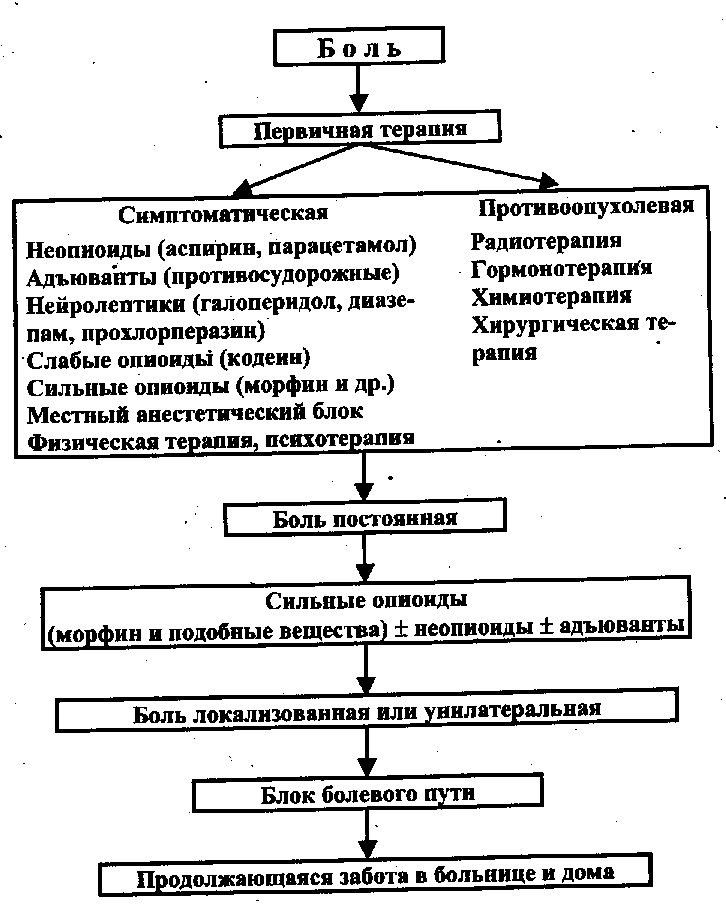
Рис. 16 Схема лечения боли при раке
Выделяют еще так называемую вспомогательную терапию боли (Вейн A.M., 1999). Она включает мероприятия, направленные на ускорение процессов заживления и уменьшения болевой афферентации. К вспомогательной терапии относится использование кортикостероидов, спазмолитиков, миорелаксантов, анти-гипертензивных средств центрального α-адреноблокирующего действия:
Применение вышеуказанных лекарственных средств обеспечивает уменьшение интенсивности воспаления, сосудистой реакции, отечности, уменьшает спазм гладкой мускулатуры и таким образом снижает интенсивность болевой информации.
Наиболее часто врач встречается с хронической болью при раке, особенно у инкурабельных больных. Поэтому Всемирная организация здравоохранения (1986) рекомендует следующую систему лечения боли при раке, схему которой мы приводим ниже (рис. 16).
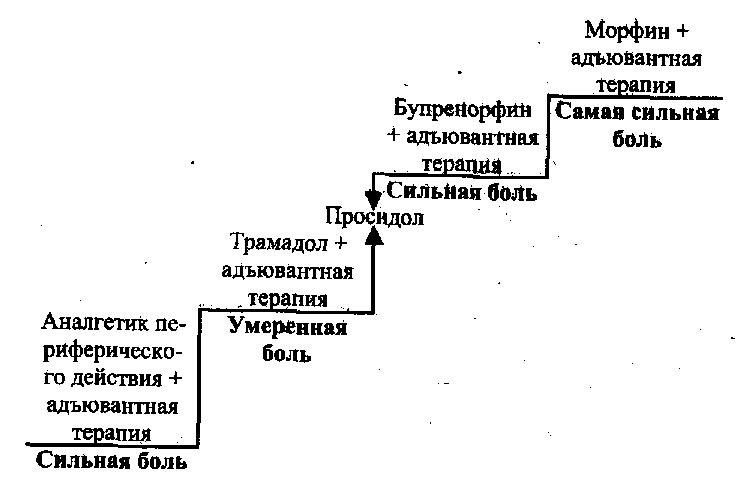
На основании большого личного опыта Н.А.Осипова с соавт. (1998) предлагают схему фармакотерапии хронического болевого синдрома у онкологических больных в зависимости от его интенсивности (рис. 17).
Н.А.Осипова с соавт. (1998) считают, что воздействие на механизмы неопиоидных центральных и периферических нейро-медиаторных систем приводит к более полноценному обезболиванию, чем первичное использование больших доз опиатов. Для этой цели в клинических условиях используются агонисты (α2-адренорецепторов, ГАМК-позитивные факторы, антагонисты кальция, брадикинина, простагландинов и их комбинации. Именно поэтому лечение хронического болевого синдрома и рекомендуется начинать с использования в первую очередь инактивато-ров алгогенов и ненаркотических аналгетиков.
ТЕСТЫ Тесты I уровня
1. Отметьте наиболее характерные проявления боли:
Источник


 Читайте также:
Читайте также: