Научная электронная библиотека
§ 3.1.4. Строение клетки
Размеры клетки широко варьируют от 0,1 мкм (некоторые бактерии) до 155 мм (яйцо страуса). У всех клеток, независимо от их формы, размеров, функциональной нагрузки обнаруживается сходное строение (рис. 3.13).
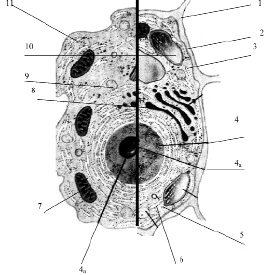
Рис. 3.13. Схема строения живой клетки: 1 – оболочка; 2 – мембрана; 3 – цитоплазма; 4 – ядро; 4а – ядрышко; 5 – рибосомы; 6 – эндоплазматическая сеть (ЭПС); 7 – митохондрии; 8 – комплекс гольджи; 9 – лизосомы; 10 – пластиды; 11 – клеточные включения
Снаружи клетка одета мембраной. Внутренняя часть клетки содержит многочисленные органоиды – структурные образования клетки, выполняющие определенные функции жизнедеятельности клетки.
1. Оболочка. Присутствует только у растительных клеток. Состоит из волокон целлюлозы. Функции оболочки: защита клетки от внешних повреждений, придает стабильную форму клетки, эластичность растительным тканям.
Повреждение наружной оболочки приводит к гибели клетки (цитолиз).
2. Мембрана. Тончайшая структура (75 Ǻ), состоит из двойного слоя молекул липидов и одного слоя белков. Такая структура обеспечивает уникальную эластичность и прочность мембране

Явление фагоцитоза – поглощение клеткой твердых частиц – впервые было описано русским врачом Мечниковым. Фагоцитарная особенность лежит в основе процесса иммунитета. Особенно развита у лейкоцитов, клеток костного мозга, лимфатических узлов, селезенки, надпочечников и гипофиза.
Пиноцитоз – поглощение клеткой растворов – состоит в том, что мельчайшие пузырьки жидкости втягиваются через образующуюся воронку, проникают через мембрану и усваиваются клеткой.
3. Цитоплазма – внутренняя среда клетки. Представляет собой гелеобразную жидкость (коллоидная система), состоит на 80 % из воды, в которой растворены белки, липиды, углеводы, неорганические вещества. Цитоплазма живой клетки находится в постоянном движении (циклоз).




4. Ядро – обязательный органоид эукариотических клеток. Впервые было исследовано и описано Р. Броуном в 1831 г. В молодых клетках расположено в центре клетки, в старых – смещается в сторону. Снаружи ядро окружено мембраной с крупными порами, способными пропускать крупные макромолекулы. Внутри ядро заполнено клеточным соком – кариоплазмой, основная часть ядра заполнена хроматином – ядерным веществом, содержащим ДНК и белок. Перед делением хроматин образует палочковидные хромосомы. Причём, хромосомы одинакового строения (но содержащие разные ДНК!) образуют пары, зрительно воспринимаемые как одно целое (рис. 3.14).
Рис. 3.14. Хромосомный набор человеческой клетки перед началом деления
Структурирование всех хромосом в пары свидетельствует о том, что число хромосом – чётное. Поэтому, его часто обозначают 2n, где n – количество хромосомных пар, а соответствующий набор хромосом называют диплоидным. Например, у голубей n = 40 (80 хромосом), у мухи n = 6 (12 хромосом), у собаки n = 39 (78 хромосом), у аскариды n = 1 (2 хромосомы). У человека n = 23 (46 хромосом). Однако, в половых клетках число хромосом в два раза меньше. Поэтому набор хромосом в половых клетках называется гаплоидным. Клетки, не являющиеся половыми называются соматическими. Иногда клетки с гаплоидным набором хромосом называют гаплоидными клетками, а с диплоидным набором хромосом – диплоидными клетками.
При слиянии двух родительских гаплоидных половых клеток образуется диплоидная клетка, дающая начало новому организму с набором генов отца и матери
Совокупность всех хромосом ядра (а значит и генов) клетки называется генотип. Именно генотип определяет все внешние и внутренние признаки конкретного организма.
В соматических клетках 44 Х-образные хромосомы (22 пары) у женщин и мужчин идентичны (сходны по строению), их называют аутосомами. А 23-я пара имеет конфигурацию ХХ – у женщин и ХY – у мужчин. Эти пары хромосом именуются половыми хромосомами.
В половых клетках 22 хромосомы также одинаковые у яйцеклеток и у сперматозоидов, а 23-я хромосома конфигурации Х – у яйцеклетки и Х или Y – у сперматозоидов. Поэтому при слиянии половых клеток и образовании пар хромосом, 23-я пара будет ( <ХY>или <ХХ>) определять пол будущего ребенка.
Необходимо помнить, что хотя в соматических клетках набор хромосом диплоидный (2n), однако, перед началом деления клеток происходит репликация ДНК, то есть, удвоение их количества, а, значит, и удвоение
количества хромосом. Поэтому перед началом деления соматической клетки в ней насчитывается 4n хромосом (рис. 16). Она становится тетраплоидной.
– хранение генетической информации;
– контроль за всеми процессами, происходящими в клетке: делением, дыханием, питанием и др.
4а. Ядрышко – структура, содержащаяся в ядре. Ядро может содержат 1, 2 или более ядрышек. Функция ядрышка – формирование рибосом.
Следует отметить, что не все клетки имеют оформленное ядро. Клетки, имеющие ядро называются эукариотическими или эукариотами. Клетки, не имеющие ядра, называются прокариотическими или прокариотами. Функции ядра у прокариот несёт одна нить ДНК (именуется хромосома), в которой хранится вся генетическая информация. К прокариотам относятся бактерии и сине-зеленые водоросли. Как правило, у прокариотов отсутствуют и некоторые другие органоиды. Размеры прокариотических клеток меньше, чем размеры эукариот.
5. Рибосомы – самые мелкие органоиды клетки. Были обнаружены в 1954 г. Французским ученым Паладом. Рибосомы были обнаружены в цитоплазме, а также на гранулярной ЭПС и в ядре.
Функция рибосом: обеспечение биосинтеза белка.
6. Эндоплазматическая сеть. Представляет собой каналы и полости, ограниченные мембраной. Различают две разновидности ЭПС: гранулярная ЭПС и агранулярная ЭПС. Гранулярная ЭПС морфологически отличается от агранулярной наличием на ее поверхности многочисленных рибосом (на агранулярной ЭПС рибосомы отсутствуют).
Функции эндоплазматической сети:
– участие в синтезе органических веществ: на гранулярной ЭПС синтезируются белки, на агранулярной – липиды и углеводы;
– транспортировка продуктов синтеза ко всем частям клетки.
Несложно уяснить, что гранулярная ЭПС характерна для клеток, синтезирующих белки (например клетки желез внутренней секреции), агранулярная ЭПС характерна для клеток-производителей углеводов и липидов (например клетки жировой ткани).
7. Митохондрии – крупные органоиды, состоящие из двойного слоя мембран: наружная – гладкая, внутренняя образует многочисленные гребнеобразные складки – кристы. Внутри митохондрии заполнены жидкостью (матрикс).
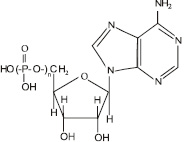
Функции митохондрий: основная функция митохондрий – обеспечение клетки энергией. Этот процесс происходит за счет синтеза аденозинтрифосфорной кислоты (АТФ) (рис. 3.15), в которой фрагмент
Рис. 3.15. Структурная формула аденозинфосфорных кислот. Для аденозинтрифосфорной кислоты n = 3, для аденозиндифосфорной кислоты n = 2, для аденозинмонофосфорной кислоты n = 1
При взаимодействии молекулы аденозинтрифосфорной кислоты с водой отщепляется один остаток фосфорной кислоты, в результате чего образуется аденозиндифосфорная кислота – АДФ и выделяется огромное количество энергии:
АТФ + Н2О = АДФ + Н3РО4 + 10 000 калорий.
Впоследствии от АДФ может отщепляться еще один остаток фосфорной кислоты, образуя АМФ – аденозинмонофосфорную кислоту.
АДФ + Н2О = АМФ + Н3РО4 + 10 000 калорий[37].
Освободившаяся энергия используется для жизнедеятельности клетки (КПД процесса превышает 80 %!).
Наряду с распадом АТФ и выделением энергии в клетке постоянно происходит синтез АТФ и накопление энергии (обратные реакции).
Количество митохондрий в клетке зависит от потребности последней в энергии. Так, в клетках кожи человека находится в среднем 5–6 митохондрий, в клетках мышц – до 1000, в клетках печени – до 2500!
8. Комплекс Гольджи. Итальянский ученый Гольджи обнаружил и описал структуру клетки, напоминающую стопки мембран, цистерны, пузырьки и трубочки. Расположена эта система чаще всего возле ядра.
Функции комплекса Гольджи: в полостях комплекса накапливаются всевозможные продукты обмена клетки, которые по каким-либо причинам не вывелись наружу. В последствии эти продукты могут быть использованы клеткой для процессов жизнедеятельности. Из пузырьков и цистерночек комплекса Гольджи в растительных клетках образуются вакуоли, заполненные клеточным соком.
9. Лизосомы – мелкие органоиды. Представляют собой пузырьки, окруженные мембраной. Внутри лизосомы заполнены пищеварительными ферментами (обнаружено 12 ферментов), которые расщепляют и переваривают крупные макромолекулы (белки, полисахариды, нуклеиновые кислоты).
Функции лизосом: растворение и переваривание макромолекул. Лизосомы участвуют в фагоцитозе. Понятно, что основная функция по перевариванию поступающих в клетку частиц принадлежит лизосомам.
10. Пластиды. Эти органоиды характерны только для растительных клеток. Форма напоминает двояковыпуклую линзу. Структура пластид напоминает таковую у митохондрий: двойной слой мембраны. Наружная – гладкая, внутренняя образует складки, называемые тилакоидами. На тилакоидах происходит основной жизненно важный для всех зеленых растений процесс – фотосинтез:
Пластиды бывают трех типов:
1) Хлоропласты – зеленые пластиды. Их цвет обусловлен наличием хлорофилла. Хлорофилл – основное вещество хлоропластов (имеет зеленый цвет). Только благодаря хлорофиллу возможен процесс фотосинтеза (см. раздел 4.2). Хлоропласты придают зеленый цвет растительным организмам.
2) Хромопласты – пластиды, имеющие различные окраски: от ярко-желтого до пурпурно-багряного. Наличие различных пигментов окрашивают плоды, цветки и осенние листья растений в соответствующие цвета. Этот факт особенно важен для привлечения насекомых к цветкам, как природный индикатор созревания плодов и др.
3) Лейкопласты – бесцветные пластиды, в которых происходит накопление запасных питательных веществ (например, крахмала).
Некоторые виды пластид могут переходить друг в друга: например, переход хлоропластов в хромопласты: созревание томатов, яблок, вишни, и т. д.; изменение окраски листьев в осенний период времени. Лейкопласты могут переходить в хлоропласты: позеленение картофеля на свету. Это доказывает общность происхождения пластид.
11. Клеточные включения. Вакуоли. Это непостоянные и необязательные составляющие клетки. Они могут появляться и исчезать в течение всей жизни клетки. К ним относятся капли жира, зерна крахмала и гликогена, кристаллы щавелево-кислого кальция и др. Жидкие продукты обмена называются клеточным соком и накапливаются они в вакуолях. В клеточном соке растворены сахара, минеральные соли, пигменты и т. д. Чем старше клетка, тем больше клеточного сока накапливает клетка. Молодые клетки практически не содержат вакуолей.
Помимо перечисленного некоторые специализированные клетки обладают специальными органоидами. К ним относятся:
– реснички и жгутики, представляющие собой выросты мембраны клетки, осуществляющие движения клетки. Они имеются у одноклеточных организмов и многоклеточных (кишечный эпителий, сперматозоиды, эпителий дыхательных путей);
– миофибриллы – тонкие нити мышечных клеток, участвующие в сокращении мышц;
– нейрофибриллы – органоиды, характерные для нервных клеток и участвующие в проведении нервных импульсов. Кроме того, в состав клеток входят центриоли – две (иногда более) цилиндрические структуры диаметром около 0,1 мкм и длиной 0,3 мкм. Место расположения центриолей в период между делениями клетки считается серединой клеточного центра. При делении клетки центриоли расходятся в противоположные стороны – к полюсам, определяя ориентацию веретена деления (рис. 16).
Следует иметь в виду, что, хотя животные и растительные клетки имеют много общего, но между ними существуют и серьёзные различия (табл. 3.1).
Более общая классификация клеток представлена на рис. 3.16.
Одно из основных отличий бактерий от архей, состоит в химическом составе мембраны. Бактерии отделены от внешней среды двойным слоем липидов (жиров и жироподобных веществ). Мембраны архей состоят из терпеновых спиртов.
Источник
Медицинские интернет-конференции
Языки
Фагоцитоз и хондроптоз в хряще (дискуссии, поиски, гипотезы) / Phagocytosis and Chondroptosis in a Cartilage (discussions, search, hypotheses)
Бенгус Л.М. / Bengus L.M.
Резюме
В обзоре представлены современные данные литературы о возможности фагоцитоза в хряще. Дана характеристика условий, при которых хондроциты могут трансформироваться в неспециализированные фагоциты. Показано, что гибель хондроцитов может осуществляться не только посредством классического апоптоза, но и путем хондроптоза. В обзор привлечены собственные данные автора.
Ключевые слова
Обзор
ФАГОЦИТОЗ И ХОНДРОПТОЗ В ХРЯЩЕ (дискуссии, поиски, гипотезы) БЕНГУС Л.М. ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко НАМН Украины», г. Харьков, Украина PHAGOCYTOSIS AND CHONDROPTOSIS IN A CARTILAGE (discussions, search, hypotheses) BENGUS L.M. Sitenko Institute of Spine and Joint Pathology, Ukraine Academy of medical science, Kharkov, Ukraine
Современные представления о структуре хрящевой ткани базируются на главном постулате, который гласит, что суставной хрящ является аваскулярной структурой, клеточный состав его представлен хондробластами (слабо дифференцированными хрящевыми клетками) и хондроцитами (дифференцированными хрящевыми клетками, специализированными в отношении биосинтеза и секреции компонентов хрящевого матрикса).
Однако развитие современной науки позволяет открывать неизвестные и малоизвестные страницы в «судьбе» хряща. В хряще не имеется доказательства присутствия «профессиональных фагоцитов» – моноцит-производных макрофагов и нейтрофилов. Различные исследователи [1‒3] показали возможность неспециализированных в отношении фагоцитоза клеток ‒ фибробластов, гломерулярных мезангиальных клеток, эндотелиальных клеток и даже хондроцитов приобретать способность к фагоцитозу апоптотических клеток in vivo [1], при отсутствии коммитированных макрофагов. С помощью флюоресцентной микроскопии и микроскопического видеонаблюдения было показано, что культивированные клетки студенистого ядра, выделенные из каудальных межпозвонковых дисков быка [4,5], фагоцитировали добавленные в культуральную среду частицы латекса. Отмечено, что клетки студенистого ядра фагоцитировали большее количество частиц латекса, чем со-культивируемые специализированные фагоциты. Возможно, это обусловлено их большими размерами, чем таковые у коммитированных фагоцитов. Кроме того, при совместном культивировании в монослойной культуре хондроцитов диска и опухолевых клеток HeLa с ультрафиолет-индуцированным апоптозом хондроциты студенистого ядра приобретали способность фагоцитировать апоптотические клетки.
На основании этого авторы делают вывод о том, что апоптотические клетки диска, присутствующие в нем in vivo на этапах его дегенерации и в грыжах диска, посылают сигналы посредством экспрессии рецепторов фагоцитоза, которые стимулируют процессы фагоцитоза в жизнеспособных хондроцитах диска. В англоязычной научной литературе эти сигналы, посылаемые апоптотическими клетками, образно называют «eat me» – «съешь меня». Они включают карбогидратные изменения поверхности апоптотических клеток, активацию на ней тромбоспондин- и фосфатидилсерин-связывающих участков [1]. Известно, что в дегенеративно измененном межпозвонковом диске и суставном хряще хондроциты нередко формируют кластеры, которые содержат клетки в разных функциональных состояниях. В связи с этим, становится понятным способ воздействия апоптотических клеток на жизнеспособные клетки с помощью цитокинов, и обусловленная этим трансформация биосинтеза и фенотипа хондроцитов, переключающих свой метаболизм с хондропластического на хондрокластический. У коммитированных фагоцитов триггером фагоцитоза является молекула фосфатидилсерина, экспрессирующегося на наружной мембране апоптотических клеток. Фосфатидилсерин связывается с рецепторами клеточной гибели (CD14, CD36, CD68). Молекулярный каскад, имеющий место у факультативных фагоцитов, к которым относятся хондроциты межпозвонкового диска и суставного хряща, изучен недостаточно [2, 6].
Существует мнение, что важную роль в активизации факультативных фагоцитов и вовлечении их в фагоцитоз апоптотических клеток играют лектины [1]. В исследованиях [4, 7] были получены убедительные доказательства того, что клетки студенистого ядра диска могут вести себя как фагоциты и при соответствующих условиях подвергаться фагоцитозу (апоптотические хондроциты). Клетки студенистого ядра межпозвонкового диска людей с дегенерацией диска (но без наличия грыжи) имеют положительную иммуногистохимическую окраску на гликопротеин CD68 (Cluster of Differentiation-68) [7], который является маркером моноцитов и макрофагов [8]. Эти клетки не являются специализированными макрофагами или моноцитами, которые внедрились в диск, но они представляют собой трансформированные резидентные клетки, которые могут вовлекаться в процесс фагоцитоза внеклеточного матрикса. Хондроциты других хрящевых тканей, например, суставного [3] или эпифизарного хряща [9] также могут становиться факультативными фагоцитами. Суспензия хондроцитов из суставного хряща коленного сустава была культивирована для оценки фагоцитоза латексных частиц, размером 1 мм, детрита суставного хряща, некротических и апоптотических остатков клеток (размером 1 мк). С помощью конфокальной микроскопии и жидкостной цитометрии было выявлено, что хондроциты фагоцитировали частицы латекса. Методами светлопольной и трансмиссионной электронной микроскопии было установлено, что хондроциты суставного хряща in vitro фагоцитировали тканевой детрит и клетки с вепезид-16-индуцированным (VP-16 – индуктор апоптоза раковых клеток) апоптозом и некрозом [3].
Таким образом, было доказано наличие у хондроцитов способности к фагоцитозу, что подтверждает идею о том, что фагоцитоз, осуществляемый хондроцитами, расположенными вблизи погибших клеток, возможен, но это явление очень редкое. В суставном хряще и межпозвонковых дисках человека механизм активации фагоцитарных и аутолитических свойств у хондроцитов необходим для удаления апоптотических клеток, количество которых неуклонно растет с возрастом.
В тех случаях, когда собственных резервов хондроцитов, специализирующихся на элиминации погибших путем апоптоза клеток, недостаточно, имеет место активизация вторичного некроза с последующим повреждением клеточного микроокружения [10], что, по-видимому, стимулирует воспалительную реакцию в прилежащих тканях. Повышение частоты и темпов апоптоза хондроцитов, их способность при необходимости трансформироваться в факультативные фагоциты, а также активизация воспалительной реакции в ответ на вторичный некроз являются важными элементами проявления адаптационно-компенсаторных механизмов организма в ответ на дегенерацию хряща.
В последние годы стали накапливаться доказательства того, что программируемая гибель клеток не всегда проявляется как классический апоптоз [9, 11, 12]. Оказалось, что клетки имеют различные пути, с помощью которых они подвергаются гибели (табл. 1), и эти пути характеризуются различной морфологией. Таблица 1. Варианты гибели клеток по J.B. Kouri [11] И хотя апоптоз культивированных хондроцитов имеет характерные классические морфологические и биохимические признаки (сжатие и сморщивание клетки, конденсация хроматина и вовлечение каскада каспаз) [13], такие клетки очень редко встречаются в хряще in vivo. Была сделана попытка установить морфологические различия между способом гибели хондроцитов и классическим апоптозом клеток. С этой целью был предложен термин «хондроптоз» [9, 11, 12] для характеристики другого ‒ не классического апоптоза хондроцитов суставного и эпифизарного хряща, который является специфической формой программируемой гибели хондроцитов in vivo.
В отличие от классического апоптоза, у хондроцитов, вставших на путь «хондроптоза», вначале происходит гиперплазия комплекса Гольджи и мембран эндоплазматической сети (ЭПС), что отражает усиление синтеза белка. Но при этом в хондроцитах, очевидно, синтезируются не белки хрящевого матрикса, а протеолитические ферменты. Гиперплазированные мембраны ЭПС сегментируют цитоплазму и способствуют образованию компартментов клетки, внутри которых происходит ферментативное расщепление цитоплазмы и органелл хондроцита. Имеет место деструкция материала внутри аутофагосом, присутствуют остаточные тельца, а в хрящевых лакунах выявляются клеточные остатки в виде пузырьков. Вместе взятые эти процессы приводят к полной самодеструкции хондроцита, на что указывает присутствие в хряще пустых лакун.
Полагают, что ЭПС-зависимый путь апоптоза играет более значительную роль в хондроптозе, чем рецептор-опосредованный или митохондриальный пути и что лизосомальные протеазы так же важны для клеточной гибели, как и каспазы. В связи с тем, что хондроптоз не зависит от фагоцитоза, он может быть более предпочтительным in vivo, где хондроциты изолированы внутри своих лакун. Однако инициирующие факторы и молекулярные пути, вовлекающие хондроциты в хондроптоз, пока остаются неясными. При электронно-микроскопическом исследовании глубокой зоны эпифизарного хряща кроликов не было обнаружено признаков апоптоза хондроцитов, хотя такие клетки были обнаружены in vitro. Вместо этого были выявлены электронно-плотные хондроциты с лопастным ядром, очаговой конденсацией хроматина и темной цитоплазмой с обильным количеством канальцев ЭПС [14]. Эти клетки авторы назвали «темными хондроцитами».
Детальное исследование их ультраструктуры в сочетании с иммуно-гистохимическими методами показало наличие другого механизма программируемой гибели этих клеток. Кроме того, в незрелых хондроцитах хрящевых эпифизов также были идентифицированы другие типы гибели клеток. Эти клетки имели такие же ядра как у «темных хондроцитов», канальцы ЭПС были расширены и заполняли все внеядерное пространство клетки, при этом другие органеллы были редуцированы, а цитоплазма содержала плотные извитые включения. Эти клетки авторы назвали ослабленными или «парализованными». Было сделано предположение, что «темные хондроциты» и «парализованные» клетки являются примером физиологической гибели клеток, отличной от апоптоза. Учитывая то, что фагоцитоз апоптотических телец хондроцитов, заключенных в свои лакуны, явление редкое, необходим другой механизм их элиминации [14]. В исследованиях R.A. González-Polo и соавт. (2005) [15] было доказано, что митохондриально-зависимой активации каспаз и апоптотическим изменениям ядра предшествует аутофагическая вакуолизация цитоплазмы.
Это объединило два типа клеточной гибели: 1-й тип ‒ классический апоптоз и 2-й тип, характеризующийся аккумуляцией аутофагических вакуолей в цитоплазме [10, 16‒18]. При остеоартрозе хондроциты суставного хряща содержат вакуоли с поглощенными небольшими частицами и волокнами (продуктами деструкции матрикса), что может быть связано с фагоцитозом хондроцитов. При сравнении остеартрозного суставного хряща человека и крыс (на поздней стадии экспериментального остеоартроза) были получены сходные результаты, которые впоследствии были дополнены ультраструктурными и иммуногистохимическими наблюдениями. Исследования были направлены на выяснение роли комплекса Гольджи, который играет важную роль в процессе апоптоза хондроцитов при остеоартрозе. Однако особенности влияния комплекса Гольджи на апоптоз в суставном хряще человека при остеоартрозе не установлены. При оценке интенсивности метки белка-58К (Golgi 58K protein) ‒ иммунологического маркера комплекса Гольджи, и маркеров апоптоза (TUNEL и каспаза-2L) в суставном хряще больных остеоартрозом после тотальной артропластики колена было обнаружено значительное усиление метки Гольджи-белка в хондроцитах.
Иммуногистохимический анализ показал со-локализацию белка комплекса Гольджи 58К и каспазы-2L, что свидетельствует о том, что данный фермент присутствует в комплексе Гольджи хондроцитов при остеоартрозе. Это подтвердило роль комплекса Гольджи в апоптозе, и то, что индуцирующие апоптоз каспазы локализуются в комплексе Гольджи. Кроме того, было обнаружено множество TUNEL-положительных хондроцитов, но при этом имели место различные соотношения клеток в плане каспазы-2L. Эти данные подтвердили ранее предложенную концепцию о том, что апоптоз в хряще при остеоартрозе (хондроптоз) может являться вариантом классического апоптоза [12]. Эти результаты согласуются с данными H.I. Roach (2004) [9] об участии комплекса Гольджи в гибели хондроцитов путем хондроптоза. Изменение хрящевых клеток при остеоартрозе связано с нарушением метаболизма хондроцитов ‒ подавлением биосинтеза протеогликанов и коллагена и повышением продукции молекул, деградирующих хрящевой матрикс (матриксных металлопротеиназ, в частности – ММР-13), превышающим биосинтез ингибиторов протеаз [19, 20].
Удаление апоптотически измененных хондроцитов при остеоартрозе происходит с помощью как апоптотических, так и не апоптотических сигналов [21]. Была сделана попытка установить последовательность событий, которые имеют место в процессе элиминации хондроцитов при остеоартрозе. С этой целью у животных с моделью остеоартроза была проведена идентификация апоптоза (иммуногистохимическими методами по определению активности каспаз и с помощью TUNEL-метки) и аутофагии (с помощью маркеров аутофагии ‒ LC3II ‒ легкая цепь связанного с микротрубочками белка, и маркеров цитоплазматической вакуолизации).
Была показана модификация процесса гибели хондроцитов в разных зонах хряща. На ранней стадии остеоартроза гибель хондроцитов начиналась с апоптоза в поверхностной и части промежуточной зоны хряща, вероятно, как следствие постоянной механической травматизации сустава. С течением дегенеративного процесса в хондроцитах тех же зон суставного хряща была обнаружена высокая частота активации каспазы-3 и LC3II-экспрессия, что указывало на комбинацию двух процессов гибели клеток – апоптоза и аутофагии. В глубокой зоне хряща, на фоне аномальной оссификации субхондральной кости, имеющей место при остеоартрозе, наблюдался только апоптоз.
В наших исследованиях при изучении ультраструктурной организации суставного хряща у животных с экспериментальным глюкокортикоид-индуцированным остеоартрозом [22, 23] мы наблюдали активизацию апоптоза хондроцитов (рис. 1), что было подтверждено методом трансмиссионной электронной микроскопии. В таких хондроцитах выявлялась значительная гетерохроматизация и нередко фрагментация клеточного ядра. При этом в цитоплазме хондроцитов обнаруживалось обилие вакуолей.
В других клетках на фоне лопастного гетерохромного ядра в цитоплазме определялись гипертрофированная ЭПС и комплекс Гольджи, что соответствует морфологическим признакам хондроптоза (рис. 2). Изредка вблизи апоптотически измененного хондроцита (в одной хрящевой лакуне) мы обнаруживали другой хондроцит с признаками активизации фагоцитоза (рис. 3). Такие хондроциты имели гипертрофированные удлиненные клеточные отростки, которые были направлены в сторону расположенной поблизости погибшей клетки. Ядро таких клеток было преимущественно лопастным с высокой долей гетерохроматина. Нередко такой хондроцит содержал в цитоплазме крупную фагосому с деструктивно измененным хрящевым матриксом либо погибшим хондроцитом, на что указывало присутствие в фагоцитированной клетке клеточных отростков, остаточных телец и фрагментов мембранных органелл. При этом в цитоплазме фагоцитирующего хондроцита сохранялась достаточно хорошо развитая агранулярная ЭПС.
Согласно характеристике клеточной гибели у хондроцитов in vivo [9, 11, 12] наличие в цитоплазме развитой ЭПС, на фоне активизации фагоцитарной активности клетки, является одной из стадий хондроптоза. Т.е., фагоцитирующие хондроциты, по-видимому, с одной стороны, участвуют в процессе очищения матрикса от продуктов тканевого и клеточного детрита, а с другой стороны, они сами уже находятся на начальной стадии гибели клетки. Изредка мы обнаруживали в промежуточной зоне суставного хряща клетки с нетипичной для хрящевой ткани ультраструктурой. Эти клетки были отростчатые, по форме напоминали фибробласты, но их цитоплазма содержала многочисленные вариабельные по размерам вторичные лизосомы. Кроме того, некоторые из этих клеток содержали 2-3 ядра.
Ультраструктура таких клеток дает нам повод сделать предположение о том, что они являются клетками с кластическими функциями, которые можно отнести к хондрокластам (при наличии нескольких ядер), либо к факультативным макрофагам (при выраженной фагоцитарной активности). Следует отметить, что вопрос утилизации погибших путем апоптоза хондроцитов в настоящее время в научной литературе является слабо освещенным. Некоторые авторы считают, что образовавшиеся в процессе апоптоза апоптотические тельца подвергаются дальнейшей деградации в хрящевом матриксе, а продукты их распада могут поступать путем диффузии в полость сустава, вызывая, таким образом, асептическое воспаление и индуцируя остеоартроз [24].
На основании наших наблюдений мы можем предположить, что в суставном хряще имеется и другой путь утилизации погибших путем апоптоза клеток и продуктов их распада. Этот путь связан с передачей сигнала от апоптотически погибшего хондроцита к жизнеспособному хондроциту, расположенному в пределах одной с ним лакуны, либо в кластере хондроцитов, либо (при отсутствии таковых) ‒ в территориальном или интертерриториальном матриксе. Погибшая клетка индуцирует сигнал о необходимости переключения метаболизма жизнеспособного хондроцита с хондропластического на хондрокластический. Необходимо отметить, что данный механизм активизируется в патологических ситуациях, связанных с массовой гибелью хондроцитов (при активизации патологического апоптоза), и, возможно – в процессе хондрогенеза. В интактном суставном хряще его проявления слабо выражены в связи с редкими случаями физиологической гибели хондроцитов. Учитывая имеющиеся в современной литературе данные о возможности передвижения хондроцитов в хрящевом матриксе [25] становится понятным, каким образом хрящевые клетки, расположенные на расстоянии друг от друга и не контактирующие своими отростками, могут взаимодействовать, обмениваться сигнальными молекулами и регулировать свой метаболизм, с целью компенсации структурных и функциональных нарушений. Следует отметить, что для обеспечения передвижения хондроцитов в хрящевом матриксе цитоплазма этих клеток содержит цитоскелет, который (при активизации движения клетки, митотическом делении либо на фоне инволютивных изменений) может быть гипертрофированным. Движение хондроцитов обеспечивается массовым сокращением микрофиламентов, а направление движения определяется наличием погибшей клетки и соответствующей ориентацией микротрубочек.
Выводы:
1. Доказано наличие у хондроцитов способности к фагоцитозу. Фагоцитоз, осуществляемый хондроцитами, расположенными вблизи погибших клеток, возможен, но встречается редко.
2. Хондроциты являются не специализированными, а факультативными макрофагами. В этом случае они представляют собой трансформированные резидентные клетки, способные вовлекаться в процесс фагоцитоза внеклеточного матрикса и погибших клеток.
3. В суставном хряще и межпозвонковых дисках человека и животных механизм активации фагоцитарных и аутолитических свойств у хондроцитов необходим для элиминации апоптотических клеток.
4. Апоптоз хондроцитов in vivo – хондроптоз, сопровождается гиперплазией эндоплазматической сети, комплекса Гольджи и обилием аутофагических вакуолей в цитоплазме хондроцитов.
5. Комплекс Гольджи играет важную роль в процессе апоптоза хондроцитов при остеоартрозе. Иммуногистохимически доказано, что индуцирующие апоптоз каспазы локализуются в комплексе Гольджи. Апоптоз в хряще при остеоартрозе (хондроптоз) является вариантом классического апоптоза.
6. При прогрессировании дегенеративного процесса в хондроцитах на фоне остеоартроза имеет место комбинация двух процессов гибели клеток – апоптоза и аутофагии.
Подписи к рисункам
Рис. 1. Модель глюкокортикоид-индуцированного остеоартроза. Апоптоз хондроцита промежуточной зоны суставного хряща. Выраженная гетерохроматизация ядра (стрелка) и вакуолизация цитоплазмы (две стрелки). Контрастирование по Рейнольдсу. Увеличение — х4500. Электронограмма Бенгус Л.М.
Рис. 2. Модель глюкокортикоид-индуцированного остеоартроза. Изогенная группа из двух хондроцитов промежуточной зоны суставного хряща. Снизу – хондроптоз хондроцита. Интенсивно гетерохроматизированное лопастное ядро (стрелка). Гипертрофия комплекса Гольджи – обилие секреторных пузырьков (две стрелки). Агранулярная ЭПС (двойная стрелка). Контрастирование по Рейнольдсу. Увеличение — х8000. Электронограмма Бенгус Л.М.
Рис. 3. Суставной хрящ крысы с глюкокортикоид-индуцированным остеоартрозом. Изогенная группа из 2-х хондроцитов. Сверху – погибший хондроцит (стрелка). Снизу – фагоцитирующий хондроцит. Множество канальцев агранулярной ЭПС (двойная горизонтальная стрелка) и комплекс Гольджи (две стрелки) в цитоплазме хондроцита. Большая фагосома с клеточным детритом (двойная вертикальная стрелка). Экзоцитоз содержимого остаточного тельца (угловая стрелка). Контрастирование по Рейнольдсу. Увеличение — х8000. Электронограмма Бенгус Л.М.
Источник