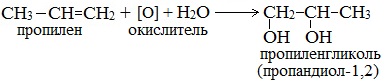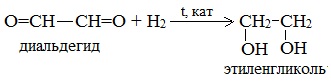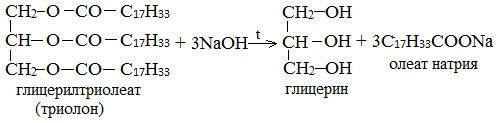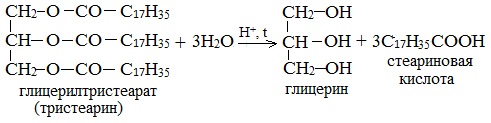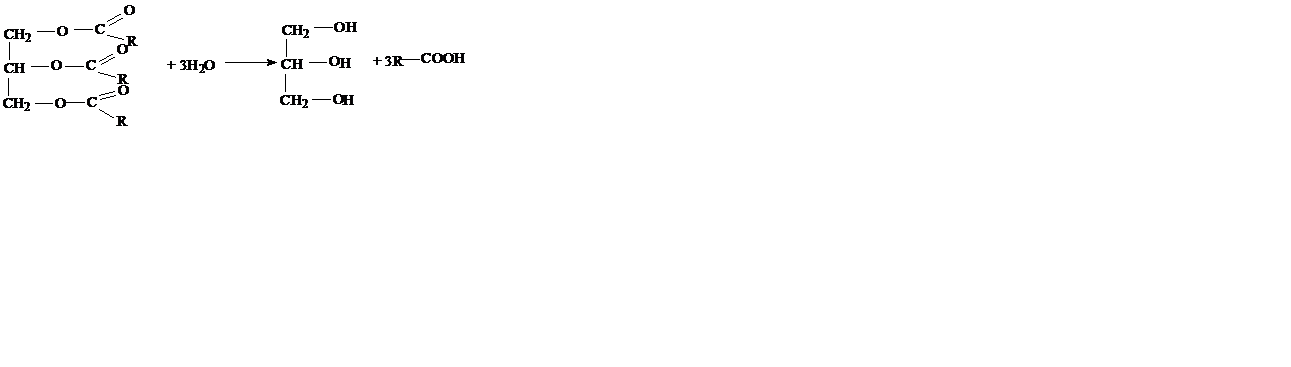Урок 20. Многоатомные спирты
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у разных атомов углерода:
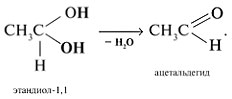
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
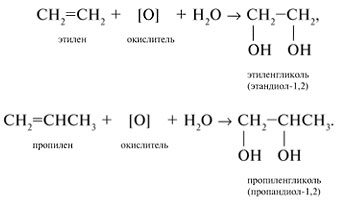
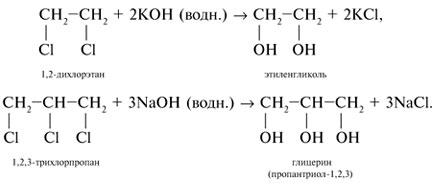
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
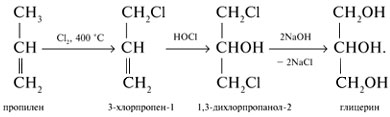
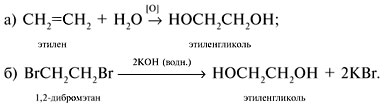
Получение



Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. 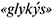
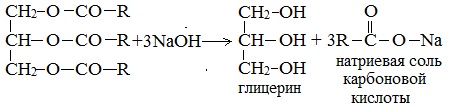
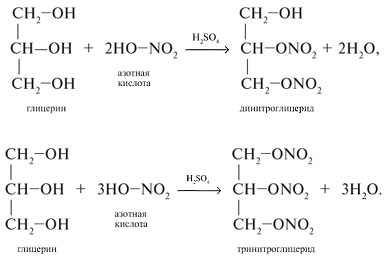
Химические свойства
Этиленгликоль и глицерин подобны одноатомным спиртам.




 | ||||||||||
2C6H5OH + 2Na  | 2C6H5ONa | + H2 |
| фенолят натрия |
C6H5OH + NaOH 
Однако кислотные свойства фенола выражены слабее, чем у карбоновыхкислот и, тем более, у сильных неорганических.
Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной 
а) Реакция с бромной водой (качественная реакция):
 | + 3Br2  |  | + 3HBr |
Образуется 2,4,6-трибромфенол — осадок белого цвета.
б) Нитрование (при комнатной температуре):
 | + 3HNO3(конц.)  3H2O + 3H2O + |  |
2,4,6-тринитрофенол (пикриновая кислота)
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
4. Поверхностно-активных веществ
7. Взрывчатых веществ
Вопросы для самоконтроля:
1.Дать понятие гомологического ряда алканолов
2. Првести примеры изомеров этилового спирта
3. Охарактеризовать физические свойства этанола
4. Охарактеризовать химические свойства этанола
5. Привести способы получение этанола
6. Каковы области применения этанола?
7. Привести примеры представителей многоатомных спиртов.
8. Какими физическими и химическими свойства обладают многоатомные спирты?
9. Дать определение фенолам.
10.Какие физические и химические свойства характерны для фенолов?
Задания для самостоятельного выполнения:
1. Какие вещества называются спиртами?
2. Продолжите определение: Фенолы – это производные ароматических углеводородов, в молекулах которых ___________________________
3. Запишите определения:
Функциональная группа — Предельные одноатомные спирты —
Многоатомные спирты — Водородная связь —
4. Напишите структурные формулы всех изомерных спиртов состава C4H9OH. Назовите эти спирты.
5. Объясните, почему в классе спиртов нет газообразных веществ?
6. Изобразите схему образования водородной связи между молекулами:
а) воды б) спирта в) воды и спирта
7. Напишите структурные формулы изомерных ароматических соединений состава C7H8O и назовите их. Укажите, к каким классам органических соединений они относятся.
8. Перечислите химические свойства фенолов, обусловленные гидроксильной группой (А) и бензольным ядром (Б). Приведите примеры химических реакций.
9. С какими из перечисленных веществ будут реагировать фенол и метанол: 1) HBr, 2) Na, 3) NaOH? Напишите уравнения реакций.
10. Как с помощью качественных реакций различить водные растворы фенола, этанола, и глицерина. Приведите план распознавания веществ и напишите уравнения реакций.
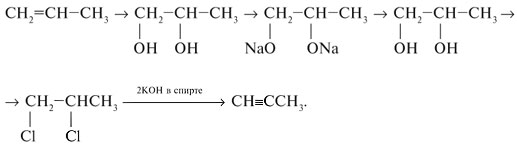
11. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения, укажите условия реакций и назовите вещества, участвующие в реакциях:
Расчетные задачи:
1. При действии на раствор фенола в воде массой 400г избытком брома выпал осадок массой 3,31г. Вычислить массовую долю фенола в первоначальном растворе.
2. Какую массу этилата натрия можно получить во время взаимодействия этанола массой 11,5г с натрием массой 9,2г.14.
3. Рассчитайте массу алкоголята натрия, полученного при взаимодействии металлического натрия массой 4,6г с абсолютным этанолом объемом 40 мл (плотность 0,79 г/мл).
4. Массовые доли углерода, водорода и кислорода в веществе равны соответственно 40%, 6,67% и 53,33%. Плотность паров этого вещества по водороду равна 30. Установите молекулярную формулу вещества.
Тестирование по теме «Спирты, фенолы».
1. Выберите формулу этанола:
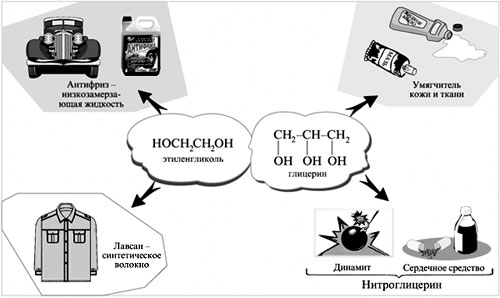
2. Укажите, с какой целью используют глицерин для обработки шкуры:
А) способствует высыханию;
Б) для смягчения и придания эластичности;
В) предотвращает размножению бактерий;
Г) хорошо растворимый в воде.
3. Укажите вещества, которые взаимодействуют между собой:
4. Расположите вещества в ряд увеличения кислотных свойств:
А) глицерин; Б) этанол;
В) этиленгликоль; Г) уксусная кислота.
5. Укажите вещество, которым необходимо подействовать на хлорбензол, чтобы образовался фенол:
А) водород; Б) натрий гидроксид;
В) натрий хлорид; Г) нитратная кислота.
6. Установите генетическую цепочку образования фенола:
А) С2Н2; Б) С6Н6; В) СН4; Г) С6Н5Сl.
7. Составьте уравнения реакций по данной схеме:
Источник

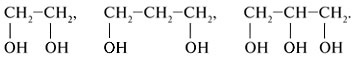
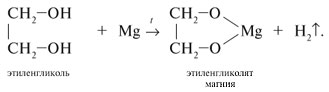
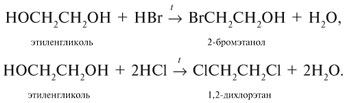
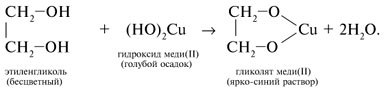
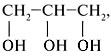
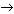 моногалогенуглеводород
моногалогенуглеводород 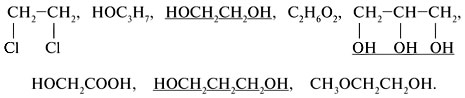
 С(О)O–]n;
С(О)O–]n; 
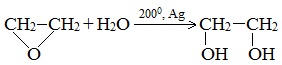

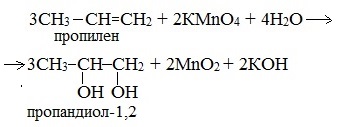 Упрощенно
Упрощенно