- Этилен
- Характеристики и физические свойства этилена
- Получение этилена
- Химические свойства этилена
- Применение этилена
- Примеры решения задач
- Промышленные способы получения этилена
- Этилен (этен), получение, свойства, химические реакции
- Электронное и пространственное строение молекулы
- Видео
- Получение
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Получение этилена
- Примеры решения задач
- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
Этилен
Характеристики и физические свойства этилена
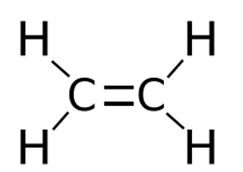
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400 o С, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
| Задание | Осуществите ряд превращений: |
этан → этен → этанол → этен → хлорэтан → бутан.
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? |
| Решение | Запишем в общем виде уравнения бромирования и гидрирования алкена: |
Рассчитаем количество вещества водорода:
n(H2) = 6,72 / 22,4 = 0,3 моль,
следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна:
что соответствует формуле C4H8.
Найдем массу брома:
M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль;
m(MnO2) = 0,3 × 160 = 48 г.
Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4).
Источник
Промышленные способы получения этилена
В настоящее время этилен является важным техническим сырьем не только как исходный продукт для производства полимеров, обладающих рядом ценных свойств, благодаря которым эти полимеры во все большем и большем количестве применяются в электротехнике и других областях промышленности, но этилен является также основным сырьем для производства стирола, окиси этилена и других соединений.
Кроме газов крекинга, которые получаются только лишь в местах переработки нефти, за последние годы стало широко развиваться планомерное производство этилена и из других видов сырья. Сырьем для производства этилена является этиловый спирт, природный газ или выделенная из него этановая фракция, а в последнее время — ацетилен.
Дегидратация этилового спирта с помощью серной кислоты была уже давно отвергнута промышленностью и заменена каталитической дегидратацией. В качестве катализатора дегидратации этилового спирта обычно применяется окись алюминия, рабочая температура реакции находится в пределах 250—400°. Процесс проводится в реакторе, снабженном рубашкой для обогрева. Обогрев производится парами ртути. Газ, выходящий из реактора, охлаждается, компримируется, сушится и подвергается низкотемпературной ректификации. В результате получается весьма чистый этилен. При дегидратации спирта в производстве бутадиена по Лебедеву этилен получается в качестве побочного продукта с выходом около 5—8%. Этот этилен, так же как и этилен, полученный предыдущим способом, вполне пригоден для полимеризации, поскольку он не содержит прерывающих ее примесей. Необходимо только этилен, получающийся в производстве бутадиена по способу Лебедева, очистить вымораживанием от содержащегося в нем ацетальдегида, поскольку последний препятствует полимеризации.
Из ацетилена этилен получается путем частичного гидрирования при атмосферном или слегка повышенном давлении. Исходный ацетилен не должен содержать примеси, отравляющие катализатор. Перед переработкой ацетилен подвергается очистке на промывных установках, орошаемых хлорной водой, затем промывается разбавленным раствором щелочи и сушится. Водород также не должен содержать контактных ядов. Реакторы гидрирования, соединенные в батареи, имеют внутри решетки, на которых размещается катализатор, палладий на двуокиси кремния. Сначала смесь ацетилена и водорода нагревают до 200°; в процессе гидрирования температура в реакторах поддерживается в пределах 180— 230° за счет тепла реакции и регулируется орошением катализатора водой. С постепенным старением катализатора реактор по мере надобности нагревают дымовыми газами. Выходящий из реактора газ имеет следующий состав: 80 объем. % паров и 20 объем. % газа, содержащего 50—60% этилена, 3% этана, 3% азота, 0,8% ацетилена и около 30% водорода. После охлаждения и отделения воды сырой этилен сжижают в разделителе Линде и подвергают низкотемпературной фракционированной дистилляции. Очищенный продукт содержит 94—96% этилена, 3—4% этана, приблизительно 1% азота и около 0,5% ацетилена. Этилен, получаемый из ацетилена, для полимеризации не годится. Он применяется для производства стирола.
При производстве этилена из этан-пропановой фракции смесь обоих углеводородов, к которой прибавляют небольшое количество водяного пара, подвергают кратковременному действию температуры 750—800°. Реакционную смесь быстро охлаждают, газы компримируют, отделяют от воды и подвергают низкотемпературной ректификации. На аналогичном принципе основано производство этилена путем высокотемпературного дегидрирования этана (температура около 900°). Этот процесс проводится при давлении 0,5 атм; этан подается на дегидрирование в смеси с азотом. Процесс проводится в реакторе из специальной хромистой стали (20—30% хрома) с содержанием никеля менее 0,2%, так как последний способствует побочным реакциям и образованию углерода. Примесь кремния оказывает противоположное действие. Газ, выходящий из реактора, содержит около 33% этилена, небольшое количество ароматических углеводородов и около 0,3% ацетилена, который получается в результате дальнейшего дегидрирования этилена. Путем охлаждения ацетилен освобождают от примесей смолистых веществ и подвергают гидрированию при температуре 180—230°, превращая его практически количественно в этилен. Катализатором этого процесса служит металлический никель (5%) на окиси хрома (95%). Сырой этилен пропускают через абсорберы, заполненные активированным углем, в которых задерживаются ароматические углеводороды. Окончательная очистка этилена заключается в абсорбции его раствором хлорида меди (I) при 15 атм. Содержащиеся в газе олефины отделяются постепенным снижением давления до 3—1,4; 1—0,35; 0,1 атм. Газы, отделенные в результате первого и второго снижения давления, содержат гомологи этилена, и их возвращают на абсорбцию. Этим способом получается не менее 96% этилена с выходом не менее 79—80% от теоретического, считая на этан.
Другим способом производства этилена является частичное окисление этана воздухом или кислородом при температуре 800—850°. Оба газа прежде всего нагревают: этан до 650°, кислород до 550°, а затем смешивают в отношении 3:1 в небольшой камере смешения, откуда с большой скоростью подают в основной аппарат — камеру сжигания. Камера сжигания заполнена кольцами Рашига, чтобы смешение газов было наилучшим. Благодаря короткому времени контактирования снижается образование углерода и формальдегида. Отходящий из камеры сжигания газ, который содержит примерно 33 объем. % этилена, 26,3% водорода, 14,1% этана, 11,5% окиси углерода, 7,6% метана, 4,2% азота, 1,1% пропана, 0,7% углекислого газа и 0,6% кислорода, охлаждают водой, сушат и после сжижения подвергают с целью очистки низкотемпературной дистилляции на разделителе Линде. Регенерированный этан вновь возвращают на переработку. Выход этилена по этому методу составляет 80% от теоретического.
Этилен для производства полиэтилена должен быть исключительно чистым: в нем не должны находиться его гомологи и ацетилен, которые отрицательно влияют на свойства полимера. Для отделения этилена от остальных углеводородов и для его очистки был предложен целый ряд физических и химических способов. Все эти способы основаны как на различной растворимости олефинов и других ненасыщенных углеводородов в определенных растворителях, так и на их высокой реакционной способности. Из физических методов рекомендуются следующие: экстракция селективными растворителями, адсорбция веществами, обладающими большой поверхностью, чаще всего активированным углем, и наконец, низкотемпературная фракционированная дистилляция газообразного или сжиженного продукта при повышенном, атмосферном или пониженном давлении. К химическим способам разделения и очистки олефинов относится абсорбция разбавленной серной кислотой, реагирующей с гомологами этилена, диолефинами и ароматическими углеводородами обычно быстрее, нежели с этиленом. К этим способам относится также абсорбция другими химическими реагентами, например, аммиачным раствором хлористой меди, с которой этилен образует комплексное соединение, быстро разлагающееся при повышенной температуре, пониженном давлении или при комбинации обоих условий.
Источник
Этилен (этен), получение, свойства, химические реакции
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sp 2 —гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Видео
Получение
- Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
- Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
- На производстве этилен получают из природного газа и при процессах пиролиза нефти.
- Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
- При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Примеры решения задач
Задание Осуществите ряд превращений: этан → этен → этанол → этен → хлорэтан → бутан. Решение Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl.
Задание Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? Решение Запишем в общем виде уравнения бромирования и гидрирования алкена: CnH2n + Br2 = CnH2nBr2 (1); CnH2n + H2 = CnH2n+2 (2). Рассчитаем количество вещества водорода: n = V / Vm; n(H2) = V(H2) / Vm; n(H2) = 6,72 / 22,4 = 0,3 моль, следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 16,8 / 0,3 = 56 г/моль, что соответствует формуле C4H8. Согласно уравнению (1) n(CnH2n) :n(Br2) = 1:1, т.е. n(Br2) = n(CnH2n) = 0,3 моль. Найдем массу брома: m = n×M; m(Br2) = n(Br2) × M(Br2); M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль; m(MnO2) = 0,3 × 160 = 48 г. Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4). CH2=CH-CH2-CH3 (1); CH3-CH=CH-CH3 (2); CH2=C(CH3)-CH3 (3); C4H8 (4). Ответ Масса брома равна 48 г.
Источник
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник