КУЛЬТУРАЛЬНЫЙ (БАКТЕРИОЛОГИЧЕСКИЙ) МЕТОД ИССЛЕДОВАНИЯ



Бактериологический метод исследования (БЛМИ) – метод, основанный на выделении чистых культур бактерий с помощью культивирования на питательных средах и их идентификации до вида на основании изучения морфологических, культуральных, биохимических, генетических, серологических, биологических, экологических характеристик микроорганизмов.
Бактериологическую диагностику инфекций проводят, используя стандартные диагностические схемы, утвержденные Министерством здравоохранения.
Чистая культура – бактерии одного вида, выращенные на питательной среде, свойства которых находятся в процессе изучения.
Штамм – идентифицированная чистая культура микроорганизмов одного вида, выделенная из определенного источника в определенное время. Штаммы одного вида могут несущественно отличаться биохимическими, генетическими, серологическими, биологическими и др. свойствами, а также местом и временем выделения.
Цели БЛМИ:
1. Постановка этиологического диагноза: выделение чистой культуры микроорганизмов и её идентификация.
2. Определение дополнительных свойств, например, чувствительности микроорганизма к антибиотикам и бактериофагам.
3. Определение количества микроорганизмов (важно в диагностике инфекций, вызываемых УПМ).
4. Типирование микроорганизмов, т. е. определение внутривидовых различий на основании изучения генетических и эпидемиологических (фаговаров и сероваров) маркёров. Это используется в эпидемиологических целях, т. к. позволяет установить общность микроорганизмов, выделяемых от разных больных и из разных объектов внешней среды, в различных стационарах, географических регионах.
БЛМИ включает несколько этапов, различных для аэробов, факультативных анаэробов и облигатных анаэробов.
I. Этапы БЛМИ при выделении чистой культуры аэробов и факультативных анаэробов.
Этап.
А.Забор, транспортировка, хранение, предварительная обработка материала. Иногда до посева проводят селективную обработку материала с учетом свойств выделяемого микроорганизма. Например, перед исследованием мокроты или другого материала на присутствие кислот устойчивых микобактерий туберкулеза, материал обрабатывают растворами кислот или щелочей.
Б. Посев в среду обогащения (при необходимости). Его проводят, если в исследуемом материале содержится малое количество бактерий, например, при выделении гемокультуры. Для этого кровь, взятую на высоте лихорадки в большом объёме (8–10 мл у взрослых, 4–5 мл у детей) засевают в среду в соотношении 1:10 (для преодоления действия бактерицидных факторов крови); посев инкубируют при температуре 37 0 С 18-24 ч.
В. Микроскопия исследуемого материала. Из исследуемого материала готовят мазок, окрашивают его по Граму или другим методом и микроскопируют. Оценивают присутствующую микрофлору, ее количество. В ходе дальнейших исследований должны быть выделены микроорганизмы, присутствовавшие в первичном мазке.
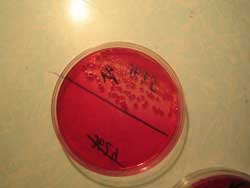
Г. Посев на питательные среды с целью получения изолированных колоний. Производят посев материала петлёй или шпателем методом механического разобщения на чашку с дифференциально-диагностической или селективной средой с целью получения изолированных колоний. После посева чашку переворачивают дном кверху (чтобы избежать размазывания колоний капельками конденсационной жидкости), подписывают и помещают в термостат при температуре 37 0 С на 18-24 ч.
Следует помнить, что при посевах и пересевах микробных культур внимание работающего должно быть обращено на соблюдение правил асептики для предупреждения контаминации питательных сред и предупреждения заражения окружающих и самозаражения!
В случае инфекций, вызываемых условно-патогенными микроорганизмами, где имеет значение количество присутствующих микроорганизмов в патологическом материале, делают количественный посев материала, для чего предварительного готовят ряд 100-кратных разведений материала (обычно 3 разведения) в стерильном изотоническом растворе хлорида натрия в пробирках. После чего по 50 мкл каждого разведения высевают на питательные среды в чашках Петри.
Этап.
А. Изучение морфотипов колоний на средах, их микроскопия. Просматривают чашки и отмечают оптимальную питательную среду, скорость роста, характер роста микроорганизмов. Для изучения выбирают изолированные колонии, расположенные по ходу штриха, ближе к центру. Если вырастает несколько типов колоний – каждый исследуется в отдельности. Оценивают признаки колоний (табл. 7). При необходимости чашки с посевами просматривают через лупу или с помощью микроскопа с объективом малого увеличения и суженной диафрагмой. Изучают тинкториальные свойства отличающихся морфотипов колоний, для этого из части исследуемой колонии готовят мазок, окрашивают по Граму или другими методами, микроскопируют и определяют морфологию чистоту культуры. При необходимости ставят ориентировочную РА на стекле с поливалентными сыворотками.

Б. Накопление чистой культуры. Для накопления чистой культуры изолированные колонии всех морфотипов пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой и инкубируют в термостате при +37 0 С (такая температура оптимальна для большинства микроорганизмов, но может быть и другой, например, для Campylobacterium spp. – +42 0 C, Candida spp. и Yersinia pestis – +25 0 C).
В качестве среды накопления для энтеробактерий обычно используют среду Клиглера.
Состав среды Клиглера: МПА, 0,1% глюкозы, 1% лактозы, реактив на сероводород (сернокислое железо + тиосульфат натрия + сульфит натрия), индикатор феноловый красный. Изначальный цвет среды малиново-красный, среда «скошена» в пробирках: имеет столбик (2/3) и скошенную поверхность (1/3).
Посев в среду Клиглера производится штрихом по поверхности и уколом в столбик.
Этап.
А. Учет роста на среде накопления, оценка чистоты культуры в мазке по Граму. Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нём в разных полях зрения обнаруживаются морфологически и тинкториально однородные клетки. Однако в случае выраженного плеоморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры могут встречаться одновременно клетки с различной морфологией.
Если в качестве среды накопления использовали индикаторную среду Клиглера, то оценивают изменения ее цвета в столбике и скошенной части, по которым определяют биохимические свойства: ферментацию глюкозы, лактозы и продукцию сероводорода. При разложении лактозы желтеет скошенная часть среды, при разложении глюкозы – желтеет столбик. При образовании CO2 в процессе разложения сахаров образуются газовые пузырьки или разрыв столбика. В случае продукции сероводорода отмечается почернение по ходу укола из-за превращении сульфата железа в сульфид железа.
Характер изменения цвета среды Клиглера (рис. 23) объясняется неодинаковой интенсивностью расщепления микроорганизмами азотистых веществ и образования щелочных продуктов в аэробных (на скошенной поверхности) и анаэробных (в столбике) условиях.
В аэробных условиях на скошенной поверхности происходит более интенсивное щелочеобразование, чем в столбике среды. Поэтому при разложении глюкозы, присутствующей в среде в небольшом количестве, образующаяся на скошенной поверхности кислота быстро нейтрализуется. В то же время при разложении лактозы, присутствующей в среде в высокой концентрации, щелочные продукты не способны нейтрализовать кислоту.
В анаэробных условиях в столбике щелочные продукты образуются в ничтожном количестве, поэтому здесь выявляется ферментация глюкозы.
Рис. 23. Индикаторная среда Клиглера:
2 – с ростом E. coli,
3– с ростом S. paratyphi B,
4 –с ростом S. typhi
E. coli разлагают глюкозу и лактозу с газообразованием, не продуцируют сероводород. Они вызывают пожелтение столбика и скошенной части с разрывами среды.
S. paratyphi разлагают глюкозу с газообразованием, лактозоотрицательны. Они вызывают пожелтение столбика с разрывами, скошенная часть не изменяет цвет и остается малиновой. При этом S. paratyphi B продуцируют сероводород (по ходу укола появляется черная окраска), S. paratyphi A сероводород не продуцируют.
S. typhi разлагают глюкозу без газообразования, лактозоотрицательны, продуцируют сероводород. Они вызывают пожелтение столбика без разрывов, скошенная часть не изменяет цвет и остается малиновой, по ходу укола появляется черная окраска.
Shigella spp. глюкозопозитивны, лактозоотрицательны, не продуцируют сероводород. Они вызывают пожелтение столбика (с разрывами или без них в зависимости от серовара), скошенная часть не изменяет цвет и остается малиновой.
Б. Окончательная идентификация чистой культуры(определение систематического положения выделенного микроорганизма до уровня вида или варианта) и определение спектра чувствительности выделенной культуры к антибиотикам.
Для идентификации чистой культуры на этом этапе изучают биохимические, генетические, серологические и биологические признаки (табл. 8).
В рутинной лабораторной практике при идентификации нет необходимости изучать все свойства. Используют информативные, доступные, простые тесты, достаточные для определения видовой (вариантной) принадлежности выделенного микроорганизма.
Источник
Тема 5. Бактериологические методы исследования.
Отбор и доставка материала в лабораторию.
Бактериологические методы исследования.
Методы культивирования и выделения чистых культур бактерий.
Принципы диагностики микозов.
ОТБОР И ДОСТАВКА МАТЕРИАЛА В ЛАБОРАТОРИЮ
Основные правила взятия и направления материала в микробиологическую лабораторию.
Результаты микробиологических исследований во многом зависят от правильного выбора, соблюдения всех правил отбора материала и направления его в лабораторию. Выбор материала определяется клинической картиной заболевания, предполагаемой локализацией возбудителя в организме на данном этапе и путей его выделения в окружающую среду.
Материал берут в ранние сроки заболевания, до начала антимикробной терапии в достаточном количестве.
Следует исключить попадание в материал антибиотиков, антисептиков, дезинфектантов.
При заборе, хранении и направлении материала в лабораторию строго соблюдаются правила техники бактериологической безопасности.
Материал собирают, соблюдая правила асептики для предупреждения его возможной контаминации нормальной микрофлорой организма больного и микроорганизмами окружающей среды. Используют стерильные инструменты и стерильную посуду, закрывающуюся ватно-марлевыми пробками. После взятия материала его в максимально короткие сроки направляют в лабораторию. При отсутствии такой возможности материал, за исключением ликвора, сохраняют непродолжительное время в холодильнике при 4°С.
Материал транспортируют в специальных биксах, пеналах или металлических контейнерах, которые после использования подвергают дезинфекции.
В микробиологической лаборатории все остатки патологического материала подлежат уничтожению (путем автоклавирования или сжигания).
Все материалы, направляемые в лабораторию, должны иметь сопроводительный документ — направление на специальном бланке, где указаны фамилия, имя, отчество больного, возраст, вид материала, дата взятия, предполагаемый клинический диагноз и другие сведения.
БАКТЕРИОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериологические методы исследования — это совокупность методов изучения свойств микроорганизмов, определения их систематического положения. Для этого необходимо прежде всего изолировать отдельные виды микробов и вырастить их в виде так называемых «чистых культур», а затем идентифицировать, т.е. установить соответствие выделенных микроорганизмов видам, описанным в специальных определителях.
Колония — это популяция микробных клеток одного вида, сформировавшаяся в результате деления одной микробной клетки в условиях культивирования на плотной питательной среде при оптимальной температуре.
Чистая культура — масса клеток, состоящая из микроорганизмов, принадлежащих одному виду и полученных как потомство одной клетки. Чистую культуру обычно получают путем пересева на стерильную питательную среду клеток, взятых из отдельно стоящей колонии бактерий.
Культуральные свойства бактерий устанавливаются по морфологии колоний и особенности роста культуры на питательных средах.
Биохимические признаки (свойства) бактерий определяются набором ферментов, присущих определенному роду, виду, варианту.
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ
Питательные среды предназначены для накопления, выделения, изучения и сохранения микроорганизмов.
По составу питательные среды могут быть синтетическими и натуральными.
По консистенции питательные среды могут быть жидкими, полужидкими (0,2-0,7% агара) и плотными (1,5-2% агара).
Различают питательные среды общего назначения (универсальные) и специальные питательные среды. Питательные среды общего назначения пригодны для выращивания многих видов микроорганизмов и применения в качестве основы для приготовления специальных питательных сред. Специальные питательные среды предназначены для избирательного культивирования определенных видов микроорганизмов, изучения их свойств и хранения.
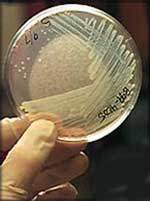
Рис. 1. Плотные питательные среды в чашках Петри.
В зависимости от цели исследования, характера посевного материала и среды используют различные методы посева. Все они включают обязательную цель: оградить посев от посторонних микробов, поэтому посев производят в асептических условиях.
Для посевов на плотные питательные среды применяют шпатель, бактериологическую петлю, иглу, тампон. При посеве проводят петлей по поверхности среды линии, оставляя при этом клетки бактерий на среде. После посева чашки закрывают и переворачивают их вверх дном. Надписи на чашках делают со стороны дна, а на пробирках — в верхней части.
Рис. 2. Посев культуры на плотную питательную среду (слева); результат посева: видны колонии бактерий (в центре и справа).
При посеве на жидкую среду петлю слегка погружают в жидкость и растирают посевной материал на стенке пробирки, после чего смывают его средой.
И ВЫДЕЛЕНИЯ ЧИСТОЙ КУЛЬТУРЫ БАКТЕРИЙ
Для успешного культивирования, помимо правильно подобранных сред и правильно произведенного посева, необходимы оптимальные условия: температура, влажность, аэрация (снабжение воздухом). Культивирование анаэробов сложнее, чем аэробов, для удаления воздуха из питательной среды используют различные способы.
Выделение отдельных видов бактерий (чистой культуры) из исследуемого материала, содержащего, как правило, смесь различных микроорганизмов, является одним из этапов любого бактериологического исследования. Чистой культурой микробов получают из изолированной микробной колонии.
При выделении чистой культуры из крови (гемокультуры) ее предварительно «подращивают» в жидкой среде: 10-15 мл стерильно взятой крови засевают в 100-150 мл жидкой среды. Соотношение засеваемой крови и питательной среды 1:10 не случайно — так достигается разведение крови (неразведенная кровь губительно действует на микроорганизмы).
Этапы выделения чистой культуры бактерий
Источник