Эндолюмбальный способ введения это
Он нашел более широкое применение в клинике. Дозировка пенициллина в таких случаях довольно разнообразна. Одни ограничиваются введением его в количестве 10—20 тыс. ЕД, другие вводят по 40—50 тыс., но есть такие, которые вводят его по 200 тыс. ЕД за один раз. И. С. Куриленко и В. А. Добрых рекомендуют начинать с малых доз. Если реакция на малые дозы не последует, то можно их увеличивать до 100—200 тыс. ЕД пенициллина с промежутками в 1—2 дня. С. А. Русанов на основании изучения литературных данных указывает, что максимальной дозой, не вызывавшей существенных расстройств при интралюмбальном введении антибиотика, можно считать дозу в 50 тыс. ЕД. Он же указывает, что больные менингитом обычно легко переносят эндолюмбальное введение даже относительно больших доз пенициллина, в то время как профилактическое введение его вызывает серьезные побочные явления.
Н. Н. Александров сообщает, что на основании наблюдений, полученных в нейрохирургической клинике Военно-медицинской Академии, можно прийти к заключению, что для интралюмбального введения пенициллина с лечебными целями при менингоэнцефалите в большинстве случаев достаточной дозой следует считать 50 тыс. ЕД. При тяжелых формах заболевания эта доза может быть увеличена до 75— 100 тыс. ЕД. Увеличение этой дозы, по мнению автора, не должно иметь места. По мере улучшения состояния больного эта доза антибиотика постепенно снижается. Как показали исследования этого автора, указанные дозы пенициллина обеспечивают к моменту следующей инъекции (которая производится через 24 ч) достаточную концентрацию его в ликворе, равную 0,03—0,06 ЕД в 1 мл. Эти дозы антибиотика при интралюмбальном введении, по его мнению, достаточно эффективны. Н. И. Гращенков и И. Г. Вайнштейн считают, что первое субарахноидальное введение пенициллина не должно превышать 10—15 тыс. ЕД.
Гибсон и Джеймс (Gibson и James) рекомендуют вводить пенициллин интралюмбально в дозе, равной 25 тыс. ЕД в 10 мл физиологического раствора.
Рудберг и Сьеберг (Rudberg и Syoberg1) вводили пенициллин эндолюмбально больным менингитом дважды в день. Когда наступало заметное улучшение менингеальных симптомов, двухразовое введение заменялось одноразовым.
В. И. Покровский, Мереи (Merei) делают интралюмбальные инъекции пенициллина при менингите до тех пор, пока количество форменных элементов в спинномозговой жидкости доходит до 90—120 в 1 мм3 или пока возникают реактивные явления со стороны центральной нервной системы в виде головной боли, судорог. При указанных явлениях субарахноидальное введение антибиотика прекращается. При гнойных менингитах в субарахноидальное пространство вводится также стрептомицин.
Дозировка пенициллина и стрептомицина при менингитах должна быть строго индивидуализирована. Поэтому установить какую-либо дозу, пригодную во всех случаях, трудно. Во всяком случае дозы пенициллина должны быть невелики и в зависимости от тяжести процесса они колеблются в пределах 30—50 тыс. ЕД, а стрептомицин по 50—100 тыс. ЕД.
В субарахноидальное пространство следует вводить исключительно кристаллическую натриевую соль пенициллина и хлоркальциевыи комплекс стрептомицина в физиологическом растворе. Указанные препараты, менее токсичны и поэтому больше подходят для этой цели.
Комбинированное (внутримышечное и субарахноидальное) применение антибиотиков имеет место в настоящее время, главным образом, при тяжелых формах гнойного менингита различной этиологии.
Методика введения антибиотика проста. После выпускания 10—15 мл спинномозговой жидкости вводится раствор пенициллина или стрептомицина. Эндолюмбально пенициллин и стрептомицин вводятся периодически, через 1—2 дня. Как мы уже сказали, интралюмбальный способ введения пенициллина и стрептомицина обычно сочетается с внутримышечным.
Источник
Эндолюмбальный способ введения это
Введение лекарственных веществ непосредственно в ликворную систему (интратекально, эндолюмбально) является очень ответственной процедурой. Такой путь введения лекарственных препаратов (преимущественно этиотропных) в субарахноидальное пространство наиболее часто показан при инфекционных поражениях мозговых оболочек и вещества головного мозга (менингит, менингоэнцефалит).
При крайне тяжелых вариантах течения бактериальных нейроинфекций интратекальное введение антибактериальных препаратов применяется в сочетании с основными методами их введения — внутримышечным, внутривенным и внутриартериальным.
Показаниями для интратекального введения антибиотиков являются:
— ациклично протекающие (затяжные, вяло- и волнообразно текущие) тяжелые и крайне тяжелые формы гнойных менингитов и менингоэнцефалитов;
— угроза развития или наличие вентрикулита;
— угроза формирования абсцесса головного мозга на фоне основного заболевания и(или) организации гноя на поверхности головного мозга;
— тромбоэмболические поражения сосудов и синусов головного мозга на фоне сепсиса;
— развитие гнойного менингита и(или) менингоэнцефалита как осложнения нейрохирургического заболевания, в том числе в послеоперационном периоде.
При выборе этиотропного препарата, предполагаемого к интратекальному введению, определении его разовых, курсовых доз и длительности курса необходимо помнить о том, что интратекальное введение антибиотика является дополнением к основной этиотропнои терапии, а также учитывать следующие факторы:
— предрасположенность больного к аллергии;
— степень выраженности отека головного мозга (при выраженном отеке введение препаратов в концевую цистерну малоэффективно);
— спектр выделенных штаммов патогенных микроорганизмов, их чувствительность к антибиотикам;
— фармакокинетические и фармакодинамические особенности конкретных препаратов и их сочетаемость (синергизм) с препаратами, в том числе антибактериальными, получаемыми больным в виде базисной терапии;
— возможность появления токсических эффектов при интратекальном введении препаратов, особенно при наличии у больного тяжелого сопутствующего патологического процесса (поражение почек, печени и т. д.);
— проведение больному ликворосорбционной терапии и ряда других экстракорпоральных методов лечения.
Прямых противопоказаний к интратекальному введению антибиотиков нет, однако именно факторы непосредственного миелотоксического и других прямых токсических воздействий на ткани ЦНС большинства антибиотиков и противобактериальных химиопрепаратов значительно сузили спектр используемых для эндолюмбального введения антибиотиков.
Второй, не менее существенной, проблемой является тенденция к изменению резистентности основных нейротропных этиопатогенов к все еще широко используемым препаратам пенициллинового ряда и аминогликозидов первых поколений. Общепризнанным является факт, что не чувствительны in vitro и клинически к этим препаратам выделенные от больных практически 90% штаммов стафилококков, до 40% штаммов пневмококков, до 15% штаммов менингококков (в странах Азии, США, Канаде).
Кроме того, наблюдается повсеместная тенденция к росту удельного веса в этиологии бактериальных нейроинфекций листерий, гемофильной палочки, энтеробактерий, традиционно резистентных к названным препаратам.
Источник
Эндолюмбальный способ введения это
ФГБОУ ВО «Тюменский государственный медицинский университет», Тюмень, Россия
ГБОУ ВПО «Тюменская государственная медицинская академия», Тюмень
Государственный медицинский университет, Семей, Казахстан
ГБОУ ВПО «Тюменский государственный медицинский университет», Тюмень, Россия, Государственный медицинский университет, Семей, Казахстан
ГБОУ ВПО «Тюменский государственный медицинский университет», Тюмень, Россия
Интратекальное введение лекарственных препаратов
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(10): 89-92
Лебедев И. А., Левитина Е. В., Акимжанова А. К., Рахманина О. А., Шторк Т. Э. Интратекальное введение лекарственных препаратов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(10):89-92.
Lebedev I A, Levitina E V, Akimzhanova A K, Rakhmanina O A, Shtork T E. Intrathecal administration of drugs. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2016;116(10):89-92.
https://doi.org/10.17116/jnevro201611610189-92
ФГБОУ ВО «Тюменский государственный медицинский университет», Тюмень, Россия


Обобщены сведения о введении лекарственных средств в цереброспинальную жидкость. Освещены показания и противопоказания к введению фармацевтических препаратов в ликворное пространство. Приведены основные группы фармакологических препаратов, применяемых для эндолюмбального введения и показания для их назначения, отмечены преимущества и недостатки такого метода лечения. Описана методика введения антибиотиков при бактериальном и грибковом поражении ЦНС. Подчеркивается необходимость оценки интракраниального давления перед выполнением процедуры пункции концевой цистерны и исключения блокады ликворопроводящих путей. Отражены основные сведения об интратекальном введении противоопухолевых и цитостатических препаратов при первичных и метастатических поражениях головного мозга, а также эффективности введения кислородно-озоновой смеси в лечении пациентов с черепно-мозговой травмой. Отмечены результаты исследования, показавшие статистически значимое уменьшение выраженности неврологического дефицита при введении церебролизина в эндолюмбальное пространство в 1-е сутки после развития инфаркта мозга. Приведена информация о возможных осложнениях описываемого способа доставки лекарственных средств, методы борьбы с ними и способы их предотвращения.
ФГБОУ ВО «Тюменский государственный медицинский университет», Тюмень, Россия
ГБОУ ВПО «Тюменская государственная медицинская академия», Тюмень
Государственный медицинский университет, Семей, Казахстан
ГБОУ ВПО «Тюменский государственный медицинский университет», Тюмень, Россия, Государственный медицинский университет, Семей, Казахстан
ГБОУ ВПО «Тюменский государственный медицинский университет», Тюмень, Россия
Исторические сведения о первом интратекальном введении фармакологических препаратов с лечебной целью отсутствуют. Имеются данные о том, что люмбальную пункцию (ЛП) впервые выполнил и описал Г. Квинке в 1890 г. Он же первым исследовал цереброспинальную жидкость (ЦСЖ), определил состав, удельный вес, изучил и описал ее характеристики при гнойном менингите. Известный нейрохирург У. Денди, обучавшийся данной специальности у Х. Кушинга, разработал и использовал на практике такие диагностические методы, как пневмовентрикулография (1918 г.) и пневмоэнцефалография с эндолюмбальным введением воздуха (1919 г.). Спинальная анестезия была впервые выполнена 16 августа 1898 г. А. Биром при резекции пораженного туберкулезом голеностопного сустава. А. Бир и его ученик А. Гильдебрандт лично на себе испытали действие нового метода анестезии [1—6].
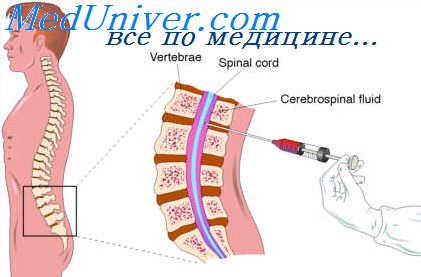
Термин «интратекальное введение» («эндолюмбальное введение») обозначает доставку вещества в подоболочечное пространство (от лат. teka — оболочка), т. е. субарахноидально после прокола твердой мозговой оболочки. В нейрохирургической практике при выполнении лекарственных блокад анестетик и кортикостероидные препараты могут вводиться в эпидуральное пространство, т. е. между твердой оболочкой спинного мозга и желтой связкой.
Основными преимуществами интратекального введения являются возможность создания максимальных концентраций лекарственного вещества в мозговой ткани и ЦСЖ, а также введение препаратов, не проникающих через гематоэнцефалический барьер. В ряде случаев введение лекарственного средства в концевую цистерну позволяет уменьшить его дозу и снизить системное токсическое воздействие. К недостаткам метода можно отнести относительно сложную методику введения фармакологических средств, риск перепадов интракраниального давления и невозможность введения эмульсий и суспензий. При соблюдении техники выполнения ЛП вероятность повреждения мозговой ткани минимальна.
Не касаясь в данной статье введения в эндолюмбальное пространство препаратов для анестезии и контрастных веществ, выделим показания к интратекальному введению лекарственных средств. Одним из основных показаний для введения антибактериальных препаратов в ЦСЖ методом пунктирования люмбального пространства является бактериальный менингит. Такая процедура показана при отсутствии клинического и лабораторного улучшения состояния больного в течение 72 ч после начала парентерального введения антибиотиков. Существует точка зрения, что данный временной промежуток должен быть меньше, и отсутствие санации ЦСЖ на фоне проводимого лечения в течение 24—48 ч — достаточное основание для интратекальной противомикробной терапии [2]. Показаниями для этого вида лечения являются вентрикулит, поздно начатое лечение и рецидив менингита или менингоэнцефалита, особенно у больных с иммунодефицитом. Под вентрикулитом понимают воспаление эпендимы желудочков мозга, обычно развивающееся в результате ее инфекционного поражения с резким ухудшением состояния больного, рвотой, угнетением сознания и гипертермией. Причиной его развития могут быть гематогенное распространение бактериальных агентов, распространение менингита из подпаутинного пространства, а также прорыв абсцесса мозга, в результате чего его содержимое попадает в полость желудочков.
Клинический опыт позволил определить основные группы антибиотиков, используемых для введения в ЦСЖ с учетом наиболее вероятной природы возбудителей и их резистентности к препаратам данной группы. В настоящее время при бактериальном поражении ЦНС в концевую цистерну вводятся аминогликозиды (амикацин по 5—20 мг 1 раз в сутки, гентамицин по 4—8 мг 1 раз в сутки, тобрамицин по 4—8 мг 1 раз в сутки), ванкомицин по 4—10 мг 1 раз в сутки, полимиксин В по 50 000 ЕД 1 раз в сутки (детям до 2 лет — по 20 000 ЕД в сутки), диоксидин по 5—10 мг в концентрации 0,1—1% 1 раз в сутки. Необходимо помнить о недопустимости введения в ликворное пространство калиевой соли пенициллина и колистина (полимиксин Е) — это может привести к летальному исходу прямо во время процедуры.
Коррекция этиотропного лечения, как правило, проводится после получения результатов бактериологического исследования. Такие ранее применяемые препараты, как стрептомицин, олеандомицин, морфоциклин, неомицин, мономицин, левомицетина гемисукцинат, полимиксин М в настоящее время для интратекального введения используются все реже из-за выраженной токсичности.
Перед выполнением ЛП врач должен понимать степень выраженности у больного отека головного мозга, о котором можно судить по данным нейровизуализации и офтальмоскопии. При выраженном отеке введение препаратов в концевую цистерну малоэффективно, а выведение ЦСЖ может привести к повреждению головного мозга в результате его вклинения в большое затылочное отверстие. После прокола твердой мозговой оболочки необходимо оценить проходимость субдурального пространства путем проведения ликвородинамических проб. Это особенно важно в случае наличия у пациента опухолевого или метастатического поражения спинного мозга или его оболочек. При наличии блока ликворопроводящих путей вводимый препарат не поступит интракраниально, а его миелотоксическое действие может повыситься из-за невозможности распределения в ЦСЖ.
Методика введения лекарственных средств в субарахноидальное пространство состоит в следующем: разовую дозу вводимого препарата разводят в 2—3 мл изотонического (0,9%) раствора натрия хлорида. После выполнения ЛП на уровне L3—S1 (игла прокалывает кожу, гиподерму, межостистые и желтые связки отростков позвонков и твердую оболочку мозга) канюлю шприца вставляют в павильон пункционной иглы, набирают в шприц до 5—6 мл ЦСЖ и медленно вводят 2—3 мл содержимого шприца. Затем вновь наполняют шприц ЦСЖ до 5 мл и медленно вводят все содержимое шприца. После манипуляции пункционную иглу извлекают. Если состояние больного позволяет, то ему показано нахождение в постели с приподнятым ножным концом в течение 30 мин. В случае курсового введения антибиотиков показанием для отмены данной манипуляции являются появление признаков токсического воздействия препарата (снижение содержания белка в ЦСЖ ниже 1 г/л) и наступление лимфоцитарной санации ЦСЖ (кроме туберкулезного поражения ЦНС) [7].
При выборе антимикробного препарата, предполагаемого для интратекального введения, определении его разовых и курсовых доз, а также длительности курса необходимо помнить, что введение антибиотика в эндолюмбальное пространство не заменяет этиотропной терапии, получаемой больным парентерально. Кроме того, необходимо учитывать такие факторы, как аллергологический анамнез, спектр выделенных штаммов патогенных микроорганизмов и их чувствительность к антибиотикам, фармакокинетические и фармакодинамические особенности конкретных препаратов, их сочетаемость и синергизм с препаратами, в том числе антибактериальными, получаемыми больным в виде базисной терапии. Необходимо помнить о возможности появления токсических эффектов при эндолюмбальном введении препаратов, особенно при наличии у больного тяжелого сопутствующего заболевания (поражение почек, печени и т. д.), проведения больному ликворосорбционной терапии и других экстракорпоральных методов лечения.
Обращает на себя внимание, что в инструкциях по применению противобактериальных препаратов этот метод введения практически не представлен, а антибиотики, рекомендуемые для лечения менингитов, не охарактеризованы с точки зрения переносимости при введении в ликворопроводящее пространство.
Прямых противопоказаний к интратекальному введению антибиотиков нет, однако именно факторы непосредственного токсического воздействия на ЦНС большинства препаратов этой группы и противобактериальных химиопрепаратов значительно сузили спектр используемых лекарственных средств. Второй проблемой является тенденция к изменению резистентности основных нейротропных патогенов ко все еще используемым препаратам пенициллинового ряда и аминогликозидов первых поколений. Общепризнанно, что нечувствительны in vitro и клинически к этим препаратам выделенные от больных практически 90% штаммов стафилококков, до 40% — пневмококков, до 15% — менингококков (особенно в странах Азии, США, Канаде). Кроме того, наблюдается повсеместная тенденция к росту удельного веса в этиологии бактериальных нейроинфекций листерий, гемофильной палочки, энтеробактерий, традиционно резистентных к названным препаратам [8].
Другим показанием для эндолюмбального применения лекарственных средств является грибковый менингит (криптококковый, кандидозный, гистоплазмоидный, кокцидиоидомикозный), в этом случае вводится амфотерицин В. Учитывая его относительно высокое нефротоксическое действие, встречающееся у 80% больных, целесообразно применение липосомального варианта (амбизом), обладающего меньшей токсичностью. В дозе 0,25—1,0 мг он вводится 2—4 раза в сутки, через катетер, установленный в концевой цистерне [9—14].
При туберкулезном поражении ЦНС возможно интратекальное введение изониазида (до 2,5 мг/кг), хотя в реальной клинической практике это встречается редко [15].
При наличии у пациента таких нейроонкологических заболеваний, как менингеальный карциноматоз, нейролейкоз, лептоменингеальная лимфома и некоторые злокачественные опухоли ЦНС, в том числе метастазы рака, интратекально вводятся цитостатики. Метотрексат применяется в дозе 0,25 мг/кг массы тела больного, на курс 120—180 мг с началом на 7—10-е сутки после оперативного вмешательства. Недостатком данного препарата являются выраженное токсическое действие, нарастание отека в послеоперационной зоне и реактивная гиперпродукция ЦСЖ, что сопровождается внутричерепной гипертензией [16].
Необходимо отметить, что только в инструкции к применению метотрексата и противоопухолевого препарата цитозар сказано об их возможном введении в ликворное пространство. Близким по составу и действию к цитозару препаратом, который может вводиться в концевую цистерну для лечения онкологических процессов в ЦНС, является вепезид. В инструкции к применению противоопухолевого препарата велкейд (бортезомиб) отмечено о недопустимости его эндолюмбального введения и то, что во время такой процедуры были отмечены летальные случаи.
В ряде исследований была показана эффективность и безопасность интратекального введения церебролизина в остром периоде инфаркта мозга. Установлено достоверно более быстрое и значительное развитие регресса неврологического дефицита у больных, получавших такой вид лечения, по сравнению с пациентами, перенесшими ишемический инсульт, которым данный препарат в подоболочечное пространство не вводился. При однократном эндолюмбальном введении 5 мл церебролизина в первые 12 ч после развития острого инсульта и последующем лечении внутривенными капельными введениями по 10 мл через 12 ч отмечено статистически значимое повышение эффективности терапии по сравнению только с внутривенным введением препарата в той же дозе [17].
Кроме того, имеется опыт введения в ликворное пространство озоно-кислородной смеси и биологического регулятора гипофиза эпиталамина при лечении черепно-мозговой травмы (ЧМТ). Эффективность такой методики доказана в исследованиях, основанных на данных лабораторного анализа ЦСЖ, нейроофтальмологических методов, нейрокартирования и вызванных потенциалов. Динамика клинических изменений при комплексном лечении среднетяжелой ЧМТ и ее осложнений у больных, получавших такую смесь в концевую цистерну, достоверно свидетельствует о более быстром регрессе общемозговой и очаговой неврологической симптоматики, менингеального синдрома и нормализации ЦСЖ, чем у пострадавших, не получавших такого лечения [18].
У пациентов с тяжелой ЧМТ при включении в комплексную терапию эндолюмбального введения в течение 3 сут биорегулятора эпиталамина 1 в дозе 20 мг, растворенного в 1,5—5 мл 10% раствора глюкозы, достоверно повышаются результаты лечения и снижается летальность. Далее переходят на ежедневное внутривенное введение 20 мг препарата в течение 7 сут. Эффект достигается за счет восстановления нарушенной в результате ЧМТ нейрорегуляции иммуногенеза посредством модуляции гипоталамо-гипофизарной системы 2 .
В нейрохирургической практике при лечении люмбосакральных радикулопатий со стойким выраженным болевым синдромом применяется эпидуральное введение кортикостероидов, в частности дипроспана (бетаметазон) 1—2 мл (7—14 мг), триамциналона диацетата (50 мг) или метилпреднизолона ацетата (80 мг). Эти препараты, как правило, разводятся на каком-либо анестетике, чаще на лидокаине.
Для уменьшения спастичности, сопровождающей некоторые заболевания ЦСЖ, интратекально, через установленный в концевой цистерне катетер с помощью специальной помпы вводят баклофен, выпускаемый для такого применения в специальной инъекционной форме по 1 и 5 мл под торговым названием лиорезал интратекальный. Инфузия препарата непосредственно под твердую оболочку обеспечивает воздействие этого лекарственного средства на рецепторные зоны задних рогов спинного мозга.
Необходимо помнить, что попадание в субарахноидальное пространство инородных субстанций (воздух, контрастные вещества, анестетики, химиотерапевтические препараты, антибактериальные средства) может вызвать средней степени или выраженную менингеальную реакцию. Она проявляется плеоцитозом до 1000 клеток в 1 мкл, повышением содержания белка при нормальном содержании глюкозы и стерильном посеве ЦСЖ. В большинстве случаев это состояние быстро регрессирует, но иногда может привести к арахноидиту, радикулиту или миелиту. Частота таких осложнений неизвестна.
Имеющиеся сведения позволяют рассматривать введение лекарственных препаратов в ЦСЖ как один из способов повышения эффективности проводимой терапии у пациентов с различными заболеваниями нервной системы.
Конфликт интересов отсутствует.
1 В РФ в качестве лекарственного препарата не зарегистирован.
Источник