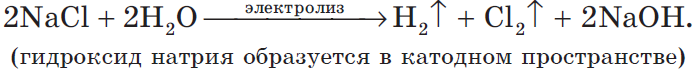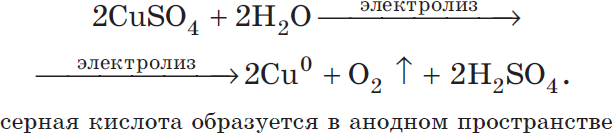- Электролиз
- Электролиз расплавов и растворов
- Теория к заданию 22 из ЕГЭ по химии
- Электролиз расплавов и растворов (солей, щелочей)
- Электролиз расплавленных солей
- Электролиз водных растворов электролитов
- Что такое электролиз и где он применяется?
- Что такое электролиз?
- Законы электролиза Фарадея
- Первый закон
- Второй закон
- Электролиз расплавов
- Особенности электролиза в растворах
- Электролиз в газах
- Особенности процессов, происходящих на катоде и аноде
- Факторы, влияющие на процесс электролиза
- Где применяется электролиз?
- Гальваническое покрытие
- Электроочистка — рафинирование меди
- Добыча металлов
- Анодирование
- Энергетические затраты
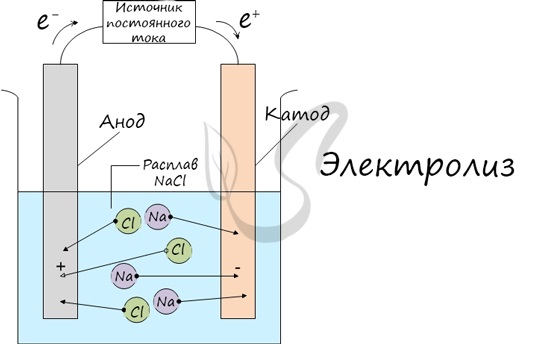
Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
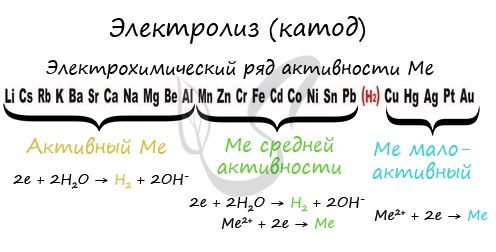
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
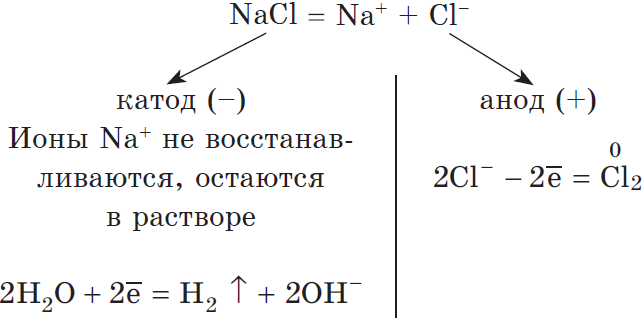
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
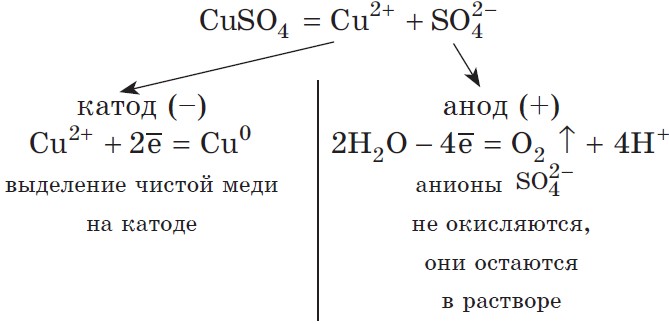
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Электролиз расплавов и растворов
Теория к заданию 22 из ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
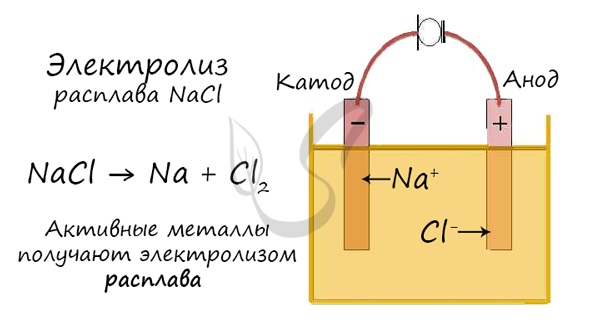
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Под действием электрического тока катионы $Na^<+>$ движутся к катоду и принимают от него электроны:
Анионы $Cl^<->$ движутся к аноду и отдают электроны:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
| $Li K Ca Na Mg Al$ $Li^ <+>K^ <+>Ca^ <2+>Na^ <+>Mg^ <2+>Al^<3+>$ | $Mn Zn Fe Ni Sn Pb$ $Mn^ <2+>Zn^ <2+>Fe^ <2+>Ni^ <2+>Sn^ <2+>Pb^<2+>$ | $H_2$ $2H^<+>$ | $Cu Hg Ag Pt Au$ $Cu^ <2+>Hg_2^ <2+>Ag^ <+>Pt^ <2+>Au^<3+>$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^<−>;$ $M^ | Восстанавливаются катионы металла и вода: $M^ $2H_2O+2ē=H_2↑+2OH^<−>$ | Восстанавливаются катионы металла: $M^ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) | |||
2. Процесс на аноде зависит от материала анода и от природы аниона.
| Кислотный остаток $Ас^ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^<−>−nē=M^ анод раствор | Окисление аниона (кроме $F^<–>$) $Ac^ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^<+>$ В щелочной среде: $4OH^<−>−4ē=O_2↑+4H^<+>$ | |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Учитывая присутствие ионов $Na^<+>$ в растворе, составляем молекулярное уравнение:
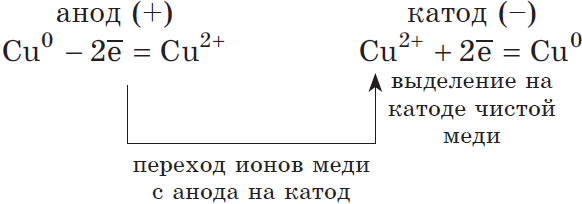
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Катионы $Cu^<2+>$ в ряду напряжений стоят после ($Н^<+>$), по этому они и будут восстанавливаться на катоде.
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^<2->$ в растворе:
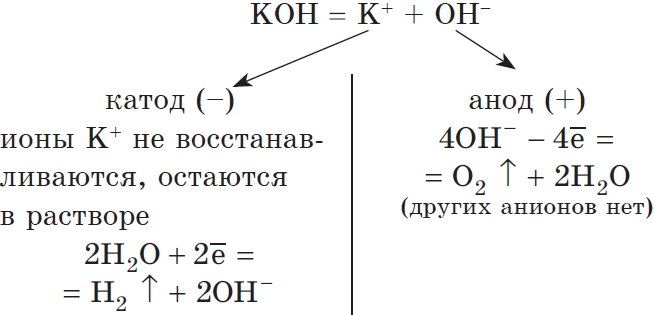
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Источник
Что такое электролиз и где он применяется?
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.
Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:
k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита . Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока . В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита . Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита . Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Источник