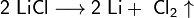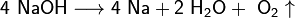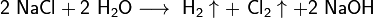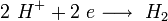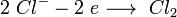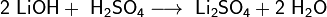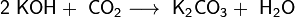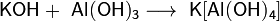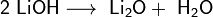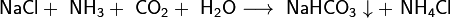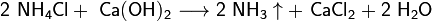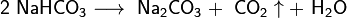- Получение щелочных металлов
- Готовые домашние задания, готовые задачи по химии и биологии
- Получение щелочных металлов и едких щелочей. Задачи 973 — 974
- Характеристика электролитических способов получения щелочных металлов и едких щелочей
- Электролитический способ получения щелочных металлов
- Характеристика электролитических способов получения щелочных металлов и едких щелочей
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li + + e → Li
анод: 2Cl − — 2e → Cl2
2. Иногда для получения щелочных металлов проводят э электролиз расплавов их гидроксидов:
катод: Na + + e → Na
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием изхромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка.
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрияэлектролизом концентрированного водного раствора поваренной соли:
катод:
анод:
Прежде щёлочь получали реакцией обмена:
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных дляоснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Карбонаты
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3 − , необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действиемуглекислого газа на раствор гидроксида калия:
Поташ используют в производстве стекла и жидкого мыла.
Щелочные металлы. Ионы Na + и К + распределены по всему организму, причём ионы натрия входят в состав преимущественно межклеточных жидкостей, а ионы калия находятся, в основном, внутри клеток. С ионами натрия связаны осмотическое давление жидкостей, удержание воды тканями, поддержание кислотно-основного равновесия в организме, перенос аминокислот и сахаров через клеточную мембрану.
Хлорид натрия NaCl. В зависимости от концентрации хлорида натрия различают изотонический (физиологический) и гипертонический растворы.
Изотоническим является 0,9%-ный раствор NaCl, т.к. его осмотическое давление соответствует осмотическому давлению плазмы крови (7,7 атм). Изотонический раствор используют в качестве плазмозаменяющего раствора при обезвоживании организма, для растворения лекарственных веществ и т.д. Гипертонические растворы (5%, 10%)применяют наружно в виде компрессов и примочек для лечения гнойных ран.
Гидрокарбонат натрия NaHCO3 (питьевая сода). Введение гидрокарбоната натрия в желудок приводит к быстрой нейтрализации соляной кислоты желудочного сока:
Глауберова соль Na2SO4*10H2O; назначается внутрь в качестве слабительного средства.
Иодид калия KI применяется как препарат йода при заболеваниях щитовидной железы.
Перманганат калия KMnO4 используется как антисептическое средство для промывания ран, полоскания рта и горла.
Источник
Готовые домашние задания, готовые задачи по химии и биологии
Получение щелочных металлов и едких щелочей. Задачи 973 — 974
Характеристика электролитических способов получения щелочных металлов и едких щелочей
Задача 973.
Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электрохимические процессы происходят в том и другом случае?
Решение:
а) Щелочные металлы получают электролизом расплавов их соединений, например, натрий можно получить электролизом расплава хлорида натрия. При этом на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Уравнения реакций электродных процессов при электролизе расплава NaCl:
На катоде: Na + + 
На аноде: Cl¯- 
Cl 0 +Cl 0 = Cl2↑
Побочным продуктом является газообразный хлор, который собирают и используют в промышленности.
б) Едкие щёлочи получают электролизом водных растворов солей щелочных металлов, например, едкое натрий получают электролизом водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода (в катодном пространстве) накапливаются ионы натрия и гидрокси-ионы (Na + и ОН ¯ ). На аноде выделяется хлор. Очень важно чтобы продукты электролиза не смешивались, так как NaOH легко взаимодействует с хлором. Для воспрепятствованию смешивания NaOH и Cl2 применяют диафрагменный метод (устанавливают диафрагму из асбеста или другого пористого материала ). Существуют два метода электролиза соли: Метод стального электрода (катода) и метод ртутного катода, анодом в обеих случаях является угольный стержень.
Уравнения реакций процессов на катоде и аноде при электролизе раствора хлорида натрия:
На катоде: 2Н2О + 2 
На аноде: 2Сl ¯ — 2 
2NaCl + 2H2O 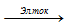
В процессе электролиза в анодное пространство непрерывно поступает раствор NaCl, а из катодного вытекает раствор, содержащий смесь NaCl и NaOH. При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
Если катодом служит ртуть, то у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Полученную при электролизе амальгаму разлагают горячей водой, при чём получается гидроксид натрия и выделяется водород и освобождается ртуть. Этим методом можно получить чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Задача 974.
Как путем электролиза раствора хлорида калия получить гидроксид, гипохлорит и хлорат калия? Написать уравнения происходящих реакций.
Решение:
а) Электролиз (Elektrolyse) раствора хлорида калия – соли образованной при взаимодействии активного металла и бескислородной кислоты протекает предсказуемо. В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН).
Стандартный электродный потенциал системы К + + 1 
Катод: 2Н2О +2 
а ионы К + , приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление ионов хлора Cl ¯ , приводящее к выделению газообразного хлора:
2Сl ¯ + 2 
2Cl 0 = Cl2 0 ↑
Поскольку отвечающей этой системе стандартный электродный потенциал (1,359 В), хотя и больше, чем стандартный электродный потенциал системы: 2Н2О = О2↑+ 4Н + + 4 

По окончании электролиза жидкость у катодного пространства выпаривают. При его выпаривании выкристаллизовываются хлорид калия и остаётся почти чистый гидроксид калия, который выпаривают до полного удаления воды. Затем, гидроксид калия сплавляют в формы. Побочными продуктами электролиза являются газообразные водород и хлор.
б) Получение гипохлорита калия. Для получения гипохлорита калия нужно, выделяющийся при электролизе хлорида калия газообразный хлор, пропустить через раствор гидроксида калия у катодного пространства. При пропускании хлора через исходный раствор едкого калия образуется гипохлорит калия:
в) Для получения хлората калия нужно пропустить хлор в горячий раствор гидроксида калия, получим:
Поскольку хлорат калия малорастворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Источник
Электролитический способ получения щелочных металлов
Все щелочные металлы встречаются в природе исключительно в виде соединений, являются сильными восстановителями, и их получение требует высоких энергетических затрат.
Литий получают электролизом расплава хлорида лития, который образуется при переработке сподумена. Переработка сподумена – процесс довольно сложный, включает стадии получения алюмината лития, гидроксида лития и хлорида лития:
2LiCl 
Известен также способ получения лития из его оксида в вакууме при 300°С:
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl 
Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Калий, рубидий и цезий можно получить электролизом расплава их солей, однако на практике таким способом их не получают из-за их высокой химической активности.
Калий получают, пропуская пары натрия через расплав хлорида калия при 800°С, выделяющие пары калия конденсируют:
KCl + Na = K + NaCl
или при взаимодействии между расплавленным гидроксидом калия и жидким натрием при 440°С:
KOH + Na = K + NaOH.
Рубидий и цезий получают восстановлением их хлоридов кальцием при 700–800 °С:
2RbCl + Ca = 2Rb + CaCl2,
в качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
Источник
Характеристика электролитических способов получения щелочных металлов и едких щелочей
Задача 973.
Чем отличается электролитический способ получения щелочных металлов от электролитического способа получения едких щелочей? Какие электрохимические процессы происходят в том и другом случае?
Решение:
а) Щелочные металлы получают электролизом расплавов их соединений, например, натрий можно получить электролизом расплава хлорида натрия. При этом на катоде выделяется металлический натрий, а на аноде – газообразный хлор.
Уравнения реакций электродных процессов при электролизе расплава NaCl:
На катоде: Na + + 
На аноде: Cl¯- 
Cl 0 +Cl 0 = Cl2↑
Побочным продуктом является газообразный хлор, который собирают и используют в промышленности.
б) Едкие щёлочи получают электролизом водных растворов солей щелочных металлов, например, едкое натрий получают электролизом водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода (в катодном пространстве) накапливаются ионы натрия и гидрокси-ионы (Na + и ОН ¯ ). На аноде выделяется хлор. Очень важно чтобы продукты электролиза не смешивались, так как NaOH легко взаимодействует с хлором. Для воспрепятствованию смешивания NaOH и Cl2 применяют диафрагменный метод (устанавливают диафрагму из асбеста или другого пористого материала ). Существуют два метода электролиза соли: Метод стального электрода (катода) и метод ртутного катода, анодом в обеих случаях является угольный стержень.
Уравнения реакций процессов на катоде и аноде при электролизе раствора хлорида натрия:
На катоде: 2Н2О + 2 
На аноде: 2Сl ¯ — 2 
2NaCl + 2H2O 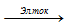
В процессе электролиза в анодное пространство непрерывно поступает раствор NaCl, а из катодного вытекает раствор, содержащий смесь NaCl и NaOH. При выпаривании раствора NaCl выкристаллизовывается, а NaOH остаётся в растворе. NaOH отделяют от NaCl и выпаривают до полного удаления воды. Полученный гидроксид натрия сплавляют и отливают в формы. Побочными продуктами являются водород и хлор.
Если катодом служит ртуть, то у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Полученную при электролизе амальгаму разлагают горячей водой, при чём получается гидроксид натрия и выделяется водород и освобождается ртуть. Этим методом можно получить чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Задача 974.
Как путем электролиза раствора хлорида калия получить гидроксид, гипохлорит и хлорат калия? Написать уравнения происходящих реакций.
Решение:
а) Электролиз (Elektrolyse) раствора хлорида калия – соли образованной при взаимодействии активного металла и бескислородной кислоты протекает предсказуемо. В данном случае на электродах выделяется водород (катод) и хлор (анод). А в растворе постепенно накапливается соответственно щелочь (КОН).
Стандартный электродный потенциал системы К + + 1 
Катод: 2Н2О +2 
а ионы К + , приходящие к катоду будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление ионов хлора Cl ¯ , приводящее к выделению газообразного хлора:
2Сl ¯ + 2 
2Cl 0 = Cl2 0 ↑
Поскольку отвечающей этой системе стандартный электродный потенциал (1,359 В), хотя и больше, чем стандартный электродный потенциал системы: 2Н2О = О2↑+ 4Н + + 4 

По окончании электролиза жидкость у катодного пространства выпаривают. При его выпаривании выкристаллизовываются хлорид калия и остаётся почти чистый гидроксид калия, который выпаривают до полного удаления воды. Затем, гидроксид калия сплавляют в формы. Побочными продуктами электролиза являются газообразные водород и хлор.
б) Получение гипохлорита калия. Для получения гипохлорита калия нужно, выделяющийся при электролизе хлорида калия газообразный хлор, пропустить через раствор гидроксида калия у катодного пространства. При пропускании хлора через исходный раствор едкого калия образуется гипохлорит калия:
в) Для получения хлората калия нужно пропустить хлор в горячий раствор гидроксида калия, получим:
Поскольку хлорат калия малорастворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Источник