Электролиз
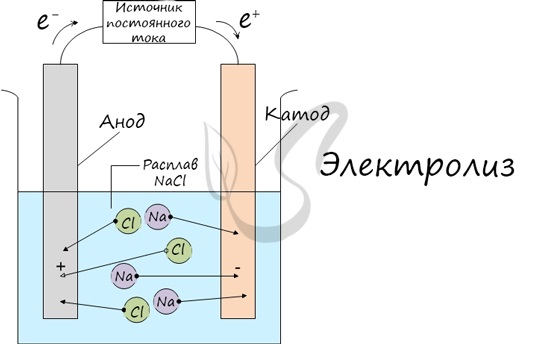
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
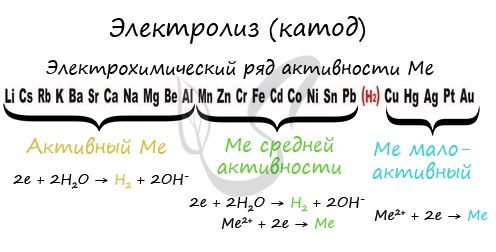
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
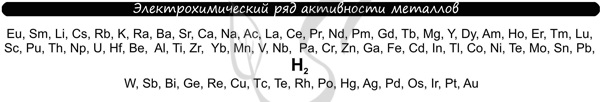
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
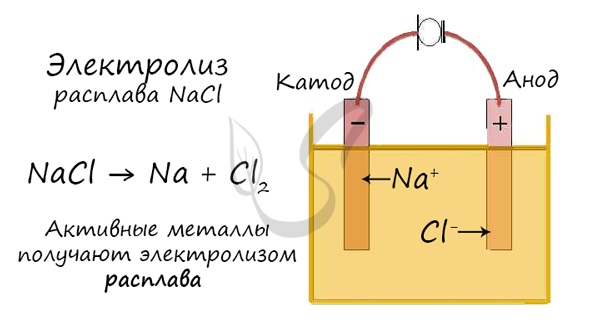
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Получение натрия
Получение натрия на производстве

В лабораторных условиях натрий получают электролизом расплавленной поваренной соли, но реакция ведеться при повышенной температуре и практически не применим без специального оборудования.
В 1807 г. Гемфри Деви впервые получил металлический натрий путем электролиза едкого натра. Однако этот способ долго не мог получить промышленного применения из-за отсутствия мощных источников электрического тока.
Поэтому после открытия натрия и изучения его свойств, имеющих несомненно весьма важное значение, стали разрабатываться способы получения натрия путем химического восстановления его соединений (едкого натра, соды, поваренной соли) действием углерода или расплавленного чугуна при высокой температуре. Натрий получался при этом в виде паров, которые отгонялись из печей и конденсировались при охлаждении. Техническое значение получили лишь немногие способы. Так, промышленное производство натрия было начато в 1856 г. Сен-Клэр-Девиллем, когда им стал применяться натрий вместо калия для получения металлического алюминия из двойной соли 3NaCl • АlСl3. Девилль получал натрий химическим путем из солей натрия при взаимодействии их с углеродом. В течение 30 лет по способу Девилля вырабатывалось 5-6 т натрия в год и было выпущено в общей сложности около 200 т натрия.
Химические способы получения натрия оказались неэкономичными из-за огромного расхода угля и солей и весьма быстрого разрушения аппаратуры. Поэтому с развитием электротехники стали внедряться в производство способы получения натрия электролизом.
В 1890 г. Кастнер разработал и стал применять способ получения натрия электролизом расплавленного едкого натра. Замеча тельно, что Кастнеру с самого начала удалось разработать совершенную, простую и удобную аппаратуру, а также удачно подобрать условия ведения процесса. Вследствие этого предложенный Кастнером щелочной способ с некоторыми усовершенствованиями в течение 30—35 лет был единственным способом промышленного получения натрия и до настоящего времени сохранил свое значение в некоторых странах. К таковым относится производство натрия, кроме СНГ , в Норвегии, Японии и, по-видимому, во Франции. В Англии щелочной способ существовал с 1902 до 1952 г. и был преобладающим.
Однако основное сырье для щелочного способа — едкий натр, который получают из поваренной соли, является дорогим продуктом. Поэтому, наряду со щелочным способом, с середины XIX в. изучалась возможность получения натрия непосредственно электролизом расплавленной поваренной соли (солевой способ). Этот способ оказался технически сложнее.
Промышленные установки для получения натрия электролизом расплавленной поваренной соли появились в 1910 г., а в период 1915—1925 гг. солевой способ начал получать распространение. Химические способы постепенно утратили свое значение.
Были попытки применить в качестве сырья для получения натрия селитру (нитрат натрия). Однако электролиз расплавленного NaNО3 не получил практического развития вследствие отсутствия каких-либо преимуществ перед щелочным способом и ввиду ряда технических затруднений.
Большое значение в последние годы было уделено вакуумтермическим способам восстановления соды или поваренной соли углем, карбидом кальция, кремнием, алюминием и силикоалюминием до натрия. Но ввиду сложности аппаратуры и эти способы практического значения пока не получили.
Получение натрия из едкого натра

Металлический натрий, будучи в 2 раза легче расплавленного каустика, всплывает на его поверхность, откуда и извлекается.
Рис. 2. Диаграмма плавкости системы NaOH—Na2CО3:
1 — по данным Неймана и Бергве; 2 — по данным Алабышева и Лантра това.
Основные реакции электролиза едкого натра осложняются рядом побочных процессов. Так как натрий и вода растворяются в расплавленном электролите, а при температуре электролиза происходит энергичное перемешивание всего электролита, то натрий и вода имеют возможность реагировать друг с другом, образуя водород и едкий натр
Следовательно, из четырех атомов натрия, получающихся по реакции, половина может реагировать с водой. Значит в этом случае теоретически возможно получение натрия только с выходом по току, равным 50%.
При электролизе могут происходить также и другие. Натрий, всплывая на поверхность электролита при температуре электролиза (около 300°С), может частично окисляться кислородом воздуха, хотя он и защищен тонким слоем расплава и находится в восстановительной атмосфере водорода.
Натрий вступает в реакцию не только с водой и кислородом воздуха, но. также с примесями в техническом каустике, например с Fe 2О3, а при высокой температуре — с каустиком. В последнем случае образуется гидрид натрия и окись натрия:
Все эти побочные реакции могут снижать выход по току до 40—30%. Чтобы увеличить выход по току, нужно иметь электролизер правильной конструкции и соблюдать точный технологический режим электролиза. Конструкция ванны и режим процесса должны быть таковы, чтобы обеспечить главным образом понижение растворимости натрия в католите и максимальное удаление воды из анолита. Так как совершенно исключить растворение натрия и воды в электролите нельзя, то необходимо добиться такого обмена катодного и анодного расплава, чтобы обеспечить протекание реакции их взаимодействия преимущественно в катодном пространстве. Если реакция будет происходить у анода, где по реакции образуется и кислород, то в ванне при электролизе будут происходить частые и сильные взрывы гремучей смеси.
Растворимость натрия в электролите зависит от температуры электролита, а скорость растворения — от величины поверхностей катода и зеркала натрия в сборнике, от примесей в электролите.
О повышением температуры растворимость резко возрастает. Поэтому высокий выход по току возможен только при поддержании возможно низкой температуры католита. Для снижения температуры плавления электролита к едкому натру добавляется 12—14% кальцинированной соды Na 2CО3. Кроме того, для отвода избыточного тепла, выделяющегося при электролизе, католит следует искусственно охлаждать, например, пропусканием воздуха через специальные каналы в корпусе ванны или в катоде.
Впервые диаграмма плавкости системы NaOH—Na 2CО3 была изучена в 1913 г. М. С. Максименко, а впоследствии Б. Нейманом.
Ввиду расхождения данных плавкость системы NaOH—Na 2CО3 вновь была проверена А. Ф. Алабышевым и М. Ф. Лантратовым. Результаты представлены на рис. 129. Чистый едкий натр плавится при 318,2° С. Система имеет эвтектику при 17,6 вес. % Na 2CО3 и 291,8° С, что оказалось близким к данным М. С. Максименко. Установлено также, что лучшие выходы по току получаются в электролите, содержащем 12—19% Na 2CО3.
Скорость растворения в католите натрия зависит, как уже указывалось, также от величины поверхностей катода и натрия в сборнике и составляет 0,11 г с 1 см 2 этих поверхностей в 1 ч при 305° С и 0,17 г с 1 см 2 в 1 ч при 320° С. Следовательно, для уменьшения количества растворяющегося натрия необходимо уменьшить эти поверхности. Поверхность катода может быть уменьшена повышением катодной плотности тока. Чтобы не увеличивать при этом напряжение на ванне за счет роста падения напряжения в электролите, катод делается в виде «гребенки» из отдельных стержней или полос, увеличивающих сферу действия катода и уменьшающих среднюю плотность тока в сечении электролита.
Из вредных примесей, находящихся в электролите, необходимо отметить силикаты, а также соли кальция и окислы железа. В их присутствии на катодах образуются трудноотделимые губчатооб разные корки, приводящие к существенному увеличению скорости растворения натрия. Каустик, применяемый для электролиза, должен быть возможно чище в отношении этих примесей.
Вода, образующаяся у анода, частично испаряется и уносится из ванны с выделяющимся кислородом, но большая часть ее остается в анолите. Удалению воды способствует повышение тем пературы анолита. Для этого некоторые исследователи предлагав повышать анодную плотность тока. Однако одна эта мера мало эффективна для повышения температуры анолита; она одновременно приводит к возрастанию напряжения на ванне. Более правильным является увеличение мощности на единицу объема анолита. Этого можно достигнуть созданием малого объема анодного пространства путем устройства специальных анодных карманов. В этом случае анолит будет содержать влаги больше, чем весь электролит, что приводит также к возрастанию количества удаляемой из ванны воды. Большой же разницы в температурах анолита и католита при бурном перемешивании расплава получить практически нельзя.
Очень важное значение для повышения выхода по току имеет создание условий правильного обмена между анолитом и католитом. Во-первых, обмен этот должен быть таким, чтобы взаимодействие натрия с водой происходило преимущественно в катодном пространстве. При этом взрывы гремучей смеси происходят редко, а выделяющийся в катодном пространстве водород (католит слабо «кипит» от выделяющегося водорода) создает восстановительную атмосферу и защищает натрий от окисления.
Во-вторых, обмен католита и анолита должен быть таким, чтобы количество влаги, поступающей в катодное пространство с анолитом, было эквивалентно количеству растворившегося за это же время натрия. При более энергичном обмене попадающая из анолита влага будет реагировать не только с растворенным натрием, но и с натрием в сборнике, снижая выход по току. Если же обмен недостаточен и воды поступает с анолитом меньше, чем необходимо для связывания растворенного натрия, то католит насыщается натрием. Легкое насыщение не вредно, но при большом насыщении, при существенном недостатке воды, возможна реакция.
Потребление натрия резко возрастает. Растет и температура процесса, а катоды покрываются тугоплавкой и трудноотделимой коркой, состоящей в основном из Na 2О. И то и другое приводит к возрастанию количества растворяющегося натрия. Так как выделение водорода прекращается, то металл легче окисляется. Все это ведет к снижению выхода по току. Правильный обмен между католитом и анолитом достигается устройством диафрагмы — металлической сетки между анодом и катодом.
До начала электролиза каустик должен быть хорошо обезвожен. В присутствии воды в электролите будет идти процесс электролиза воды, как это следует из измерений обратной э, д. с. при
320—330° С в зависимости от плотности тока, по данным М. С. Максименко. Наблюдаемый на кривой первый излом при 1,35 в соответствует разложению воды, второй излом при 2,25 в —разложению NaOH.
Удельная электропроводность чистого NaOH при 320° С равна 2,18 ом -1 • см -1 и изменяется с температурой почти прямолинейно. Содержание соды и поваренной соли снижает электропроводность электролита. Поэтому допускать содержания соды в нем выше 20% нельзя. К тому же и температура плавления электролита при содержании соды свыше 17% возрастает.
Наилучшими условиями электролиза являются: температура 300—305°С; содержание соды от 12 до 20%; SiО2 не более 0,2%; окислов железа и кальция только следы; высокая катодная плотность тока при небольшой анодной плотности тока; хорошее
охлаждение католита; малый объем анолита и создание правильного обмена между катодным и анодным расплавом путем подбора металлической сетки.
Получение натрия электролизом поваренной соли

При электролизе на катоде разряжаются ионы Na + с образованием металлического натрия, а на аноде идет разряд ионов Сl — и образуется газообразный хлор. На практике эта простая первичная схема электролиза осложняется рядом побочных процессов, а также обстоятельств, затрудняющих осуществление производственного процесса. Основная сложность процесса заключается в том, что хлорид натрия плавится при 800° С, а натрий имеет температуру кипения около 883° С; выше 800°С давление паров натрия настолько высоко, что он почти полностью испаряется. Кроме того, при этих температурах натрий энергично растворяется в расплаве и начинает реагировать с кислородом воздуха и с веществами, входящими в состав футеровки ванн.
Рис. 3. Диаграмма плавкости системы:
Большие затруднения встречаются при выборе материала для аппаратуры, который должен быть стоек при высоких температурах по отношению к таким химически активным веществам, как хлор и натрий.
Хороший выход по току можно получить только при снижении температуры электролиза. Этого можно достигнуть добавлением к поваренной соли других соединений, образующих с NaCl низкоплавкие смеси. В то же время эти соединения не должны участвовать в электролизе во избежание загрязнения полученных натрия и хлора другими веществами. Добавляемые соли не должны вместе с тем резко увеличивать растворимость натрия в расплаве и снижать электропроводность электролита.
Необходимо также в качестве добавки в NaCl применять легкодоступные и дешевые вещества. При выборе солевых добавок следует исключить все соединения, катион которых более электроположителен, чем Na. Соединения стронция, лития, рубидия и цезия из-за высокой стоимости не могут иметь практического значения. Такие соединения как сульфаты, карбонаты, нитраты и гидроокиси, содержащие кислород, изменяют анодный процесс, поэтому не могут применяться в качестве добавок. Бромиды и иодиды дороги и применение их также будет влиять на анодный процесс. Фториды бария и кальция имеют высокую температуру плавления.
В результате для выбора добавок к поваренной соли, пригодных для технического электролиза, остаются лишь хлориды К, Са и Ва и фториды Na и К.
Более подробное изучение физико-химических свойств этих см сей солей (плавкость, растворимость натрия в них, электропроводность и т, п.) указывает, что для практики наиболее пригодны три типа электролитов:
1. Фтористый, состоящий из 62,5% NaCl, 25% NaF и 12,5% KCl. Температура плавления такого электролита около 570° С, что позволяет вести электролиз при 650—670° С.
2. Смесь хлоридов натрия
42% и кальция 58% Этот электролит, по литературным данным, получили наибольшее распространение за рубежом. Из диаграммы плавкости системы NaCl— СаСl2, представлен ной на рис. 3 , видно, что эвтектическая смесь этих со лей имеет температуру плавления 505° С, что позволяет вести электролиз при 580 630° С при некоторых колебаниях смеси по содержанию СаСl2.
3. Добавкой к смеси хлоридов натрия и кальция хлорида бария удается снизить температуру плавления электролита еще на 50° С. Таким образом, тройная смесь, состоящая из 32—40% NaCl 36—42% СаСl2 и 22—26% ВаСl2 является наиболее легкоплавки электролитом для получения натрия из поваренной соли.
Растворимость натрия при 600° С во всех трех электролитах не велика и выход по току при подходящих условиях может достигать 75 —80%. Фтористый электролит имеет более высокую электропроводность, чем хлористый. Однако фтористые добавки расходуются в значительных количествах (около 120 кг на 1 т натрия), так как они, по-видимому, вступают во взаимодействие с материалами футеровки электролизера и графитовым анодом. В свою очередь недостатком хлористого электролита является гигроскопичность СаСl2, требующая предварительного обезвоживания его и способствующая образованию шлама в ванне. Однако более низкая температура электролиза в хлористых электролитах способствует повышению выхода по току и удлиняет срок службы материалов ванны.
Существенным является также поддержание постоянства состава электролита в процессе электролиза, что легче осуществить при хлористых добавках к NaCl.
Недостаток фтористого электролита — необходимость поддерживать низкую анодную плотность тока из-за склонности фтористого электролита к анодным эффектам.
Вредными примесями в электролите при получении натрия из NaCl являются сульфаты и соли железа, приводящие к резкому снижению выхода по току. Особенно вредны присутствие влаги в электролите и образование окислов натрия вследствие окисления металла кислородом воздуха на поверхности плава.
Графитовый анод, стойкий к сухому хлору, быстро разрушается в присутствии влаги и кислородных соединений натрия, особенно при повышенных температурах. Образующиеся при этом СO2 и СО загрязняют анодный хлор и затрудняют его использование.
Поэтому следует тщательно обезвоживать электролит и загружать его в ванны расплавленным или хорошо подсушенным. Во избежание окисления натрия катодное пространство следует тщательно герметизировать и предупреждать всплывание натрия вне сборника.
Свойства применение натрия
Масштабы получения и применения щелочных металлов пока не велики и находятся в противоречии с большими запасами их в земной коре. В то же время щелочные металлы обладают рядом весьма ценных свойств, среди которых главнейшим является их высокая химическая активность. Это же свойство щелочных металлов служит основным препятствием при производстве их. Наибольшее значение среди щелочных металлов имеет натрий.
Натрий — металл с температурой плавления 97,83° С и температурой кипения 883° С. Плотность твердого натрия равна 0,97 г/см 3 , а расплавленного в зависимости от температуры может быть рассчитана по уравнению:
В земной коре натрия содержится 2 ,64 вес. % и встречается он главным образом в виде хлорида натрия как в каменной соли, так и в растворенном виде в водах соляных озер и морей. В значительных количествах натрий встречается в виде сульфата натрия (мирабилит), в виде бората, нитрата, а также входит в состав многих минералов.
В настоящее время в основном металлический натрий применяется в производстве тетраэтилсвинца, как антидетонатора при получении высокооктанового моторного топлива, кроме того, его используют для производства чистых цианидов, синтетических моющих средств — детергентов, перекиси натрия, синтетического каучука, индиго, гидрида натрия, фармацевтических препаратов и других продуктов неорганического и органического синтеза. Натрий как восстановитель используется для получения металлического калия и различных тугоплавких металлов. Применяется натрий также для модификации в раскислении сплавов цветных металлов, специальных сталей и для производства безоловянистых антифрикционных сплавов. За последнее время появился повышенных интерес к натрию и его сплавам с калием как к эффективным теплоносителям для атомных реакторов.
Промышленным методом получения натрия в настоящее время является исключительно электролиз его расплавленных соединений— едкого натра или поваренной соли. До 1925 г. почти 100% натрия получали электролизом расплавленного каустика. Но уже в 1930 г. этим методом было выпущено лишь 50% мирового производства натрия. Остальные 50% получали из поваренной соли. В 1940 г. эти доли составляли соответственно 15 и 85%, а в 952 г. — 5 и 95 %.
В СНГ существуют оба метода.
Статья на тему Получение натрия
Похожие страницы:
Понравилась статья поделись ей
Источник