Технология производствa магния.



Основной способ производства магния — электролитический. Электролитическое получение магния из водных растворов невозможно, так как электрохимический потенциал магния значительно более отрицательный, чем потенциал разряда ионов водорода на катоде. Поэтому электролиз магния ведут из его расплавленных солей.
Основная составляющая электролита — хлористый магний МgCl2, а для снижения температуры плавления электролита и повышения его электропровод-ности в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2.
Основным сырьем для получения магния являются карналлит (МgСl2•КСl•6Н2О), магнезит (МgСО3), доломит (СаСО3•МgСО3), бишофит (МgСl2•6Н2О). Карналлит — это природный хлорид магния и калия MgCl2 • КСl • 6Н2O. Бишофит (MgCl2 • 6Н2O) получается при переработке карналлита или выпари-вается из воды соленых озер и морей. Наибольшее количество магния получают из карналлита.
Основные этапы производства магния:
1.Карналлит;
2. Обогащение карналлита;
3. Обезвоживание карналлита;
4. Электролитическое получение магния;
5. Рафинирование магния;
6. Магний.
Обогащение карналлита является первой стадией его переработки. Сущность процесса обогащения сводится к отделению КСl и нерастворимых примесей путем перевода в водный раствор МgСl2 и КСl. При охлаждении полученного раствора в вакуум-кристаллизаторах выпадают кристаллы искусственного карналлита МgСl2•КСl•6Н2О, которые отделяют фильтрованием.
Карналлит обезвоживают в две стадии. Первую стадию проводят в трубчатых печах или печах кипящего слоя при 550—600° С. Под действием теплоты нагретых газов карналлит обезвоживается и после такой обработки содержит 3—4% влаги.
Вторую стадию обезвоживания осуществляют либо плавкой полученного после первой стадии карналлита в электропечах с последующим отстаиванием окиси магния, либо хлорированием карналлита в расплавленном состоянии.
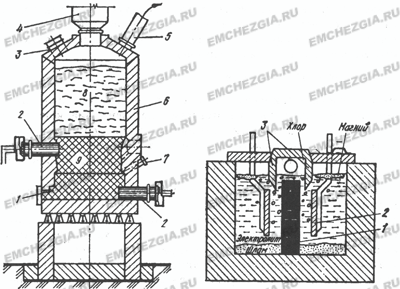
Этот способ производства хлорида магния заключается в хлорировании магнезита или оксида магния, получаемого путем предварительного обжига магнезита. Процесс ведут в шахтных электрических печах. В нижней части (рис. 1) расположены в два ряда электроды 2; между ними находятся угольные брикеты, которые при прохождении электрического тока нагреваются до
750 °С. Шихту загружают сверху, через фурмы 7 вдувают хлор.
У фурм происходит хлорирование оксида магния: MgO + Сl2 + С = MgCl2 + СО. Хлористый магний плавится и скапливается на подине, периодически его выпускают в ковш и транспортируют в электролизный цех.
Рисунок 1. Рисунок 2.
Шахтная печь для производства магния: . Схема магниевого диафрагменного
1 — летка; 2 — угольные электроды; электролизера.
3 — ремонтный люк;
4 — загрузочное устройство;
б — футеровка; 7 — хлорные фурмы;
8 — шихта; 9 — угольные брикеты
Электролитическое получение магния. Для этой цели применяют электролизер (рисунок 2), который изнутри футерован шамотным кирпичом. Анодами служат графитовые пластины 1, а катодами — стальные пластины 2, расположенные по обе стороны анода.
Для электролитического разложения хлористого магния через электролит пропускают ток под напряжением 2,7—2,8 В.
Электролитическое получение магния осуществляют в электролизере (рис. 2). Анодами служат графитовые пластины 1, а катодами — стальные пластины 2. Удельная плотность магния меньше удельной плотности электролита, и поэтому магний всплывает. Хлор, выделяемый на аноде, тоже всплывает. Чтобы избежать взаимодействия хлора с Mg, а также короткого замыкания анода и катода расплавленным магнием, вверху устанавливают специальную разделительную диафрагму 3.
Электролит состоит из МgСl2 (5—17 %), KCl, NaCl и добавок СаF2 и По мере расходования МgСl2 в электролизер периодически заливают жидкие карналлит либо хлористый магний. Электролиз ведут при 670—720 °С. На катоде выделяется магний: Мg2+ + 2е —>на аноде — газообразный хлор 2Cl- — 2е —> Cl2. Из электролизера откачивают хлор и 2—3 раза в сутки с помощью вакуум-ковшей с электрообогревом извлекают жидкий магний.
В процессе электролиза в электролите повышается концентрация других хлоридов за счет расходования МgСl2. Поэтому периодически часть отработанного электролита удаляют из ванны и вместо него заливают расплав МgСl2 или карналлита. В результате частичного разложения примесей на дне ванны образуется шлам, который регулярно удаляют из ванны.
Рафинирование магния. В электролизных ваннах получают черновой магний, который содержит 5% примесей: металлические примеси (Fе, Na, К, Аl, Са) и не металл примеси (МgСl2, КСl, NaCl, СаСl2, МgО). Магний очищают (рафинируют) переплавкой с флюсами.. Это наиболее распространенный способ, заключающийся в выдержке магния в печах сопротивления под слоем флюса. При этом происходит отстаивание (переход в осадок) запутавшихся в расплаве частиц электролита и шлама.
Источник
Производство магния
В современном машиностроении магний находит широкое применение главным образом как основа легких сплавов. Для получения металлического магния применяют два способа — электролитический и термический. В качестве исходных материалов используют магнезит, доломит, карналлит и бишофит. Магнезит является карбонатом магния (MgCO3), содержащий 28,8% Mg. В природном магнезите, кроме MgCO3, обычно содержатся окислы кремния, железа, алюминия и кальция. В нашей стране имеются большие залежи магнезита на Урале (Саткинское и Халиловское месторождения).
Доломит представляет собой двойной карбонат магния и кальция (MgCO3*CaCO3), содержащий 13,2% Mg. Доломит содержит примеси в виде кварца, кальцита, гипса и др. Наиболее крупные промышленные месторождения доломита находятся в Московской области, на Урале и на Украине.
Карналлит является природным хлоридом магния и калия (MgCl2*KCl*6Н2O), в зависимости от содержания тех или иных примесей имеет розовый, желтый или серый цвет. Карналлит является гигроскопическим материалом, активно поглощающим влагу. В карналлите содержится 8,8% Mg. Крупнейшие залежи карналлита находятся на Урале (Соликамское месторождение).
Бишофит представляет собой хлорид магния (MgCl2*6Н2О), в природе содержится в морской воде, около 0,3% в воде соляных озер. В некоторых озерах нашей страны, например озера Перекопской группы, к концу лета содержание MgCl2 достигает 15%. Бишофит также получают при переработке природного карналлита.
Электролитическим способом получают магний из хлоридов магния.
Для этой цели магнезит или доломит подвергают обжигу при температурах 700—800° С. Во время обжига магнезит диссоциирует
Хлорирование окиси магния осуществляют в шахтных электрических печах, футерованных шамотным кирпичом. Во время хлорирования в печь, кроме окиси магния, загружают угольные цилиндрики, а через фурмы, расположенные внизу печи, подают хлор. Электроды в печи располагают друг к другу под углом 120°. При работе печи развивается максимальная температура до 1000° C. В печи образовавшийся хлористый магний расплавляется и периодически, через 3—4 часа, выпускается в ковш с плотно закрывающейся крышкой и в последнем транспортируется в цех электролиза.
Карналлит подвергают обезвоживанию и расплавлению. Обезвоживание обычно производят в трубчатых вращающихся печах при температуре газов на входе до 450° С и на выходе до 220° С. Плавление ведут в трехфазных электропечах при температуре 750—800° С. Во время выдержки из расплава оседает на дно печи MgO, а в расплаве остается до 50% MgCl2, 0,5—0,7% MgO, остальное KCl и NaCl. Полученный расплав направляют на электролиз. Бишофит также подвергают обезвоживанию и расплавлению.
Получение магния из хлоридов магния ведут в электролизных ваннах. Схема электролизера приведена на рис. 22. В ван не анодами являются графитовые электроды, катодами — стальные пластины. Электролитом служит расплав солей MgCl2, KCl, NaCl, CaCl2. Во время электролиза электрический ток, проходя через электролит, нагревает его до температуры 700—750° С. При этих температурах MgCl2 разлагается и в катодном пространстве выделяется магний, а в анодном хлор. Плотность электролита больше плотности магния, поэтому магний всплывает на поверхность ванны. Отсюда магний при помощи вакуума перекачивается в ковш. Выделяющийся хлор отсасывают через хлоропровод. В процессе электролиза образующаяся окись магния и восстановленное железо осаждаются на дно ванны. Их периодически удаляют.
При электролизе расходуется 20—25 кг электродов и 15000—17000 квт*ч электроэнергии на 1 т магния.
Полученный процессом электролиза магний обычно содержит примеси: Fe, Na, К, CaCl2, MgCl2, NaCl, KCl, MgO. Примеси отрицательно влияют на механические свойства и коррозионную стойкость магния. Поэтому электролитический магний рафинируют.
Рафинирование магния производят или переплавкой с флюсами или возгонкой магния.
Рафинирование магния переплавкой с флюсами производят в электропечах сопротивления или при пламенном обогреве со стационарным или выемным тиглем. Печь футеруют шамотным кирпичом, а тигли изготовляют из чугуна или стали. В качестве флюса используют хлористые и фтористые соли (MgCl2; KCl; BaCl; NaCl; CaCl; CaF). После расплавления и нагрева металла до 700— 750° С его перемешивают с флюсом. Затем металл охлаждают до 690—710° С и из-под слоя шлака разливают в чушки. Этот способ рафинирования дает возможность очищать магний только от неметаллических примесей. После рафинирования получают металл с содержанием 99,85—99,9% Mg.
Рафинирование магния возгонкой основано на значительной упругости паров его. Упругость паров примесей, к которым относятся железо, кремний, медь и алюминий, меньше упругости паров магния.
Рафинирование возгонкой ведут в герметически закрытых ретортах со ступенчатым вакуумом (рис. 23). При температуре 600° С и остаточном давлении 0,1—0,2 мм рт. ст. магний испаряется. В зоне конденсации при температуре 450—500° С магний оседает на стенках реторты в виде друз — чистых блестящих кристаллов.
Друзы магния отделяются, затем переплавляются, после чего магний разливается на чушки. Металл содержит 99,99% Mg.
Электролитический способ получения магния является трудоемким и вредным производством. Поэтому в последние годы находят применение термические способы получения магния. Термические способы подразделяются на силикотермический, карбидно-термический и углетермический. В основу этих способов положены процессы восстановления магния из обожженного магнезита или доломита. При силикотермическом способе восстановителем служит кремний. Восстановление магния происходит по следующей реакции:
В качестве исходного материала используют доломит, ферросилиций или сплавы кремния с алюминием. Восстановление ведут в ретортах из нержавеющей стали под вакуумом до 0,1 ат, соединенных с кристаллизаторами. Реторты нагревают в электропечах или пламенем за счет сжигания топлива. При нагреве материала до 1100—1200° С в вакууме магний восстанавливается, испаряется и конденсируется (кристаллизуется) на стенках в кристаллизаторах. В реторту загружают 3,5—4,0 г шихты и получают 500—600 кг магния. На восстановление магния из 5 г доломита расходуют 1 г 75%-ного ферросилиция.
При карбидно-термическом способе в качестве исходных материалов используют магнезит и карбид кальция. В процессе нагрева такой смеси в ретортах под вакуумом до 1100—1200°С протекает реакция
Магний, испаряясь в кристаллизаторе, конденсируется, окись углерода отводится, а окись кальция остается в реторте в виде твердой фазы.
Восстановление магния углетермическим способом ведут в специальных дуговых печах при температуре выше 2000° С. При этих температурах протекает реакция
Источник
Основы металлургии магния
Металлический магний впервые получил Деви в 1808 г. Он подвергал электролизу с ртутным катодом водный раствор соли магния и получил сплав ртути и магния – амальгаму. Испарением ртути удалось выделить небольшое количество металла, сильно загрязненного примесями.
Позднее Бунзен (1852 г.) выделил магний электролизом расплавленного хлорида, и на основе этого в 1908 г. было начато промышленное производство магниевых сплавов.
Свойства магния
Магний относится ко II группе периодической системы Д.И. Менделеева. Атомная масса магния 24,32. По химическим свойствам магний относится к щелочноземельным металлам.
Магний плавится при 651 ºС и кипит при 1107 ºС. Полиморфных модификаций магний не имеет и во всем интервале температур ниже точки плавления сохраняет гексагональную плотноупакованную структуру с соотношением осей с/а (1,6235), почти равным теоретическому значению (1,633). Атомный диаметр магния равен 0,32 нм. Магний относится к наиболее легким конструкционным металлам; его плотность равна 1,74 г/см 3 при 20 ºС.
Удельная теплоемкость магния примерно такая же, как у алюминия, а скрытая теплота плавления в два раза ниже. Теплопроводность магния в полтора раза меньше, чем у алюминия, но больше, чем у стали. Коэффициенты линейного расширения магния и алюминия примерно одинаковы. Электросопротивление магния почти в два раза больше, чем у алюминия. Магний – парамагнитный металл.
Магний незначительно захватывает тепловые нейтроны. Сечение захвата тепловых нейтронов для него равно 5,9 · 10 -26 см 2 .
Модули Юнга и сдвига магния невелики и составляют всего 44,1 ГПа и 17,85 ГПа. Они обнаруживают заметную анизотропию. Магний при низких температурах обладает невысокой пластичностью. При низких температурах скольжение происходит лишь по плоскостям базиса (0001). При нагреве до 200…300 ºС в магнии появляются дополнительные плоскости скольжения <1011>и <1120>и пластичность сильно возрастает. Во всех случаях скольжение осуществляется в направлениях . Пластическая деформация осуществляется также двойникованием по плоскостям <1012>. Прочностные свойства магния при комнатной температуре выше, чем у алюминия.
Магний – химически активный металл. Свежая поверхность металла серебристо-белого цвета, но она быстро тускнеет из-за окисления магния на воздухе с образованием оксидной плёнки. При низких температурах оксидная плёнка аморфна, но при нагреве выше 200 ºС приобретает кристаллическое строение. При температурах ниже 450 ºС толщина оксидной пленки невелика; она сравнительно плотная и обладает определенными защитными свойствами против окисления. При более высоких температурах резко возрастает скорость окисления магния, оксидная пленка становится рыхлой, пористой, поэтому облегчается доступ кислорода к поверхности металла. При нагреве на воздухе до температур выше 623 ºС магний воспламеняется и горит, излучая ослепительный яркий свет. Оксидная пленка на магнии не обладает достаточными защитными свойствами, потому что плотность MgO значительно больше, чем магния.
Магний легко растворяется во всех разбавленных минеральных кислотах, с трудом – в концентрированной серной и совсем не взаимодействует с плавиковой, энергично реагирует со многими органическими кислотами.
Магний устойчив в керосине, бензине, минеральных маслах, фреоне, феноле, спиртах (кроме метилового).
Магний растворяет большие количества водорода. При температуре кристаллизации в жидком магнии растворяется около 50 см 3 /100 г водорода, а в твердом – около 20 см 3 /100 г.
Железо, медь, кобальт, кремний и никель резко ухудшают коррозионную стойкость магния. Легирование магния цирконием и марганцем повышает его коррозионную стойкость. Наилучшим способом защиты магния и его сплавов от коррозии является нанесение на поверхность изделий плотных тончайших оксидных пленок или тонких лакокрасочных покрытий.
Магниевые сплавы удовлетворительно свариваются различными методами сварки: дуговой сваркой с нерасходуемым вольфрамовым электродом в защитной среде из инертных газов, контактной точечной и роликовой сваркой.
Сырье для производства магния
Магний значительно распространен в земной коре, кларк его 2,35 %. Существенная доза запасов магния находится в воде морей и океанов, содержащей в среднем 0,3 % MgCl2, 0,04 % MgBr2, 0,18 % MgSO4. По ориентировочным подсчетам, в гидросфере имеется 1,85 · 10 15 т магния, однако из-за малой концентрации добыча его из морской воды обходится дорого и применяется в странах, бедных другими видами сырья (США, Норвегия, Англия).
Пригодные для производства ископаемые соединения магния – карналлит KCl · MgCl2 · 6H2O, магнезит MgCO3 и доломит MgCO3· CaCO3 в изобилии находятся в недрах Российской Федерации. В России около 80 % магния получают из карналлита и 20 % из магнезита.
Карналлит – гигроскопическая ископаемая соль, содержащая наряду с магнием калий, а также примеси хлористого натрия и бромидов. Руду, добытую из недр, называют карналлитовой породой или естественным карналлитом.
Естественный карналлит подвергают гидрохимическому обогащению, основанному на меньшей растворимости NaCl по сравнению с KCl и MgCl2. Дробленую породу растворяют при 110 ºС в оборотном растворе хлористого магния (32 % MgCl2). Основное количество NaCl остается в виде кристаллов и отделяется на ситах. Раствор направляют в вакуум-кристаллизаторы. Из полученной здесь пульпы кристаллов искусственный карналлит выделяют в отстойниках, а затем центрифугируют. Он имеет примерно следующий состав: 32 % MgCl2; 25 % KCl; 6 % NaCl; 37 % H2O.
Извлечение магния в искусственный карналлит не превышает 75 %, поэтому не прекращаются поиски других, более выгодных процессов, в частности основанных на механическом обогащении.
Способы получения магния
Электролиз расплавленного хлорида
Способ электролиза расплавленного хлорида MgCl2 или расплава MgCl2 и KCl стал теперь основным в мировой практике. Для этого применяется ванна из огнеупорного кирпича в стальном кожухе. В середине ванны установлен графитовый анод, а по бокам – два стальных катода. Хлористый магний плавится при 718 ºС, расплав его состоит из ионов Mg 2+ и Cl – .
Ионы разряжаются на катоде:
Магний выделяется в жидком виде (температура плавления 651 ºС) и всплывает в электролите, собираясь на его поверхности; плотность жидкого магния около 1,47 кг/м 3 , а плотность жидкого MgCl2 1,68 кг/м 3 .
На аноде выделяется хлор:
пузырьки его также всплывают в электролите. Магний и хлор не должны встречаться: это привело бы к сгоранию магния в хлоре:
Для разделения продуктов электролиза в ванне устанавливают керамические перегородки – диафрагмы. Чтобы предупредить потери хлора и окисление магния кислородом воздуха, ванну закрывают керамической крышкой.
Присутствие в расплаве хлоридов щелочных металлов – калия и натрия – не изменяет ход электролиза: напряжение разложения этих солей выше, поэтому калий и натрий не выделяются на катоде вместе с магнием. Присутствие в расплаве даже небольших количеств воды вредит электролизу, так как хлористый магний при этом гидролизуется:
Окись магния выпадает в осадок и образует на дне ванны нежелательный для процесса шлам. Подобное действие оказывают примеси сульфата на восстановленный магний:
Примеси железа восстанавливаются легче магния и загрязняют его. Поэтому для производства магния электролизом нужен безводный его хлорид, не содержащий остаточной воды, сульфата и железа. Безводный хлористый магний можно получить обезвоживанием природных солей – бишофита MgCl2 · 6H2O и карналлита либо хлорированием магнезита.
Соли обезвоживают сушкой и переплавкой. Для хлорирования природный MgCО3 обжигают при температуре около 700–800 ºС, превращая его в каустический магнезит по реакции
Каустический магнезит смешивают с углем, брикетируют и обрабатывают хлором. Безводный хлористый магний получается в результате реакции
Получение хлористого магния из магнезита бывает выгоднее обезвоживания солей, если для этого можно использовать хлор, получаемый при электролизе карналлита.
Поэтому для производства магния электролизом расплавленного хлорида требуется предварительное получение из природного сырья достаточно чистого безводного хлористого магния.
Термические способы получения магния
Углетермический способ основан на реакции
Окись магния смешивают с мелким нефтяным коксом и брикетируют. Брикеты нагревают в среде водорода, предупреждающего доступ воздуха, в электрической печи при температуре около 2500 ºС. Магний получается в виде паров, смешанных с окисью углерода.
Выходящую из печи газовую смесь быстро охлаждают до 120 ºС, смешивая с большим количеством водорода или природного газа. Резкое охлаждение необходимо для «закаливания» газов, предупреждающего обратную реакцию – окисление паров магния окисью углерода. Магний конденсируется в тонкую пыль; ее улавливают из газов пылеуловителями и подвергают дистилляции в вакууме, получая твердый металл.
Для углетермического способа требуется сложная дорогая аппаратура, и он взрывоопасен: мелкая пыль магния склонна к самовозгоранию. Поэтому в современной практике этот способ применяется редко.
Силикотермический способ требует меньших температур и более простого оборудования. По этому способу окись магния восстанавливают в вакууме ферросилицием – сплавом железа и кремния.
В герметичных стальных ретортах, обогреваемых электричеством или газом до 1160–1170 ºС, нагревают брикеты из тщательно перемешанных порошков каустического доломита и ферросилиция. Каустический доломит – смесь окислов CaO и MgO для силикотермического способа удобнее, чем чистая окись магния: входящая в доломит окись кальция способствует восстановлению.
Каустический доломит получают обжигом природного доломита при 1000–1100 ºС в трубчатых вращающихся печах.
В реторте протекает реакция
2MgO + 2CaO + Si(Fe) → Ca2SiO4 + 2Mg + Fe.
Магний удаляется в виде паров, а в реторте остаются полурасплавленный остаток силиката кальция и железо. Пары магния, охлаждаясь в конденсаторе, дают кристаллический осадок металла.
Этот способ сложен и дорог из-за большого расхода реторт. Реторты даже из дорогой хромоникелевой стали недолговечны. Силикотермический способ применяют в том случае, если отсутствуют месторождения хлоридов магния.
Получение хлорида магния
Магний широко применяют в виде сплавов с алюминием, цинком и марганцем для изготовления деталей авиационных и автомобильных двигателей. Магниевые сплавы обладают хорошими литейными свойствами, что дает возможность получать из них сложные отливки. Сплавы легко поддаются свариванию и обработке резанием.
Основными видами сырья для получения магния являются магнезит, доломит, карналлит и бишофит. Главной составляющей магнезита является MgCO3, а доломита CaCO3 • MgCO3. Карналлит — это природный хлорид магния и калия MgCl2 • KCl • 6Н2O. Бишофит (MgCl2 • 6Н2O) получается при переработке карналлита или выпаривается из воды соленых озер и морей. Наиболее распространен в настоящее время электролитический способ получения магния, при этом магний в процессе электролиза получается из вводимого в электролит хлорида MgCl2. Технология получения магния этим способом включает три стадии: получение безводного хлорида магния MgCl2, электролиз с выделением из хлорида жидкого магния, рафинирование магния.
Получение хлорида магния ведут тремя способами. Первый способ — обезвоживание карналлита MgCl2 • KCl • 6Н2O. Процесс осуществляют в две стадии. Первую проводят, нагревая карналлит в трубчатых вращающихся печах или печах кипящего слоя. Вторую — в основном в печах- хлораторах, имеющих плавильную камеру (печь сопротивления), где карналлит расплавляют при температурах 550—600 °С; две хлорирующие камеры, где продувкой хлором примеси (MgO) переводят в MgCl2 и копильник расплава (миксер). На некоторых заводах вторую стадию проводят в электрических печах сопротивления, где карналлит расплавляют при температуре
500 °С и сливают в миксер. В обоих случаях жидкий карналлит сливают из миксеров в ковш и везут в электролизный цех. Обезвоженный карналлит содержит, %: MgCl2 47-52; KCl 40-46; NaCl 5-8.
Второй способ получения хлорида магния заключается в хлорировании магнезита MgCO3 или оксида магния, получаемого путем предварительного обжига магнезита. Процесс ведут в шахтных электрических печах. В нижней части печи (рис. 250) расположены в два ряда электроды 2; между ними находятся угольные брикеты, которые при прохождении электрического тока нагреваются до
750 °С. Шихту (MgO или MgCO3) загружают сверху, через фурмы 7 вдувают хлор. У фурм происходит хлорирование оксида магния: MgO + Cl2 + С = MgCl2 + СО. Хлористый магний плавится и скапливается на подине, периодически его выпускают в ковш и транспортируют в электролизный цех.
Третий способ — это получение MgCl2 в качестве побочного продукта в процессе восстановления титана магнием из TiCl4 (см. ниже). Этот жидкий хлорид магния направляют в магниевое производство (магний и титан обычно производят на одном предприятии).
Электролитическое получение магния осуществляют в электролизере (рис. 251). Анодами служат графитовые пластины 7, а катодами — стальные пластины 2. Удельная плотность магния меньше удельной плотности электролита, и поэтому магний всплывает. Хлор, выделяемый на аноде, тоже всплывает. Чтобы избежать взаимодействия хлора с магнием, а также короткого замыкания анода и катода расплавленным магнием, вверху устанавливают специальную разделительную диафрагму 3.
Электролит состоит из MgCl2 (5—17 %), KCl, NaCl и добавок CaF2 и NaF. По мере расходования MgCl2 в электролизер периодически заливают жидкие карналлит либо хлористый магний. Электролиз ведут при 670—720 °С. На катоде выделяется магний: Mg 2+ + 2e → Mg, на аноде — газообразный хлор 2Cl — — 2е → Cl2. Из электролизера откачивают хлор и 2—3 раза в сутки с помощью вакуум-ковшей с электрообогревом извлекают жидкий магний.
В последнее время наряду с описанными выше диафрагменными электролизерами применяют бездиафрагменные.
Рафинирование магния осуществляют отстаиванием в печах, возгонкой или электролизом. Наиболее распространен первый способ, заключающийся в выдержке магния в печах сопротивления под слоем флюса. При этом происходит отстаивание (переход в осадок) запутавшихся в расплаве частиц электролита и шлама. Рафинирование возгонкой осуществляют путем испарения магния в вакууме при 900 °С. Испаряющийся чистый магний осаждается в конденсаторе. Электролитическое рафинирование магния схоже с аналогичным процессом рафинирования алюминия по трехслойному методу. В электролизере внизу у анода находится слой рафинируемого магния, выше — слой электролита, а над ним у катода накапливается чистый магний.
Применяют также термические способы получения магния с использованием в качестве восстановителя С, Si или СаС2. Из них проще силикотермический способ, при котором пользуются специальными ретортами из хромоникелевой жаропрочной стали, помещаемыми в электропечь, отапливаемую газообразным топливом. В качестве сырья лучше всего брать доломит MgCO3 • СаСО3, а в качестве восстановителя — кремний ферросилиция. Магний получается высокой чистоты.
Источник