- Аффинаж серебра в домашних условиях
- Что из себя представляет процедура аффинажа
- Способы
- Купелирование
- Электролитический способ
- Химический способ
- Необходимые материалы и инструменты
- Поэтапный электролиз серебра в домашних условиях
- Видео получения чистого серебра из зеркал (в 2 частях)
- Получение металлов
- Получение металлов и сплавов
- Металлы I и II групп
- Получение калия
- Получение кальция
- Барий
- Получение тугоплавких металлов
- Получение сплавов на жидком катоде
- Похожие страницы:
Аффинаж серебра в домашних условиях
Серебро постепенно становится самым популярным драгоценным металлом. В отдельных источниках уже с уверенностью говорят о том, что золото отходит на второй план, уступая ему пальму первенства. Конечно же, всё актуальнее становится вопрос проведения процедур аффинажа по отношению к серебру. Именно о деталях этой процедуры в домашних условиях пойдёт речь в этой статье.
Что из себя представляет процедура аффинажа
Извлечение чистого серебра из различных сплавов, из которых изготовлены множество контактов, транзисторов и реле – давно известная практика.
Чтобы получить чистый драгоценный металл, необходимо использовать специальные технологии очистки его от примесей, которые в своей совокупности называются аффинажем. Сущность данной процедуры заключается в её стадиях, с прохождением которых представляется возможным получить чистое серебро, золото или платину.
В целом такая процедура – сугубо промышленный процесс, но в наши дни аффинаж серебра возможно провести и в домашних условиях.
Для очистки подходят следующие объекты:
- лом серебряных ювелирных украшений;
- шламы от электротехнической очистки серебра;
- технологический лом, в котором содержится серебро;
- так называемая «серебряная пена» – отходы свинцовой промышленности.
Способы
К альтернативным способам аффинажа серебра относятся:
- купелирование;
- электролитический способ;
- химические способы.
Выбор способа аффинажа зависит от таких факторов:
- количество аффинируемого драгметалла;
- непрерывность производства;
- состояние металла, поддаваемого обработке.
А знаете ли вы, что электролитический способ аффинажа серебра применяется тогда, когда исходным материалом является серебро высокой пробы.
В том случае, если серебро находится в растворённом виде в состоянии сульфата или хлорида, рациональнее всего использовать химическую или электрохимическую обработку драгоценного металла.
Купелирование
Аффинаж низкопробных сплавов производится способом купелирования, который основывается на уникальном свойстве свинца, расплавленного с серебром, – окисляться на воздухе и отделяться от металла вместе с другими примесями.
Это важно! В процессе купелирования не отделяются только золото, платина и металлы платиновой группы.
Для купелирования используется специальная печь с тиглем в форме чашки, которая покрыта мергелью.
Справка! Мергель – особая пористая известняковая глина, наделённая особенностью, способствующей поглощению окиси свинца.
Поэтапно процесс купелирования серебра можно представить следующим образом:
- Печь предварительно разогревают.
- В печь помещается пробирный тигель с техническим серебром и свинцом.
- Тигель необходимо разогреть до полного расплава.
- В печь пропускают атмосферный воздух.
- После термической реакции тигель вынимают из печи и разливают в формы.
После того как сплав остынет, он примет радужный цвет. Это означает, что в нём присутствуют как серебро, так и другие драгоценные металлы.
Таким образом, путём купелирования можно получить исключительно сплав серебра с другими драгоценными металлами.
Электролитический способ
Электролитический аффинаж серебра необходимо производить в специальных ячейках из пластика или песчаника, которые содержат раствор нитрата серебра. Коэффициент чистого драгметалла в таком растворе должен быть не менее 50 грамм на один литр.
Анодом в таком процессе будет выступать загрязнённое серебро, а катодом – тонкие полоски нержавеющей стали.
Аноды следует поместить в тканевые мешочки, в которых впоследствии будут собраны нерастворившиеся загрязнения в виде частиц серебра, избежавших электрохимического растворения. На катодах же будет откладываться серебро в виде макрокристаллов. Такие кристаллы растут в сторону противоположного полюса до короткого замыкания, во избежание которого ветви кристаллов ломаются при перемешивании раствора в направлении, параллельном электродам, на незначительном расстоянии от катода.
Такие кристаллы самопроизвольно опускаются в корзину на дне, откуда их необходимо периодически удалять. Именно из этих кристаллов впоследствии отливаются слитки.
Химический способ
Чтобы извлечь серебро из соли или растворов, необходимо использовать химический способ, вследствие применения которого драгоценный металл выделяется в виде чёрного сульфата серебра. Для применения данного способа в обязательном порядке необходимо добавление сульфата натрия. Продолжать операцию необходимо до полного прекращения выделения сульфата серебра.
В целом при такой процедуре драгоценный металл извлекается в виде хлорида только после добавления одного из альтернативных веществ: либо хлорида аммония, либо поваренной соли. Полученную жидкость необходимо отстаивать до момента её полного разделения на две фракции: прозрачную и мутную.
Это важно! Если последующее добавление соли не вызывает помутнения раствора, значит, всё серебро находится в осадке.
Из хлорида серебро можно добыть двумя способами:
- сухим, а именно – литьём в присутствии карбонатов щелочных металлов;
- из раствора, доведением пробы до максимального значения.
Необходимые материалы и инструменты
В соответствии с описаниями каждого из отдельных способов аффинажа серебра в домашних условиях приведём перечни необходимых для их проведения материалов и инструментов.
Купелирование:
- Печь.
- Тигель в форме чашки, покрытой мергелью.
- Свинец.
Электролиз:
- Специальные ячейки из песчаника или пластика.
- Азотная кислота.
- Мешочки из ткани.
Химические способы:
- Сульфит натрия.
- Хлорид аммония.
- Поваренная соль.
- Азотная кислота.
- Серная кислота.
- Специальная посуда, материал для которой выбирают в зависимости от компонентов процедуры.
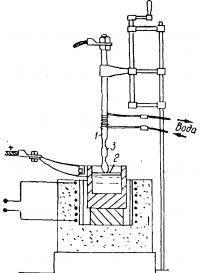
Поэтапный электролиз серебра в домашних условиях
Это важно! Все описанные выше способы применимы в домашних условиях. Однако если у вас нет «аффинажного опыта», то лучше всего использовать электролитический способ аффинажа серебра.
Условно такой процесс можно поделить на три части:
- Растворение драгметалла в азотной кислоте.
- Цементирование серебра и его сплавление.
- Непосредственный аффинаж.
На первом этапе вам понадобится:
- раствор азотной кислоты 68,8%;
- стеклянная ёмкость;
- кварцевая палочка.
Азотная кислота 68.8%, деионизированная вода, весы, стеклянная ёмкость и кварцевая палочка
Это важно! При работе с кислотами не забывайте о том, что вам необходима хорошая вентиляция (лучше всего работать на свежем воздухе), кожу рук защищаем перчатками, глаза – защитными очками, кислоту нужно лить в воду, а не наоборот.
Процесс подбора пропорций
- Чтобы получить разбавленную азотную кислоту, нужно смешать деионизированную воду с чистой кислотой в пропорции 1:1.
- Полученную жидкость перемешиваем кварцевой палочкой.
- Разливаем кислоту по специальным ёмкостям для химических реактивов.
- Приготовление нитрата серебра производим из расчёта на весь процесс. Нам необходима концентрация примерно 50 грамм серебра на один литр жидкости.
- Растворяем серебро в жидкости. Этот процесс, как правило, сопровождается выделением газа NO2 и окрашиванием раствора в голубой цвет.
- Процесс растворения длительный. Полностью серебро растворится не раньше чем через 8–10 часов.
- Полученный раствор следует закрыть в химической баночке.
- Далее получаем «серебряный цемент». Для этого необходимо вытеснить металлическое серебро из нитрата серебра с медью.
- Берём раствор нитрата серебра, добавляем медь.
Это важно! В качестве источника меди могут быть использованы старые водопроводные трубы, которые необходимо почистить до блеска.
Так выглядят медные трубочки в растворе
Добавление меди провоцирует ускорение реакции. Образовавшийся в результате серебряный цемент на трубочках – серебро в порошковом виде. Для того чтобы скорость процесса не уменьшалась, необходимо периодически стряхивать цемент с трубочек в раствор.
Серебро на медных трубочках
Реакция происходит за счёт того, что трубочки «отдают» медь нитрату серебра, поэтому постепенно они могут вовсе раствориться. Если это произошло, добавьте новые трубочки.
С вытеснением серебра реакция становится всё медленнее, поэтому вы спокойно можете оставить его без присмотра на несколько дней. Следить нужно только за наличием меди в растворе и отсутствием в нём посторонних объектов.
Это важно! Об окончании реакции будет свидетельствовать остывший раствор без признаков реакции, наличие чистой голубой жидкости сверху и слоя цемента – внизу.
Теперь приступаем к фильтрации цемента. На этом этапе понадобятся:
Необходимыnbsp;для фильтрации предметы
Это важно! Процедуру фильтрации необходимо повторить минимум пять раз. Это позволит удалить остатки нитрата меди из серебряного цемента.
После того как процедура фильтрации завершена, необходимо собрать оставшийся цемент, выпарить лишнюю влагу или дождаться, пока она испарится естественным путём.
Это важно! В растворе после фильтрации может содержаться серебро. Поэтому советуем вам добавить в оставшийся раствор поваренную соль и оставить эту жидкость для того, чтобы дождаться осадка в виде хлорида серебра.
- Полученный цемент в сухом виде необходимо сплавить в тигле. Нагреваем цемент равномерно и последовательно.
- Производим литьё в воду, что позволит получить зёрна для дальнейшей работы с металлом.
- Полученное на данном этапе серебро – драгоценный металл приблизительно 980 пробы, то есть в сплаве ещё присутствуют посторонние примеси. Для их извлечения переходим к следующему этапу.
- Перед этим полученный сплав переплавляем в брусок (небольшой слиток).
Плавка серебра в тигле
Для третьего этапа (непосредственного аффинажа) нам понадобятся:
- блок питания;
- нижняя часть пластиковой баклаги объёмом в два литра;
- чайный или кофейный фильтр;
- нержавеющая вилка;
- изоляционная лента;
- латунная палочка;
- теплоусадочная трубка-изоляция.
Необходимые для третьего этапа составляющие
- Ленту чистого серебра необходимо приварить к серебряной форме (слитку, бруску и пр.). Край её должен остаться в висячем положении.
- Теперь создадим катод из вилки, изоляционной ленты и плоскогубцев.
- Через чайный фильтр продеваем анодную палочку и располагаем объекты (нижняя часть баклаги, чайный фильтр, латунная палочка) как показано на фото ниже.
- Раствор серебра, приготовленный нами ранее, разбавляем дистиллированной водой, доведя общий объём до двух литров.
- В электролитическую ванну погружаем катод в виде вилки, заливаем электролитом, чтобы не было касания с местом соединения ленты и серебряного бруска.
- Далее присоединяем минус к вилке, а плюс – к латунной палочке, и подаём ток.
Всё готово к процедуре
Это важно! Напряжение должно колебаться в пределах 4-8 вольт, а ток не должен подниматься выше пяти ампер.
Кристаллы серебра начнут расти, поэтому важно следить за тем, чтобы они не доросли до пакета с анодом, поскольку это приведёт к короткому замыканию.
По окончании реакции серебряный брусок растворится. Электролит нужно слить в банку (его ещё можно будет использовать). Серебряные кристаллы необходимо промыть в чистой воде несколько раз, профильтровать и высушить.
Далее сплавляем кристаллы, как мы это делали ранее, производим литьё в воду.
Таким образом получаем серебро 999 пробы.
Видео получения чистого серебра из зеркал (в 2 частях)
Аффинаж серебра в домашних условиях может стать для вас интересной и увлекательной процедурой, а его результат – долгожданным и превосходящим ваши ожидания. Каждый из способов уникален. Эффективность выбранного варианта аффинажа напрямую зависит от приложенных усилий.
Источник
Получение металлов
Получение металлов и сплавов

Электролизом расплавленных соединений могут быть получены многие металлы и сплавы. Однако промышленное значение электролиз расплавов имеет пока для получения алюминия, магния, натрия, лития, бериллия и кальция.
Для получения калия, бария, рубидия и цезия электролиз расплавленных солей оказывается практически неприменимым из-за высокой химической активности и большой растворимости этих металлов в расплавленных соединениях. Производство их невелико и осуществляется преимущественно термическим восстановлением соединений различными восстановителями: Na, СаС2, Al, Si, Fe—Si, Al—Si.
К металлам, получаемым преимущественно термическим восстановлением, относятся также тугоплавкие металлы — титан, цирконий и др. Однако их получение возможно и электролизом расплавленных соединений.
Наконец, электролизом расплавленных солей получают ныне ряд сплавов, главным образом, применяя жидкий катод из металла, являющегося одним из компонентов сплава.
Металлы I и II групп
В земной коре лития содержится 6,5— 10 -3 вес. % (по А. П. Виноградову), т. е. больше, чем свинца, содержание которого равно 1,6—10 -3 вес. %. Однако литий относится к числу весьма рассеянных элементов, а получение его связано со сложной и дорогой технологией переработки минералов — сподумена Li2O • Аl2O3 • •4SiO2 и лепидолита KLiF2 • Аl2O3 • 3SiO2, содержащих от 0,5 до 3,5% лития.
Плотность лития 0,534 г/см 3 , температура плавления 186° С, температура кипения 1400° С. По химическим свойствам литий стоит ближе к щелочноземельным металлам.
До недавнего времени основное применение литий в виде металла имел для рафинирования и дегазации меди, никеля, при получении сплавов алюминия типа склерон; при производстве антифрикционных сплавов на свинцовой основе, наряду с натрием и кальцием. Большое значение в последнее время получил литий в производстве синтетического каучука, а также для получения гидрида LiAlH4, как одного из самых эффективных восстановителей в процессах органической химии и др. Особое значение и большую будущность имеет литий в качестве исходного сырья в производстве термоядерного горючего. Для этого используют изотоп Li 6 , находящийся в соотношении с Li 7 как 7,4 к 92,6, получая из него тяжелый изотоп водорода — тритий. Изотоп Li 7 используется как обычный литий.
Электролитическое получение лития основано на электролизе расплавленной смеси равных по весу количеств хлоридов лития и калия при 450—500° С. Но так как в этом случае литий загрязнен калием (до 8%), то рекомендован и другой электролит— 13% LiCl и 87% LiBr, имеющий температуру плавления около 520° С.
Электролизер для получения лития состоит из ванны, футерованной керамикой, в которую сверху вводится графитовый или угольный анод, а снизу через дно ванны — стальной катод. Электродные пространства разделены керамиковой перегородкой — диафрагмой, подобной применяемым в магниевых ваннах.
Металлический литий всплывает на поверхность электролита в катодном пространстве и его периодически извлекают. Электролиз протекает спокойно с выходом по току около 75% и при напряжении 8—12 в. Расход электроэнергии составляет около 50 квт • ч на 1 кг лития.
Металл подвергают вторичной переплавке под слоем минерального масла и укупоривают в железные запаянные барабаны.
Основные недостатки электролитического способа получения лития — применение в качестве исходного сырья дорогих солей LiCl и LiBr, высокий удельный расход энергии, загрязнение лития калием и натрием из исходных солей и переход в металл из футеровки примесей Si? Fе, Al, Mg и Са.
В последнее время разрабатывают другие методы лития, в частности вакуумтермические. Наибольшего внимания за служивает метод получения лития восстановлением его алюмината 2Li2O • Al2O3 при помощи порошка алюминия при температуре около 1200° С и остаточном давлении 0,1 мм рт. ст. Выход лития при этом составляет выше 90% металла высокой чистоты.
Представляет интерес электролитический метод получения сплава Li—Са с содержанием последнего 70—60%. В этом случае электролит состоит из 60% LiCl и 40% СаСl2 с температурой плавления около 500° С. Электролиз ведется при 580—620° С в электролизере из талькового камня с угольным анодом и железным катодом, опущенным в ванну сверху (катод соприкосновения). При плотности тока на аноде 1,0—1,6 а/см 2 и начальной катодной плотности тока 50—55 а/см 2 напряжение на ванне составляло 9—13 в. Выход по току 85—75% и расход энергии 22—25 квт•ч на 1 кг сплава.
Получение калия
Калий один из наиболее распространенных в природе элементов (2>4 вес.%), однако, имеет сравнительно небольшое применение. Плотность калия 0,86 г/см 3 , температура плавления 63,6° С, а температура кипения 762,2° С.
По химическим свойствам калий близок к натрию, но имеет более высокую химическую активность. По этой причине получение калия представляет значительно большие трудности, чем натрия, и последний заменяет калий, там где применение их более или менее равноценно. Основной областью применения калия является производство надперекиси калия КО2. В этом соединении, получающемся при окислении калия, содержится теоретически 33,8% активного кислорода, тогда как при окислении натрия в обычных условиях получается перекись натрия Na 2О2, имеющая теоретически только 20,5% активного кислорода. Поэтому при изготовлении препаратов для регенерации воздуха закрытых помещений лучше применять КО2, а не Ма 2О2.
Как уже указывалось, для получения калия в промышленности электролиз расплавленных солей не применяется.
Технология получения калия и сплавов его с натрием основана на реакциях замещения калия натрием в его соединениях КОН или КСl. При определенных условиях натрий вытесняет калий из гидроокиси калия:
В аппаратах обменного разложения сверху подают расплавленное едкое кали с температурой около 450° С, а снизу — расплавленный металлический натрий. Реакция обратима, хотя и смещена преимущественно в сторону образования калия. Содержание натрия в калии можно регулировать количествами КОН и Na, додаваемыми в аппарат. Образующаяся смесь щелочей используется как химический продукт. Вследствие высокой стоимости едкого кали и металлического натрия стоимость калия значительно выше, чем натрия.
В последнее время едкое кали в реакции обменного разложения заменяют хлоридом калия, но более высокая температура плавления хлоридов, чем гидроокисей, увеличивает трудности процесса. В связи с этим представляет интерес вакуумтермическое восстановление калия из его соединений, главным образом из хлорида калия, алюминием, кремнием, карбидом кальция и т. п.
Наконец, заслуживает внимания недавно разработанный процесс отгонки калия из сплавов его со свинцом, получаемых при электролизе расплавленных солей калия с жидким свинцовым катодом.
Получение кальция
Плотность кальция 1,55 г/см 3 , температура плавления 851° С, температура кипения 1440° С. По химическим свойствам кальций близок к натрию, отличаясь от последнего резко выраженными гетерными свойствами — способностью соединяться при нагревании на воздухе не только с кислородом, но и с азотом и водородом. Основное применение кальций имеет как восстановитель в химической и металлургической промышленности, а также как раскислитель для медных сплавов и специальных сталей.
Заслуживает внимания применение кальция для получения гидрида СаН2, имеющего значение как восстановитель при получении тугоплавких металлов и в процессах органической химии. Гидрид кальция может быть также источником получения водорода в полевых условиях. Кальций может применяться также для извлечения висмута при рафинировании свинца, хотя для этой цели выгоднее получать непосредственно сплавы Са—Pb электролизом хлоридов кальция и натрия с жидким свинцовым катодом.
Рис. 2. Принцип действия като да соприкосновения:
1 — катод (железный стержень); 2 — поверхность электролита; 3 — застывший кальций.
Электролитическое получение кальция весьма сложно. Исходная соль — хлорид кальция имеет температуру плавления 774° С. Кальций плавится при 851° С. Поэтому прибегать к добавкам других солей для снижения температуры плавления СаСl2 нет смысла. Но получающийся на катоде кальций хорошо растворим в расплаве с образованием субхлорида СаСl. Последний неустойчив, и на аноде вновь образуется СаСl2, что ведет к резкому снижению выхода по току.
Высокий выход по току удалось получить лишь применив оригинальный катод соприкосновения. Принцип действия такого катода поясняется на рис. 2. Железный стержень 1, охлаждаемый водой, нижним концом только прикасается к поверхности электролита 2. Выделяющийся на катоде кальций застывает на нем и по мере электролиза катод с застывшим кальцием медленно вытягивается из электролита. Таким образом, на катоде образуется штанга затвердевшего кальция 3, защищенная от взаимодействия с кислородом и азотом воздуха корочкой застывшего электролита.
На погруженном в электролит графитовом аноде выделяется хлор, причем соотношение поверхностей электродов таково, что катодная плотность тока в десятки раз выше анодной. Это позволяет вести электролиз так, чтобы вблизи катода температура была несколько выше 850° С, а в массе электролита и у анода ниже 800° С. Растворимость кальция при этих условиях существенно понижается и выход по току может достигнуть 80%. Но так как применяется высокая катодная плотность тока, напряжение на электролизере достигает 25—30 в и соответственно расход электроэнергии составляет 45—60 квт•ч на 1 кг Са. Это в 3 —4 раза выше, чем для получения натрия.
Было предложено много конструкций электролизеров для получения кальция, однако во всех сохраняется принцип соприкасающегося катода. Российскими исследователями были установлены рациональные пути снижения расхода электроэнергии. Было доказано, что нет надобности иметь очень высокую катодную плотность тока (50—100 и даже 250 а/см 2 ). Можно успешно вести электролиз и при катодной плотности тока 12—15 а/см 2 . Напряжение на ванне в этом случае может быть снижено до 15—17 в, а искусственное охлаждение электролизера становится излишним.
Показано также, что при больших силах тока и применений нескольких параллельно включенных катодов соприкосновения можно существенно снизить расходы на электроэнергию, рабочую силу и упростить процесс электролиза.
При достижении длины стержня кальция 500—700 мм электролиз останавливают, стержень обламывают, железный катод опускают на поверхность электролита и вновь начинают электролизу Так как кальций в стержнях сильно загрязнен включениями электролита, то его еще раз переплавляют без доступа воздуха. Каль ций-сырец загружают в железный стакан, который затем переворачивают вверх дном и в этом положении выдерживают под расплавленным хлоридом кальция. Кальций расплавляется и собирается вверху у дна опрокинутого стакана; посторонние включения отстаиваются и отделяются.
Переплавленный кальций содержит около 99% Са. Более чистый металл может быть получен перегонкой его в вакууме или в атмосфере аргона.
За последнее время усиленно разрабатывались вакуумтермические методы получения кальция из окиси кальция при помощи алюминия, силикокальция, силикоалюминия и ферросилиция и достигнуты существенные успехи в полупроизводственном масштабе.
Разработан также метод производства кальция путем получения электролизом с жидким катодом меднокальциевого сплава и с последующей вакуумной отгонкой кальция из сплава.
В качестве электролита используют расплав 75—85% СаСl2 и 15—25% КCl. Электролиз ведут при 650—710° С (т. е. металлический кальций выделяется в твердой фазе. Для того, чтобы ускорить растворение кальциевой губки, плавающей на поверхности катода, его периодически перемешивают скребком).
Электролиз идет с выходом по току около 70—75% при плотности тока на катоде 0,85—0,95 а/ см 2 и на аноде 1,7—3 а/см 2 . Катодный сплав (жидкий) содержит 60—65% кальция и имеет плотность 2,1—2,2 г/см 3 . Напряжение на ванне в период нормальной работы 8,5—10 в.
Испытаны электролизеры на 20 000 а по конструкции несколько напоминающие ванны для получения тройного сплава Pb — Na — К, но герметичные для отсоса хлора, выделяющегося на аноде.
Катодный сплав Сu—Са выливают из ванны с помощью вакуум-ковша и направляют на извлечение кальция путем отгонки его при 1180° С и остаточном давлении в реторте для отгонки около 10 мм рт. ст. Обедненный сплав с содержанием около 30% Са, остающийся после отгонки, дробят и возвращают в электролизер.
Общий расход электроэнергии на технологические нужды (в переменном токе) около 29 300 квт • ч на 1 г металлического Са, в том числе на электролиз 21 000 и на дистилляцию 6700.
Барий
Довольно широко распространен в природе, составляя 0,05 вес. % в земной коре. В природе встречается в виде солей, главным образом, витерита ВаСО3 и барита BaSО4. Плотность бария 3,75 г/см 3 , температура плавления 704° С, температура кипения 1540° С. На способности бария энергично реагировать с кислородом и азотом основано главное его применение в качестве гетера в производстве электровакуумных приборов. Так как барий является средством увеличения электронной эмиссии, то наряду с другими гетерами предпочтение в производстве электронных приборов отдается барию.
Вследствие огромной растворимости бария в его расплавлен ных солях, высокой температуры плавления последних, легкой окисляемости металла на воздухе и высокого электроотрицательного потенциала разряда ионов бария, получение его электролизом из расплавленных сред оказалось технически невозможным. Барий может быть получен отгонкой из амальгамы бария. Однако примеси ртути в металле резко ухудшают его свойства; как гетера.
Барий получают восстановлением его окиси порошком алюминия при температуре выше 1000° С и высоком вакууме:
Полученный при конденсации паров барий засасывается в медные трубки-изложницы, защищающие барий от окисления. Трубку с барием протягивает в тонкую биметаллическую проволоку. В таком виде барий сохраняется и применяется в производстве вакуумных приборов.
Возможно получение сплавов бария при электролизе расплавленного ВаСl2 с NaCl или КСl на жидком свинцовом, цинковом или оловянном катоде с высоким выходом по току. Однако отгонка бария из таких сплавов затруднена примесями щелочных металлов. Непосредственное применение подобных сплавов бария ограничено.
Получение тугоплавких металлов
Попытки получать тугоплавкие металлы в чистом виде электролизом расплавленных солей известны давно. Особенностью подобного процесса является то, что на катоде выделяется металл в твердом виде, а не в расплавленном, как это имеет место для Аl, Mg, Na и других легкоплавких металлов. Но при высоких температурах получать при катодном осаждении твердый металл в компактном виде не удается. В этом случае катодный осадок получается в виде раздробленного более или менее крупного порошка, иногда прилипающего к катоду в виде друзы кристаллов. Извлечение порошкообразного металла из электролита требует отмывки католита (электролита) от металла чаще всего растворением в воде или слабой кислоте. Таким образом, появляется добавочная технологическая операция, связанная с некоторыми потерями металла. Поэтому ранее из тугоплавких металлов в чистом виде электролизом расплавленных солей получали лишь бериллий. Однако за последнее время стали получать электролизом и другие чистые тугоплавкие металлы — титан, цирконий, тантал, ниобий и др.
Для технического получения тугоплавких металлов разработаны или разрабатываются методы термического восстановления их из соединений при помощи Al, Mg, Na, Si, СаС2, сплавов Al — Si, Si — Са в вакууме или в атмосфере инертного газа.
Так, например, получение металлического титана основано на реакциях восстановления при 800—900° С:
TiCl4 + 4Na → 4NaCl + Ti
Очень чистые металлы рассматриваемой категории получаются также термическим разложением их йодистых соединений.
Однако возможность получения тугоплавких металлов электролизом расплавленных солей не исчерпана и исследования в этом направлении продолжаются. Как пример ниже рассмотрены электрохимические способы получения бериллия и титана.
В земной коре бериллия находится 6 • 10 -4 вес. %, т. е. меньше, чем лития. Главным минералом, содержащим бериллий, является берилл — двойной силикат бериллия и алюминия состава: 14% ВеО, 19% Аl 2O3, 67% SiO2. В виде примесей сопутствуют соединения К, Na, Li, Са, Fe и др.
Плотность бериллия 1,84 г/см 3 , температура плавления около 1285° С. Чистый бериллий имеет высокую твердость, однако благодаря хрупкости, плохо поддается механической обработке.
Бериллий применяют в качестве раскислителя при литье металлов и модификатора при образовании специальных сплавов. Например, сплавы меди с небольшим содержанием бериллия (1—3%) наряду с высокой прочностью обладают высокой электропроводностью и большим сопротивлением усталости, что важно для пружин электрических приборов и автоматики.
Малая плотность, высокие прочность и температура плавления, стойкость против окисления позволяют использовать бериллий как один из лучших замедлителей и отражателей в высокотемпературных ядерных реакторах. Бериллиевые соли получают путем ряда сложных химических операций. По одному из способов размолотый берилл спекают с кремнефторидом натрия Na2SiF6 с последующим выщелачиванием водой фторобериллата натрия. Из раствора последнего осаждают едкой щелочью гидроокись бериллия. Гидроокись бериллия затем обрабатывают плавиковой кислотой и переводят во фторокись, которая идет на электролиз.
По другому способу, берилл плавят в электрической печи, застывший плав разлагают серной кислотой и обрабатывают аммиаком для осаждения гидроокиси бериллия, которую сушат и нагревают в струе хлора в присутствии углерода. Полученный хлорид бериллия подвергают электролизу.
Наиболее чистый бериллий получается из его хлорида при электролизе смеси ВеСl2 с NaCl по 50 вес. % каждой соли и при 300—350° С. Электролизер со сменным никелевым катодом позво ляет проводить электролиз в две стадии. В первой стадии при.
низком напряжении на катоде осаждаются металлы более электроположительные, чем бериллий. Затем катод сменяют и на свежем катоде осаждают бериллий высокой чистоты. В отличие от описанных в литературе приемов электролиз ведут полунепрерывно с кратковременной остановкой для смены катода и корректирования состава электролита.
Катод с металлом отмывают водой от основной массы электролита. Затем порошок бериллия просеивают на сите с отверстием 2 мм и после ряда дополнительных отмывок мелкую фракцию порошка, более загрязненную примесями, подвергают рафинированию.
Разработан также способ отделения катодного бериллия от хлоридов непосредственной отгонкой их в вакуумной печи при 650—700° С. Возогнанные хлориды и расплавленный электролит собираются в охлажденном никелевом приемнике, из которого они перегружаются в электролизер.
Более загрязненный бериллий получают термическим восстановлением ВеF2 (иногда с добавками фторида бария) сублимированным магнием в индукционных печах с графитовыми тиглями.
Бериллий, полученный электролизом хлорида или восстановлением фторида, переплавляют в вакууме (20 мм рт. ст.) и в атмосфере аргона.
Был открыт в конце XVIII в., однако металлический титан был получен только, в 1910 г. — через 120 лет после его открытия — путем восстановления хлорида титана (IV) натрием.
По содержанию в земной коре (0,6%) титан относится к довольно распространенным металлам. Он более распространен, чем медь, свинец, цинк. Большая рассеянность титана в земной коре и значительные трудности выделения из титановых руд обусловили малое его использование в качестве металла. Однако за последние 15—25 лет производство титана выросло до нескольких десятков тысяч тонн в год, главным образом в США и Англии, и продолжает расти.
Плотность титана 4,54 г/см 3 , температура плавления 1668° С, температура кипения около 3260° С. По внешнему виду титан похож на сталь. Титан имеет переменную валентность, но основная валентность его равна 4. На воздухе при нормальной температуре компактный титан устойчив. При нагревании выше 400° С он окисляется и растворяет азот и водород, отчего становится хрупким. Хрупкость металлу придают также примеси.
Разбавленная серная кислота, а также азотная любой концентрации на него действует очень медленно, как и слабые растворы щелочей. Титан растворяется в соляной, концентрированной серной и плавиковой кислотах; устойчив против коррозии в морской воде.
В природе известно около 70 минералов титана, однако промышленное значение имеют главным образом ильменит (титанистый железняк), а также рутил ТiO2.
До недавнего времени большую часть титановых минералов использовали главным образом для производства двуокиси тита на, применяемой для изготовления титановых белил и для замены олова в производстве белой эмали.
Титан имеет высокую механическую прочность при малой плотности и устойчив против коррозии, поэтому может быть использован как конструкционный материал.
Свойства титана могут быть еще значительно улучшены легирующими добавками (Сr, Mn, Al, V, Mo, Si и др.).
Присадка титана в количестве 5—10% к меди и алюминию улучшает их физико-химические свойства. Титан широко применяется в твердых и жаропрочных сплавах. Порошкообразный титан используют как поглотитель газов (гетер) в электровакуумной промышленности.
Для получения металлического титана из руды последнюю подвергают химико-технологической переработке для получения чистых ТiO2 или TiCl4.
Наиболее распространенным промышленным методом получения металлического титана является восстановление TiCl4 при высокой температуре магнием или натрием по реакциям, приведенным выше. Однако магние- и натриетермический методы получения титана имеют крупные недостатки.
Во-первых, они требуют больших капиталовложений и расхода электроэнергии на производство металлов-восстановителей — магния или натрия. Во-вторых, периодичность процессов связана с большими затратами труда при малой производительности аппаратуры.
В связи с этим за последние годы много внимания уделяется получению титана электролизом расплавленных солей.
Попытки получить титан электролизом расплавленного электролита постоянного состава, питаемого добавками ТiO2 (по аналогии с получением алюминия из криолито-глиноземных расплавов), не получили практического осуществления. Металл получается в этом случае с повышенным содержанием кислорода и в виде очень мелкокристаллического, легко окисляющегося осадка, мало пригодного для прессовки и переплавки.
Более успешны попытки получать титан электролизом расплавленной смеси хлоридов и фторидов щелочных металлов (например, 30 вес. % NaCl, 30 вес. % КCl и 40 вес. % KF), в которую вводится TiCl4 в газообразном состоянии. Однако получить металл высокой чистоты и при достаточно эффективных технико-экономических показателях электролиза не удается.
Наилучший путь для электрохимического получения чистого титана это электролитическое рафинирование титана-сырца в расплавленных электролитах, состоящих, например, из смеси хлоридов калия и натрия с добавками 8—12% TiCl3, легко переходящего в TiCl2 в результате восстановления на катоде.
Необходимость минимального содержания в тугоплавких металлах кислорода, азота, водорода, а также металлических при месей предъявляет к процессу электролиза и к электролизерам очень сложные требования. Так, необходима глубокая химическая очистка солей для электролиза. Их обезвоживают в условиях, исключающих гидролиз, так как оксисоли (оксихлориды) трудно отделимы от галогенидов, а при электролизе в их присутствии металл получается с содержанием кислорода. Затем соли переплавляют в вакууме или в атмосфере аргона и вводят в ванну без соприкосновения с воздухом.
Электролизеры работают только в атмосфере аргона (или гелия) без соприкосновения электролита и металла с воздухом, т. е. должны быть герметичны.l
Технический аргон тщательно очищают от следов влаги и газов (N2, О 2, Н2) в колонках с γ-A l2O3, а затем над титановой губкой при 700—800° с. Минеральная футеровка электролизеров не допустима и тепловая и химическая защита внутренних стенок-электролизеров достигается образованием гарниссажа из застывшего электролита при охлаждении стенок ванны водой. Для поддержания электролита в расплавленном состоянии организуется внутренний обогрев переменным током. Все операции по установке и извлечению катодов, подаче электролита и многие другие проводятся в полной изоляции от внешней среды. Ванна заполнена аргоном и в случае выделения хлора, непрерывно промывается аргоном. Полученные осадки металлов очищаются от включения электролита либо отмывкой в растворах, либо отгонкой летучих солей и откачкой газов нагреванием в глубоком вакууме.
Получение сплавов на жидком катоде
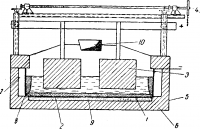
По аналогичной схеме в конце ХIХ в. пытались получать магний электролизом расплавленного карналлита со свинцовым промежуточным электродом. Однако на практике процессы оказались сложными, потери металла большими из-за обильного образования шлама, а передача расплавленных свинца и сплава из одного отделения ванны в другое слишком трудной. Практического развития этот метод производства Na или Mg не получил.
Рис. 3 . Схема электролизера на 12 ООО а для получения тройного сплава:
1 — железное корыто; 2 — расплавленный свинец; 3 — анод; 4 — подъемный механизм; 5—кожух; 6 — футеровка; 7 — воздушный канал; 6— гарниссаж; 9 — содовая подсыпка; 10— бортовый отсос
Однако интерес к электролитическому получению сплавов с жидким катодом не исчез потому, что выделение металлов на жидком катоде происходит с большим выходом по току и при меньшем напряжении, чем при обычном электролизе расплавленных солей с твердым «индифферентным» катодом. Естественное разделение (по плотностям) электродных продуктов уменьшает потери их, связанные с воссоединением, что должно обеспечить вы сокий выход по току. Отсутствие диафрагмы и возможность свести к минимуму расстояние между электродами должны приводить к снижению напряжения на ванне. В том же направлении действует деполяризация при выделении металла на жидком катоде.
Так, например, деполяризация при выделении Na или К на жидком свинце составляет величину около 0,52 в, а для Са — даже 0,7 в.
Основное значение жидкий катод имеет при электролитическом получении двойных или тройных сплавов из щелочных или щелочноземельных металлов, с одной стороны, и из какого-либо цветного металла, с другой (например, Pb, Sn, Zn, Аl, Сu и т. п.). Получаемые сплавы либо имеют самостоятельное значение (например, Be — Сu, Li — Сu), либо являются промежуточными для приготовления различных сплавов (например, безоловянистых баббитов из Са — Рb и Na — Pb). Промежуточное значение имеют и сплавы, идущие затем на производство химических продуктов (например, тетраэтилсвинца из сплава Na—К—Рb или отгонки калия из сплава К—Рb).
Электролиз расплавов с жидким катодом предлагался для выделения многих других металлов и получения разнообразных сплавов, как например, Mg с Сu, Sn или Аl; Мn с Zn, Сu, Sn, Sb, Al; Be с Аl и т. п.
Ниже мы рассмотрим наиболее важное промышленное применение жидкого катода при электролизе расплавленных соединений— получение тройного сплава Na—К—РЬ.
Тройной сплав Na—К—Рb. В настоящее время натрий осо бенно широко применяется для производства антидетонатора —-тетраэтилсвинца (ТЭС). Получение последнего основано на реакции взаимодействия свинцово-натриевого сплава, содержащего небольшие добавки калия, с хлористым этилом:
Сплавы Na—Рb с содержанием 50 ат. % или 10 вес. % Na могут быть приготовлены прямым сплавлением компонентов. Сплавление производится под флюсом, содержащим КCl, и поэтому небольшие (
1 вес. %) количества калия, вытесняемого натрием из расплавленного КCl, попадают в сплав Na —Pb. Однако непосредственное получение сплава Na —К— Рb электролизом расплавленных солей, в особенности поваренной соли, весьма интересно.
Для приготовления на жидком свинцовом катоде сплава с 10 вес. % Na и 1 вес. % К необходим электролит с содержанием (в вес. %): 50% NaCl и 50% КCl или 45% NaCl, 45% КCl и 10% NaF. При катодной плотности тока, равной 0,5—1,0 а /см 2 , и температуре около 650—700° С возможно получить выход по току 70—80%. Добавка фторида натрия к смеси хлоридов натрия и калия не играет специфической роли, но способствует снижению температуры процесса, что важно с точки зрения стойкости анодных и футеровочных материалов.
Исходные соли должны быть технически чистыми и не содержать больших количеств примесей сульфатов кальция, магния, бария, влаги и железа.
Электролитическое получение тройного сплава возможно в электролизере, схема которого представлена на рис. 3. Железное сварное или литое корыто 1 служит сосудом для расплавленного свинца-катода. Корыто устанавливают в футеровке из шамотного кирпича с прослойкой на дне ее сухой соды. В вертикальных отсосах на стенках футеровки имеются воздушные каналы для охлаждения вертикальных стенок корыта и образования на внутренних стенках его слоя застывшего электролита (гарниссажа). Огнеупорная теплоизолирующая футеровка окружена снаружи стальным кожухом. Над расплавленным свинцом находится расплавленный электролит, в который в две линии погружены графитовые или угольные аноды 3. Аноды подвешены на специальной раме, несущей сборную анодную шину с подъемным механизмом 4. Для получения хлора аноды должны иметь герметичную камеру (одну или несколько).
При электролизе по мере насыщения свинца необходимым количеством щелочных металлов, тройной сплав извлекают (не полностью) из ванны с помощью вакуум-ковша, а в ванну загружают свежую порцию свинца в чушках.
Состав электролита поддерживают в допустимых пределах компонентов периодической добавкой солей, заранее приготовленных переплавкой в пламенной печи.
Выход по току не превышает 47—65% при напряжении 8— 11 в и токе 6000—6500 а. Снижение вывода по току объясняется главным образом образованием на катоде шлама, требующего периодического удаления его.
Проблемой оказалась герметизация анодного пространства. Фактически ванны работают открытыми и, во избежание отравления атмосферы цеха хлором, переведены на содовый электролит состава 30—40% Na2CО3, 25—30% KCl и 30—40% NaCl. Анодный процесс в этом случае сводится к разряду ионов СО 2- 3 , образованию кислорода и СO2.
Промышленные электролизеры на 10 000—12 000 а работают на содовом электролите с выходом по току 60%- При катодной плотности тока около 0,3 а/см 2 и анодной — около 1 а/см 2 напряжение на ванне равно 6,5—7,0 в, а расход электроэнергии составляет 1600—1700 квт • ч на 1 т тройного сплава (считая на общий вес сплава, содержащего около 90% Pb и около 10% щелочных металлов).
Статья на тему Получение металлов
Похожие страницы:
Понравилась статья поделись ей
Источник
















