Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Источник
Электродуговой способ получения азотной кислоты
Тема 32. Оксиды азота.
Часть I
1. Запишите формулы пяти оксидов азота и фигурными скобками объедините солеобразующие и несолеобразующие.
2. Заполните таблицу «Солеобразующие кислотные оксиды азота».
3. Физические свойства:
1) NO газ, тяжелее воздуха, Mr(NO)=30
2) NO2 бурый, ядовитый газ.
4. Классификационная характеристика HNO3:
1) по водороду – одноосновная
2) по кислороду – кислородсодержащая
3) по растворимости – растворимая
4) по степени диссоциации – сильная
5. Химические свойства HNO3 как электролита конкретизируйте уравнениями реакций в молекулярной, полной и сокращённой ионной формах:
1) с основными оксидами
2) с гидроксидами металлов
3) с солями с образованием ↑ или ↓
6. Окислительные свойства HNO3: взаимодействует с металлами, стоящими до и после Н2 в ряду напряжений металлов, образуя соль, воду и какой-либо продукт восстановления N+5.
Рассмотрите ОВР, схемы которых:
Часть II
1. Запишите уравнения реакций получения азотной кислоты электродуговым способом:
Почему этот способ так называется?
Потому что реакция идёт только при температуре электрической дуги.
2. Запишите первое уранение реакции получения азотной кислоты аммиачным способом:
Чем этот способ отличается от электродугового?
Идёт при низкой температуре, в присутствии катализатора.
3. Допишите уравнения реакций. Расставьте коэффициенты методом электронного баланса.
4. Почему концентрированную азотную кислоту перевозят в стальных и алюминиевых цистернах?
Т.к. она при обычных условиях не взаимодействует с алюминием и железом (сталь содержит железо).
5. Заполните схему «Применение азотной кислоты»
6. Придумайте и решите задачу на нахождение объёма оксида азота (II), полученного путём взаимодействия разбавленной азотной кислоты с известной массой меди, содержащей долю примесей в виде оксида меди (II).
Найти объём NO, который получили из меди и разбавленной HNO3, если медь содержит 10% примесей CuO, a m(Cu прим)=128 г.
7. Напишите синквейн об азотной кислоте.
1. Азотная кислота
2. Сильная и разъедающая
3. Разъедает кожу
4. Основа удобрений
5. Соли азотной кислоты
Источник
Техническая азотная кислота
Получение азотной кислоты осуществляется тремя способами, которые мы опишем в том порядке, в каком они начали применяться в промышленности.
1.Получение азотной кислоты из селитры. Наиболее старый способ получения азотной кислоты, которым пользовались уже в середине XVII в., заключается в нагревании натриевой селитры с концентрированной серной кислотой: NaNО3 + H2SО4 = NaHSО4 + HNО3
Выделяющиеся при нагревании пары азотной кислоты направляются в охлаждаемый водой приемник, где они сгущаются в жидкость. При слабом нагревании и избытке серной кислоты реакция идет с образованием кислой соли. Если же взять достаточное количество селитры и нагревать сильнее, то получается нормальная соль:
Однако при этом происходит значительная потеря азотной кислоты вследствие ее разложения. Поэтому процесс ведут таким образом, чтобы реакция протекала по первому уравнению.
До начала текущего столетия описанный способ получения азотной кислоты был единственным применяемым в промышленности. Затем он был почти полностью вытеснен другими способами, основанными на фиксации атмосферного азота.
2. Получение азотной кислоты из воздуха дуговым методом. В основе этого метода, впервые технически осуществленного в Норвегии в 1905 г., лежит описанная в реакция непосредственного соединения азота с кислородом. Необходимая для этой реакции высокая температура получается при помощи электрической душ, питаемой мощным источником электрического тока. Если пламя электрической дуги поместить между двумя полюсами сильного электромагнита (рис. 98), то оно принимает форму плоского диска, вследствие чего поверхность пламени сильно увеличивается. Этот огненный диск, достигающий 3 м в диаметре, образуется в сложенной из огнеупорных кирпичей специальной печи, температура в которой достигает 3000—3500°. Стенки печи пронизаны каналами, через которые в печь вдувается воздух. Приходя в соприкосновение с пламенем электрической дуги, воздух сильно нагревается, и в нем образуется некоторое количество окиси азота.
Выходящие из печи газы, содержащие 2—3% окиси азота, быстро охлаждают до 1000—1100°, чтобы образовавшаяся окись азота не могла разложиться обратно на азот и кислород. В процессе дальнейшего охлаждения газовой смеси окись азота присоединяет кислород, переходя в двуокись азота, которая поглощается водой и превращается в азотную кислоту.
Получение азотной кислоты описанным методом связано с затратой большого количества электрической энергии. Наибольшее развитие этот метод получил в Норвегии, располагающей значи-тельными ресурсами дешевой электроэнергии. К 1925 г. мировое производство азотных соединений, получаемых по дуговому методу, достигло 42 000 т в год в пересчете на азот. Однако в последнее время дуговой метод применяется в сравнительно небольших масштабах, так как оказалось экономически выгоднее получать азотную кислоту новым методом — окислением синтетического аммиака.
3. Получение азотной кислоты окислением аммиака. Наиболее важным из современных способов получения азотной кислоты является каталитическое окисление аммиака кислородом воздуха. При описании свойств аммиака было указано , что он горит в кислороде, причем продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов окисление аммиака может протекать иначе. Если, например, пропускать смесь аммиака с воздухом сквозь накаленную сетку из платиновой проволоки, служащей катализатором, то при 750° и определенном составе смеси происходит почти количественное превращение аммиака в окись азота:
Окись азота легко переходит в двуокись азота, которая с водой образует азотную кислоту.
Возможность каталитического окисления аммиака в азотную кислоту была известна давно, но только в начале XX в. удалось использовать этот процесс для заводского получения азотной кислоты. В первых аппаратах для окисления аммиака катализатором служила платина. В настоящее время применяют преимущественно сплав платины с родием, содержащий 5—10% родия. Выход окиси азота составляет 96—98%.
На рис. 99 представлена схема заводской установки для окисления аммиака при атмосферном давлении. Освобожденный фильтрованием от механических примесей воздух подается вентилятором 1 в теплообменник 2, где он нагревается выходящими из контактного аппарата газами примерно до 300°, и затем поступает в смеситель 3. Сюда же вентилятором 4 подается газообразный аммиак. Из смесителя аммиачно-воздушная смесь, содержащая 10—11% аммиака, поступает в контактный аппарат 5, состоящий из двух полых конусов, соединенных основаниями. В широкой части аппарата закреплены горизонтально несколько сеток из тонких платино-родиевых нитей, служащих катализатором. В контактном аппарате происходит окисление аммиака в окись азота.
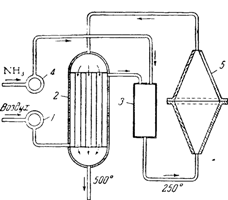
Выходящая из кон тактного аппарата горячая газовая смесь направляется в теплообменник. Здесь горячие газы охлаждаются до 500—550°, после чего их пропускают последовательно через паровой котел (для использования тепла), особые холодильники и, наконец, поглотительные башни, где в основном и происходит окисление окиси азота в двуокись и образование азотной кислоты.
Получаемая из башен кислота обычно содержит 50—55% HNО3. Превращение ее в более концентрированную кислоту достигается путем перегонки с серной кислотой, которая служит удерживающим воду средством. Кроме того, в последнее время разработан способ получения концентрированной азотной кислоты взаимодействием жидкой двуокиси азота с водой (или с разбавленной азотной кислотой) в присутствии кислорода под давлением 50 ат при температуре 75°. Реакция протекает по суммарному уравнению
По этому способу, называемому «прямым синтезом», получают сразу 98%-ную азотную кислоту.
В настоящее время большая часть азотной кислоты, вырабатываемой в огромных количествах, получается окислением аммиака. А так как главная масса аммиака получается путем синтеза из элементов, то в конечном счете этот способ, как и предыдущий, основан на фиксации атмосферного азота.
Основоположником отечественного производства синтетической азотной кислоты был инженер И. И. Андреев, который в 1914 г. впервые поставил вопрос об организации в России производства азотной кислоты окислением аммиака, образующегося при коксовании угля. Андреев тщательно изучил реакцию окисления аммиака на изготовленных под его руководством ката лизаторах и построил опытную промышленную установку. Полученные на этой установке экспериментальные данные были использованы при составлении проекта первого завода синтетической азотной кислоты, который был построен в Юзовке (ныне Сталино, Донецк) и пущен в ход в июле 1917 г. Опыт работы этого завода был широко использован советскими инженерами при проектировании новых заводов, построенных в годы первых пятилеток.
Вы читаете, статья на тему Техническая азотная кислота
Источник



















