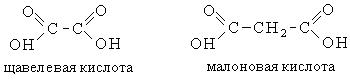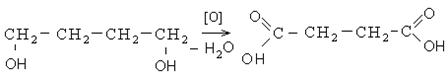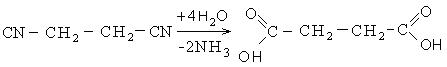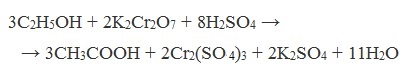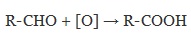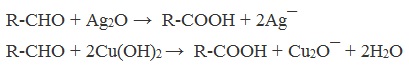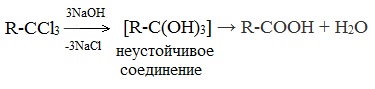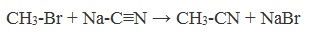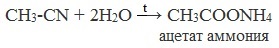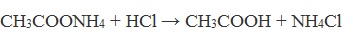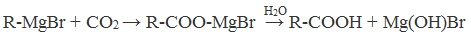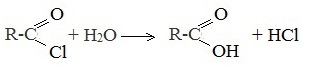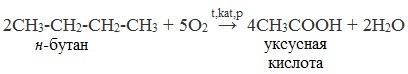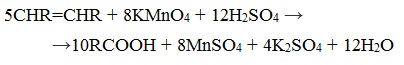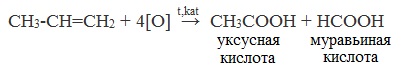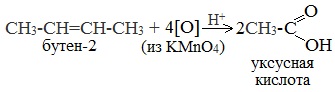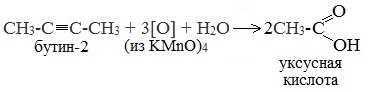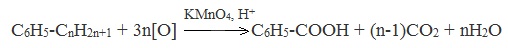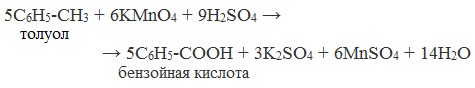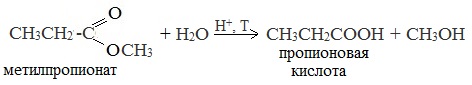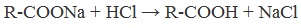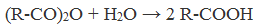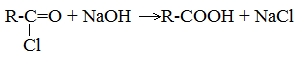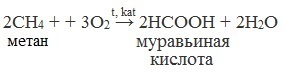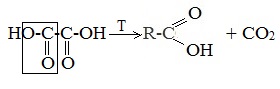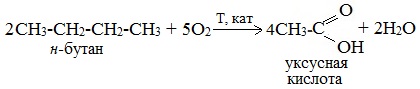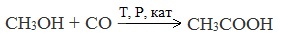- Двухосновные предельные карбоновые кислоты
- Двухосновные карбоновые кислоты способы получения
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
- Двухосновные насыщенные и ненасыщенные карбоновые кислоты
- Изомерия и номенклатура двухосновных насыщенных и ненасыщенных карбоновых кислот
- Двухосновные карбоновые кислоты: Физические и химические свойства
- Физические свойства дикарбоновых кислот
- Химические свойства дикарбоновых кислот
Двухосновные предельные карбоновые кислоты



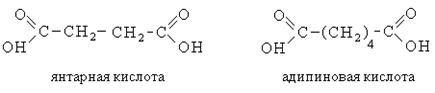
Двухосновные предельные кислоты содержат в своем составе две функциональные карбоксильные группы. Ниже приведены важнейшие представители:
Способы получения. Двухосновные карбоновые кислоты могут быть получены способами, аналогичными способам получения одноосновных карбоновых кислот.
1. Окисление гликолей:
2. Гидролиз динитрилов:
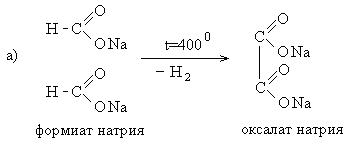
3. Щавелевую кислоту получают по следующей схеме:
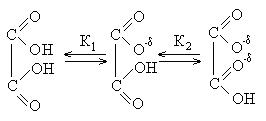
Применение. Щавелевая кислота. Эта кислота является более сильной кислотой, чем одноосновные кислоты, и диссоциирует в две ступени:
Более сильные кислые свойства щавелевой кислоты обусловлены электронными эффектами, действующими в молекуле.
Щавелевая кислота используется в деревообрабатывающей промышленности, для отбелки орехового и красного дерева, в пищевой промышленности как консервирующий реагент.
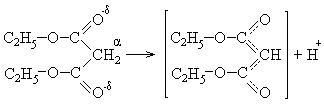
Малоновая кислота и особенно ее эфир обладают специфическими свойствами: атомы водорода в α-положении очень подвижны и способны диссоциировать по типу кислоты. При этом образуется стабилизированный резонансом карбанион:
Это свойство малоновой кислоты и ее этилового эфира широко используется в органическом синтезе под названием «синтезы на основе малонового эфира».
Малоновая кислота содержится в свекольном соке, фасоли, горохе.
Янтарная кислота распространена в природе, особенно в красной смородине, недозрелом крыжовнике. В технике ее получают гидрированием малеиновой кислоты и из природной смолы – янтаря – путем сухой перегонки.
Источник
Двухосновные карбоновые кислоты способы получения
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
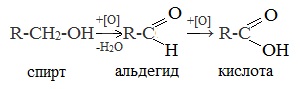
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
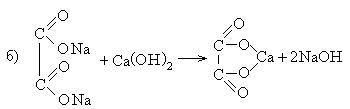
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
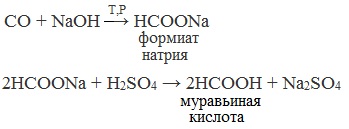
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
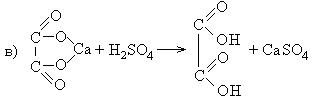
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
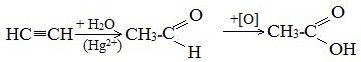
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Источник
Двухосновные насыщенные и ненасыщенные карбоновые кислоты
Молекулы двухосновных (дикарбоновых) кислот содержат насыщенный или ненасыщенный углеводородный радикал и две карбоксильные группы. Двухосновные карбоновые кислоты имеют общую формулу НООС-R-СООН.
Если карбоксильные группы связаны с насыщенным углеводородным радикалом, то кислота является насыщенной (предельной) и ненасыщенной (непредельной), если карбоксильные группы связаны с ненасыщенным углеводородным радикалом, например, бутандиовая (янтарная) и бутендиовая кислоты:
Изомерия и номенклатура двухосновных насыщенных и ненасыщенных карбоновых кислот
Согласно правилам систематической номенклатуры ИЮПАК дикарбоновые кислоты называют аналогично соответствующим углеводородам, прибавляя окончание — диовая или слово дикарбоновая кислота. Например, пропандиовая или пропандикарбоновая кислота, пентандиовая или пентандикарбоновая кислота.
Первые девять членов ряда предельных дикарбоновых кислот имеют тривиальные названия. Тривиальные названия, названия по систематической номенклатуре и структурные формулы некоторых дикарбоновых кислот приведены в таблице:
Двухосновные карбоновые кислоты: Физические и химические свойства
Физические свойства дикарбоновых кислот
Двухосновные карбоновые кислоты – твердые кристаллические вещества. Они достаточно хорошо растворимы в воде, причем растворимость их выше, чем у соответствующих одноосновных (монокарбоновых) кислот. Температуры их кипения также выше, чем у монокарбоновых кислот. Это обусловлено тем, что большее число карбоксильных групп, способно образовывать большее число водородных связей, вследствие чего происходит ассоциация молекул.
Химические свойства дикарбоновых кислот
Двухосновные карбоновые кислоты сохраняют общие свойства одноосновных карбоновых кислот, такие как, способность образовывать полные или неполные функциональные производные – соли, эфиры и т.п. и специфические свойства.
Специфические химические свойства дикарбоновых кислот:
- Кислотные свойства двухосновных карбоновых кислот повышены по сравнению с соответствующими одноосновными кислотами. Так, величина кислотности щавелевой кислоты сравнима с таковой у минеральных кислот, чем и обусловлена ее токсичность. Однако с ростом числа углеродных атомов в гомологическом ряду кислотность значительно снижается.
Двухступенчатая диссоциация в растворах:
Для первых двух членов ряда ионизация по первой ступени протекает легче, чем по второй. Для кислот с числом атомов углерода более 5 этого различия практически не наблюдается.
2. Действие температуры. Дикарбоновые кислоты, в отличие от монокарбоновых, менее устойчивы к повышенным температурам. При нагревании происходит их декарбоксилирование либо дегидратация. При этом, в зависимости от строения кислоты образуются различные продукты:
Среди дикарбоновых кислот важное место занимает малоновая кислота. Атомы водорода метиленовой группы являются очень подвижными и подвергаются электрофильному замещению:
На основе малонового эфира (диэтилового эфира малоновой кислоты) осуществляются важные синтезы.
Алкилмалоновый эфир также способен образовывать соединение с натрием и далее алкилироваться:
Источник