- УЧЕБНАЯ КНИГА ПО ХИМИИ
- § 4.10. Донорно-акцепторный способ образования связи
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Донорно-акцепторный механизм: примеры. Что такое донорно-акцепторный механизм?
- Все ли элементы могут образовывать химические связи
- Типы химической связи
- Ковалентная связь
- Ковалентная связь: обменный механизм
- Ковалентная связь: донорно-акцепторный механизм
- Пример донорно-акцепторного механизма — катион аммония
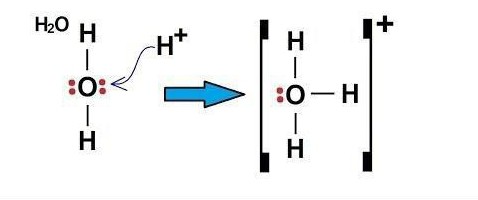
- Пример донорно-акцепторного механизма – H3O (ион гидроксония)
- Донорно-акцепторный механизм образования ковалентной связи между неорганическими молекулами
- Донорно-акцепторный механизм образования ковалентной связи между органическими молекулами
- Донорно-акцепторный механизм без формирования химической связи
- Семиполярная связь, или Дативный механизм образования связи
- Примеры дативной связи
- Значение донорно-акцепторной связи
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13/2003
§ 4.10. Донорно-акцепторный
способ образования связи
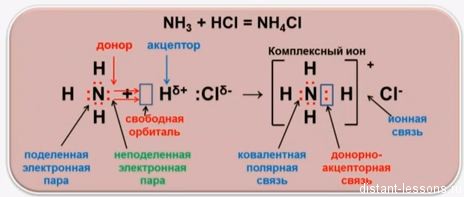
Вы изучили способ образования связи, при котором каждый атом отдает по одному электрону; этот способ называется ковалентным.
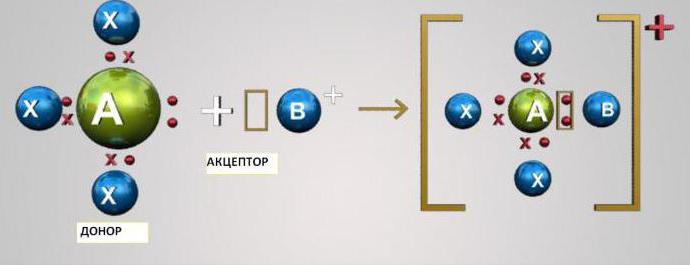
Другой способ образования связи состоит в том, что один атом предоставляет пару электронов, находящихся в спаренном состоянии на его орбитали, а другой атом – свободную, незанятую орбиталь. В результате возникает связь, образованная парой электронов, ставшей теперь общей для обоих атомов. Такой способ называется донорно-акцепторным, а саму связь иногда называют донорно-акцепторной. Связи, образованные ковалентным и донорно-акцепторным способами, отличаются только происхождением, а по своим свойствам не отличаются. Донорно-акцепторная связь называется также координационной.
Частица (атом, ион, молекула), предоставляющая электронную пару, называется донором; частица, предоставляющая свободную орбиталь (ячейку), т. е. принимающая электронную пару, называется акцептором.
Молекула водорода может быть образована двумя способами: ковалентным – из двух атомов водорода и донорно-акцепторным из протона Н + (ядро атома водорода), не имеющего электронов, и иона водорода Н – с двумя электронами (рис. 4.20). В результате этих двух реакций получаются совершенно одинаковые молекулы водорода.
 | |
 |
| Донорно-акцепторный способ образования связи; донорно-акцепторная связь; донор; акцептор; комплексообразователь; лиганд; внутренняя координационная сфера; координационное число; координационные, или комплексные, соединения; ион гидроксония; внешняя координационная сфера. |
ЗАДАЧИ И ВОПРОСЫ
1. Объясните причины взаимодействия иона водорода Н + и молекулы воды с образованием иона гидроксония Н3О + .
2. Почему углы между связями в молекуле Н2О и ионе Н3О + примерно одинаковые (тетраэдрические)?
3. Как вы объясните причину примерно одинаковых углов между связями в таких разных молекулах и ионах, как метан СН4, аммиак NH3, вода Н2О, ион аммония 
4. Переведите на русский язык.
The shared pair of electrons of a bond may also be formed by one of the two bonded atoms providing both electrons. In such a case the bond is sometimes called a dative bond, but as it is just like a covalent bond, once it is formed, two are not always distinguished.
The atom providing the two electrons to make up the dative bond is known as thе donor. It must, of course, have an «unused» pair of electrons available, and such a pair is referred to as a lone pair. The atom sharing the pair of electrons from the donor is known as the acceptor.
When it is not necessary to distinguish between a dative bond and a covalent bond the «–» symbol is used for both. Two other symbols to represent a dative bond are in use and have certain points in their favour.
The first shows a dative bond between atoms A and B as AB, A being the donor and B the acceptor. This indicates, in a convenient way, the origin of the electrons making up the bond.
The second shows an AB bond as A (+)
B (–) . This method indicates the electrical charges which develop on atoms A and B as a result of dative bond formation. A, the donor, develops a positive charge by partly transferring two electrons to B; B, the acceptor, develops a corresponding negative charge. On this basis, the dative bond can be regarded as a covalent bond with a certain amount of ionic character.
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Понятие «металлические свойства» — определяется способностью отдавать электроны — на этом основана металлическая химическая связь. Что происходит, когда встречаются атомы неметаллов?
«Неметаллические свойства» — определяются способностью принимать электроны, отбирать их у других атомов.
Давайте рассмотрим образование молекулы водорода (H2)
Первый вид ковалентной связи — ковалентная неполярная
У каждого атома водорода имеется электрон. При сближении двух атомов возникает такой момент, когда оба электрона будут находиться рядом. Что получается?
Образуется общая электронная пара
У левого атома (зеленый) стало 2 электрона на орбитали — очень выгодное энергетическое состояние, и у правого атома (синий) стало 2 электрона — тоже выгодное состояние. Образуется молекула водорода.
При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами
Получается, что ковалентная связь «стягивает» атомы в молекулы.
Второй вид ковалентной связи — ковалентная полярная
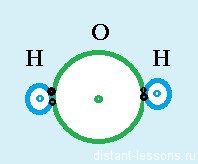
Точно таким же образом образуется молекула воды — кислород добавляет себе пару электронов, что делает его электронную оболочку завершенной, каждый атом водорода тоже становится двухэлектронным — у всех стабильное энергетическое состояние.
Образуются две электронные пары — 2 ковалентные связи.
При образовании полярной ковалентной связи — электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре.
Третий вид химической связи — ковалентная донорно-акцепторная связь
Вообще, нельзя назвать это видом связи, это, скорее, механизм образования связи.
Донорно-акцепторный механизм — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора
Давайте подведем итог по видам ковалентной связи:
- Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода;
- Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;
- Донорно-акцепторную ковалентную связь образуют атомы, имеющие неподеленную электронную пару — доноры электронов (например, азот, кислород, фосфор, сера и т.д.) и атомы, образующие пустую орбиталь — акцепторы (например, протон водорода и некоторые d-элементы.
Источник
Донорно-акцепторный механизм: примеры. Что такое донорно-акцепторный механизм?
Химической связью называется связь двух и более атомов (молекул) в органическом или неорганическом соединении. Она образуется при условии уменьшения общей энергии в системе.
Все ли элементы могут образовывать химические связи
Все элементы периодической системы имеют разную способность к образованию связи. Наиболее устойчивыми и, как результат, химически малоактивными являются атомы благородных (инертных) газов, так как содержат на внешней электронной оболочке два или восемь электронов. Они образуют небольшое количество связей. К примеру, неон, гелий и аргон не образуют химических связей ни с одним элементом, тогда как ксенон, криптон и радон способны реагировать с фтором и молекулами воды.
У атомов других элементов внешние уровни не завершены и имеют от одного до семи электронов, поэтому для повышения устойчивости оболочки образуют химические связи.
Типы химической связи
Выделяют несколько типов связи:
Ковалентная связь
Данный тип связи формируется между атомами в молекуле в результате обобществления или перекрытия валентной электронной пары. Соответственно, существует обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. Отдельным случаем является дативная связь, которая будет рассмотрена ниже.
Ковалентная связь: обменный механизм
У атомов на внешнем уровне есть неспаренные электроны. При взаимодействии внешние оболочки перекрываются. Антипараллельные спины одиночных электронов, содержащихся на внешних уровнях, спариваются с образованием электронной пары, общей для обоих атомов. Данная пара электронов представляет, собственно, ковалентную связь, которая образована по обменному механизму, к примеру, в молекуле водорода.
Ковалентная связь: донорно-акцепторный механизм
Данный механизм заключается в обобществлении двумя атомами двух находящихся на внешнем уровне электронов. При этом один из атомов выступает в качестве донора (предоставляет два электрона), а другой — акцептора (имеет вакантную орбиталь для электронов). Атомы s- и p-элементов могут быть либо акцепторами, либо донорами электронов. Атомы d-элементов способны быть и донорами, и акцепторами.
Чтобы понять, что такое донорно-акцепторный механизм, рассмотрим два простейших примера — образование катионов гидроксония H3O + и аммония NH4 + .
Пример донорно-акцепторного механизма — катион аммония
Схематически реакция образования частицы аммония выглядит следующим образом:
Электроны в атоме N распределены в следующем порядке: 1s 2 2s 2 2p 3 .
Электронная структура катиона H: 1s 0 .
Атом азота на внешнем уровне содержит два s- и три p-электрона. Три p-электрона участвуют в образовании трех ковалентных обменного типа связей азот-водород N-H. В результате этого образуется молекула аммиака NH3 с ковалентным типом связи. Поскольку атом азота N на внешнем уровне имеет еще пару электронов s, молекула NH3 может присоединить еще и катион водорода. Молекула аммиака является донором, а катион водорода H + – акцептором, который принимает донорские электроны от азота на собственную свободную s-орбиталь.
Пример донорно-акцепторного механизма – H3O (ион гидроксония)
Электроны в атоме кислорода распределены в следующем порядке: 1s 2 2s 2 2p 4 .
Атом кислорода на внешнем уровне имеет два s и четыре p-электрона. Исходя из этого, в образовании связей H-O принимают участие два свободных p-электрона и два s-электрона от двух атомов H. То есть 2 имеющиеся связи в молекуле H2O – ковалентные, образованные по обменному механизму.
Электронная структура катиона водорода: 1s 0 .
Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму. Акцептором может быть атом, имеющий свободную орбиталь, в данном примере это частица H + . Свободную s-орбиталь катиона H + занимают два электрона (s) атома кислорода.
Донорно-акцепторный механизм образования ковалентной связи между неорганическими молекулами
Донорно-акцепторный механизм ковалентной связи возможен не только во взаимодействиях типа «атом-атом» или «молекула-атом», но и в реакциях, протекающих между молекулами. Единственным условием для донорно-акцепторного взаимодействия кинетически независимых молекул является уменьшение энтропии, другими словами, повышение упорядоченности химической структуры.
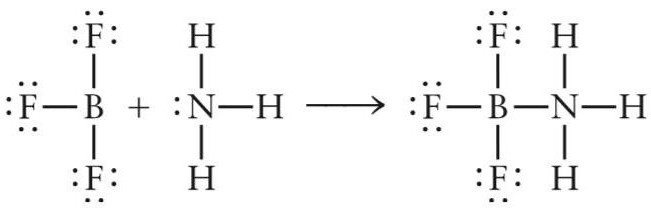
Рассмотрим первый пример — образование апротонной кислоты (кислоты Льюиса) NH3BF3. Данный неорганический комплекс образуется в реакции присоединения молекулы аммиака и фторида бора.
Электроны в атоме бора распределены в следующем порядке: 1s 2 2s 2 2p 1 .
При возбуждении атома B один электрон s-типа переходит на p-подуровень (1s 2 2s 1 2p 2 ). Таким образом, на внешнем уровне возбужденного атома бора находится два s- и два p-электрона.
В молекуле BF3 три ковалентные связи бор-фтор B-F образованы обменного типа (атомы бора и фтора предоставляют по одному электрону). После образования трех ковалентных связей у атома бора на внешней электронной оболочке остается свободный p-подуровень, за счет которого молекула фторида бора может выступать акцептором электронов.
Электроны в атоме азота распределены в следующем порядке:1s 2 2s 2 2p 3 .
По три электрона от атомов N и H участвуют в формировании связи азот-водород. После этого у азота остается еще два электрона s-типа, которые он может предоставить для образования связи по донорно-акцепторному механизму.
В реакции взаимодействия трифторида бора и аммиака молекула NH3 играет роль донора электронов, а молекула BF3 – акцептора. Пара электронов азота занимает свободную орбиталь фторида бора и образуется химическое соединение NH3BF3.
Другой пример механизма образования донорно-акцепторной связи — получение полимера фторида бериллия.
Схематически реакция выглядит следующим образом:
Электроны в атоме Be расположены так — 1s 2 2s 2 , а в атоме F — 1s 2 2s 2 2p 5 .
Две связи бериллий-фтор в молекуле фторида бериллия ковалентные обменного типа (участвуют два p-электрона от двух атомов фтора и два электрона s-подуровня атома бериллия).
Между парой атомов бериллия (Be) и фтора (F) формируются еще две ковалентные связи по донорно-акцепторному механизму. В полимере фторида бериллия атом фтора — это донор электронов, атом бериллия – их акцептор, имеющий вакантную орбиталь.
Донорно-акцепторный механизм образования ковалентной связи между органическими молекулами
Когда происходит формирование связи по рассматриваемому механизму между молекулами органической природы, образуются более сложные соединения — комплексы. В любом органическом соединении с ковалентной связью содержатся как занятые (несвязывающие и связывающие), так и пустые орбитали (разрыхляющие и несвязывающие). Возможность донорно-акцепторного образования комплексов определяется степенью устойчивости комплекса, которая зависит от прочности связи.
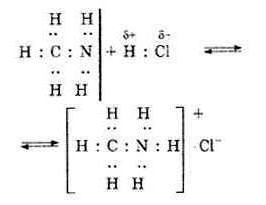
Рассмотрим пример — реакция взаимодействия молекулы метиламина с соляной кислотой с образованием хлорида метиламмония. В молекуле метиламина все связи ковалентные, образованные по обменному механизму – две связи H-N и одна связь N-CH3. После соединения с водородом и метильной группой у атома азота есть еще пара электронов s-типа. Являясь донором, он предоставляет эту электронную пару для атома водорода (акцептор), у которого есть свободная орбиталь.
Донорно-акцепторный механизм без формирования химической связи
Не во всех случаях донорно-акцепторного взаимодействия происходит обобществление электронной пары и образование связи. Некоторые органические соединения могут объединяться между собой за счет перекрывания заполненной орбитали донора с пустой орбиталью акцептора. Происходит перенос заряда – электроны делокализуются между акцептором и донором, расположенными очень близко друг к другу. Образуются комплексные соединения с переносом заряда (КПЗ).
Такое взаимодействие характерно для пи-систем, орбитали которых легко перекрываются, а электроны легко поляризуются. В роли доноров могут выступать металлоцены, ненасыщенные аминосоединения, ТДАЭ (тетракис(диметиламино)этилен). Акцепторами зачастую являются фуллерены, хинодиметаны, имеющие акцепторные заместители.
Перенос заряда может быть как частичным, так и полным. Полный перенос заряда происходит при фотовозбуждении молекулы. При этом образуется комплекс, который можно наблюдать спектрально.
Независимо от полноты переноса заряда, такие комплексы неустойчивы. Для повышения прочности и времени жизни такого состояния дополнительно внедряют мостиковую группу. В результате этого донорно-акцепторные системы успешно используются в устройствах преобразования солнечной энергии.
В некоторых органических молекулах связь по донорно-акцепторному механизму формируется внутри молекулы между донорной и акцепторной группой. Такой тип взаимодействия носит название трансаннулярного эффекта, характерного, к примеру, для атранов (элементоорганические соединения со связями N->B, N->Si).
Семиполярная связь, или Дативный механизм образования связи
Кроме обменного и донорно-акцепторного существует третий механизм – дативный (другие названия – семиполярная, полуполярная или координационная связь). Атом-донор отдает пару электронов на свободную орбиталь нейтрального атома, которому необходимы два электрона, чтобы завершить внешний уровень. Происходит своеобразный переход электронной плотности от акцептора к донору. При этом донор становится положительно заряженным (катион), а акцептор – отрицательно заряженным (анион).
Собственно химическая связь формируется за счет связывающей оболочки (перекрывания двух спаренных электронов одного из атомов внешней свободной орбиталью другого) и электростатической притяжения, возникающего между катионом и анионом. Таким образом, в семиполярной связи сочетаются ковалентный и ионный типы. Полуполярная связь характерна для d-элементов, которые в разных соединениях могут играть роли и акцептора, и донора. В большинстве случаев она встречается в комплексных и органических веществах.
Примеры дативной связи
Самый простой пример – молекула хлора. Один атом Cl отдает пару электронов другому атому хлора, у которого есть свободная d-орбиталь. При этом один атом Cl заряжается положительно, другой – отрицательно, и между ними возникает электростатическое притяжение. Из-за большой длины дативная связь имеет меньшую прочность в сравнении с ковалентной обменного и донорно-акцепторного типа, но ее наличие повышает прочность молекулы хлора. Именно поэтому молекула Cl2 более прочна, чем F2 (у атома фтора нет d-орбиталей, связь фтор-фтор только ковалентная обменная).
Молекула монооксида углерода CO (угарный газ) образована за счет трех связей C-O. Поскольку у атомов кислорода и углерода на внешнем уровне имеется по два одиночных электрона, между ними формируется две ковалентные обменные связи. После этого у атома углерода остается вакантная орбиталь, у атома O — две пары электронов на внешнем уровне. Поэтому в молекуле монооксида углерода (II) есть третья связь – семиполярная, формирующаяся за счет двух валентных спаренных электронов кислорода и свободной орбитали углерода.
Рассмотрим более сложный пример — образование данного вида связи на примере взаимодействия диметилового эфира (Н3С-О-СН3) с хлоридом алюминия AlCl3. Атом кислорода в диметиловом эфире связан двумя ковалентными связями с метильными группами. После этого у него остается еще два электрона на p-подуровне, которые он отдает атому-акцептору (алюминий) и становится положительным катионом. При этом атом-акцептор приобретает отрицательный заряд (превращается в анион). Катион и анион электростатически взаимодействуют друг с другом.
Значение донорно-акцепторной связи
Механизм образования донорно-акцепторной связи имеет важное значение в жизни человека и широко распространен в химических соединениях как органической, так и неорганической природы, что подтверждают рассмотренные выше примеры. Нашатырный спирт, в составе которого есть катион аммония, успешно применяется в быту, медицине и промышленном производстве удобрений. Ион гидроксония играет главную роль в растворении кислот в воде. Угарный газ применяется в промышленности (например, при производстве удобрений, лазерных систем) и имеет огромное значение в физиологических системах организма человека.
Источник





 B, A being the donor and B the acceptor. This indicates, in a convenient way, the origin of the electrons making up the bond.
B, A being the donor and B the acceptor. This indicates, in a convenient way, the origin of the electrons making up the bond.