- Получение этилена и опыты с ним методическая разработка по химии (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- Получение этилена и исследование его свойств. Подготовка к уроку
- Просмотр содержимого документа «инструкция практическая работа»
- Просмотр содержимого документа «маршрутный лист»
- Получение этилена и исследование его свойств
- Просмотр содержимого документа «Получение этилена и исследование его свойств»
- Этилен, структурная формула, химические, физические свойства
- Физические свойства этилена (этена):
- Видео
- Получение этилена
- Химические свойства
- Реакции окисления
- Применение и использование этилена (этена):
Получение этилена и опыты с ним
методическая разработка по химии (10 класс) на тему
Практическая работа по химии
Скачать:
| Вложение | Размер |
|---|---|
| poluchenie_etilena_i_opyty_s_nim.doc | 197.5 КБ |
Предварительный просмотр:
«Получение этилена и опыты с ним»
Цель: уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами.
Оборудование : металлический штатив, спиртовка, спички, лучинка, штатив с пробирками.
Реактивы: этиловый спирт – С 2 Н 5 ОН, H 2 SO 4 — концентрированная, раствор КМnO 4 , йодная вода, песок прокаленный.
Правила техники безопасности
Осторожно работайте с химическим оборудованием!
Осторожно обращайтесь с концентрированной серной кислотой H 2 SO 4 !
- Запрещается пробовать вещества на вкус (а);
- брать вещества руками (б);
- менять пробки и пипетки от различных банок или склянок (в);
- надо работать только над столом (г);
- смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду (д);
Прежде чем выполнять работу ответьте на вопросы и используйте их в формулировке выводов:
- Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
- К какому классу углеводородов относиться этилен? Как это можно доказать?
- Почему этилен легко обесцвечивает йодную воду и раствор перманганата калия, а метан не обесцвечивает их?
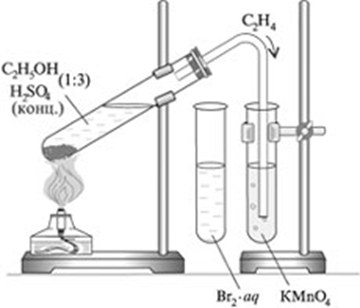
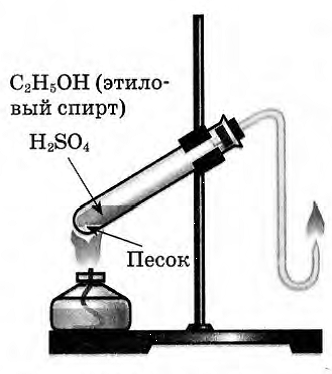
Опыт 1. Получение этилена
- Рассмотрите и соберите прибор как показано на рисунке, проверьте его на герметичность.
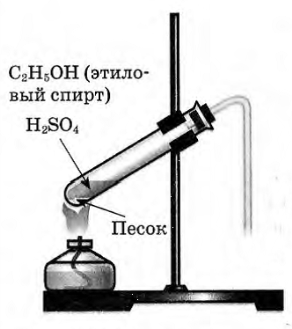
- Отмерьте мерным цилиндром 1мл этилового спирта и перелейте в пробирку, затем осторожно добавьте 3 мл концентрированной серной кислоты.
- Поместите в смесь немного предварительно прокаленного песка (или кусочек пемзы), чтобы избежать толчков жидкости при кипении
- Закройте пробирку пробкой с газоотводной трубкой и укрепите в штативе. Конец газоотводной трубки опустите в пробирку с йодной водой (бромной водой).
- Осторожно нагревайте смесь!
- Оформите работу в соответствии с образцом (табл.1)
- Опишите физические свойства этилена:
- Агрегатное состояние
- Цвет
- Запах
Опыт 2. Взаимодействие этилена с йодной (бромной) водой
• Пропускайте этилен через 1-2 мл йодной (бромной) воды.
• Следите, чтобы нагревание смеси не прекращалось. Не допускайте переброс жидкости из пробирки в прибор.
• Какие изменения происходят с йодной (бромной) водой? Объясните наблюдаемое явление.
Опыт 3. Взаимодействие этилена с раствором перманганата калия
• Пропускайте газ через 1-2 мл раствора перманганата калия.
• Объясните, что наблюдаете?
Опыт 4. Горение этилена на воздухе
• Выньте газоотводную трубку из раствора, и повернув её отверстием к верху, подожгите выделяющийся газ.
• Каким (светящимся или несветящимся) пламенем горит этилен? Дайте объяснение.
• Потушите спиртовку. Выделение этилена постепенно прекратится.
Рисунок с соответствующими надписями. Наблюдения.
Источник
Получение этилена и исследование его свойств. Подготовка к уроку

Просмотр содержимого документа
«инструкция практическая работа»
Практическая работа №2
«Получение этилена и изучение его свойств».
Уравнения реакции и выводы
Рассмотрите и соберите прибор как показано на рисунке, проверьте его на герметичность.
Отмерьте мерным цилиндром 1мл этилового спирта и перелейте в пробирку, затем осторожно добавьте 3 мл концентрированной серной кислоты.
Поместите в смесь немного предварительно прокаленного песка (или кусочек пемзы), чтобы избежать толчков жидкости при кипении
Закройте пробирку пробкой с газоотводной трубкой и укрепите в штативе. Конец газоотводной трубки опустите в пробирку с йодной водой (бромной водой).
Осторожно нагревайте смесь!
Изучение свойств этилена
Опишите физические свойства этилена:
Опыт 2. Взаимодействие этилена с йодной (бромной) водой
• Пропускайте этилен через 1-2 мл йодной (бромной) воды.
• Следите, чтобы нагревание смеси не прекращалось. Не допускайте переброс жидкости из пробирки в прибор.
• Какие изменения происходят с йодной (бромной) водой? Объясните наблюдаемое явление.
Опыт 3. Взаимодействие этилена с раствором перманганата калия
• Пропускайте газ через 1-2 мл раствора перманганата калия.
• Объясните, что наблюдаете?
Опыт 4. Горение этилена на воздухе
• Выньте газоотводную трубку из раствора, и повернув её отверстием к верху, подожгите выделяющийся газ.
• Каким (светящимся или несветящимся) пламенем горит этилен? Дайте объяснение.
• Потушите спиртовку. Выделение этилена постепенно прекратится.
Определите молекулярную формулу этиленового углеводорода, молекулярная масса которого 96?
Сделайте общий вывод о проделанной работе, исходя из цели
Просмотр содержимого документа
«маршрутный лист»
Предлагаю выполнить вам тренировочное упражнение
«Непредельные углеводороды — Алкены»
и упражнение контрольного характера «контрольные задания В1».
Можете начать работу с любого упражнения.
Инструкция для работы в лаборатории «Он-лайн работа»
Пройди по ссылке в РЭШ, выполни тест и оцени свои знания.
Пройди по ссылке в РЭШ, выполни тренировочные упражнения и виртуальную лабораторную работу, проверь результаты и запиши в маршрутный лист.
Инструкция для работы в лаборатории «Практическая работа»
Повторите правила техники безопасности и оцените свои знания.
Оценку запиши в маршрутный лист
Выполни практическую работу, заполни форму отчета.
Следи за порядком на своем рабочем месте
Сдай отчет учителю
В лаборатории «Он-лайн работа» пройди по ссылке и оцени свою работу на уроке.
Источник
Получение этилена и исследование его свойств

Данная практическая работа может использоваться как теоретический материал при подготовке к практической работе на уроке. Учащиеся дома повторяют правила техники безопасности, изучают цель работы, какое оборудование и реактивы необходимы в ходе работы, а так же какие наблюдения и выводы нужно будет записать при оформлении отчета.
Просмотр содержимого документа
«Получение этилена и исследование его свойств»
Общие положения техники безопасности на уроках химии
Химия – предмет, который предполагает изучение и работу с химическими веществами.
Во время урока, при работе учащихся могут иметь место вредные и опасные факторы:
отравление химическими веществами;
получение химических ожогов агрессивными веществами;
травмирования осколками стекла;
травмирования в результате взрыва или самовозгорания химических веществ, при нарушении условий их хранения.
Поэтому на уроках химии учащимся, прежде всего, нужно усвоить «химическую практику» и правила безопасного обращения с химическими веществами.
Это означает, что:
учащиеся обязаны знать свойства веществ, с которыми они работают и безопасные приемы обращения с ними;
выполнять требования безопасности при обращении со стеклянной посудой и ампулами;
знать правила обезвреживания и уничтожения вредных веществ;
выполнять только порученную учителем работу;
выполнять правила эксплуатации используемого оборудования;
соблюдать правила личной гигиены;
содержать рабочее место в чистоте;
правильно применять средства индивидуальной и коллективной защиты;
знать и соблюдать требования пожарной безопасности и уметь пользоваться средствами пожаротушения;
немедленно извещать учителя о любой ситуации, угрожающей здоровью и жизни людей (учеников), об инциденте или ухудшении состояния своего здоровья;
уметь оказывать первую (доврачебную) помощь при несчастных случаях (отравлении, термическом и химическом ожогах).
В кабинете химии должны быть в наличии:
аптечка, содержащая медикаменты для оказания первой медицинской помощи;
раствор для нейтрализации токсичных веществ, применяемых в работе;
средства индивидуальной защиты;
средства пожаротушения (огнетушитель, ящик с песком). Тара, в которой хранятся химические вещества должна иметь четкие надписи.
В кабинете химии ЗАПРЕЩАЕТСЯ:
выполнение работ, не связанных с заданием или во внеурочное время;
хранение химических веществ в таре, не имеющей надписи;
совместное хранение в непосредственной близости друг к другу веществ, которые могут вызвать в результате химического взаимодействия пожар или взрыв;
хранение химических веществ в количествах, превышающих суточную норму;
применение химической посуды для личного пользования;
бегать и прыгать;
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Описание опыта, рисунок
Наблюдения и уравнения реакций
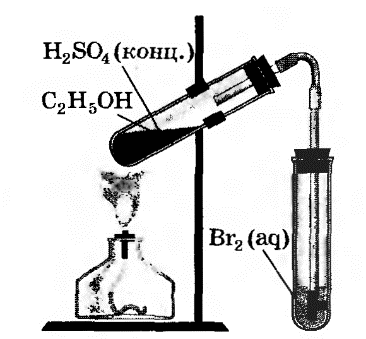
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
В пробирке начинается выделяться газ — этилен.
С2H5OH 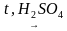
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
Изучение свойств этилена.
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
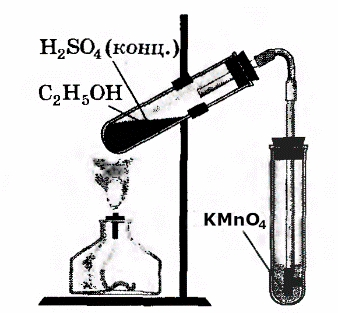
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.
При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
Выделяющиеся газ первой пробирки подожгли.
Этилен на воздухе горит ярким светящимся пламенем.
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D(возд.) = Mr (алкена)/Mr (воздуха);
Mr (алкена) = D(возд.)* Mr (воздуха);
Mr (алкена) = 1,45*29 = 42.
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D(Н2) = Mr (алкена)/Mr (Н2);
Источник
Этилен, структурная формула, химические, физические свойства
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Видео
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
— дегидратация этилена при его нагревании с серной кислотой (t >150 
— дегидрирование этана при нагревании (500
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции окисления
1. Горение. Взаимодействие с кислородом
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
Приведём уравнение реакции горения алкенов в общем виде:
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
В схемах обычно изображают формулы исходного органического вещества и продукта его превращения. При этом легче проследить за изменениями органического вещества в ходе реакции. В схемах, как правило, ставят коэффициенты только перед формулами органических веществ. Формулы реагентов, под действием которых происходит превращение органического вещества, принято писать над стрелкой. В данном случае это перманганат калия (KMnO4) и растворитель (вода).
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH , то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Видео 15.1. Качественные реакции на двойную связь Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии. Так же, как и реакция с бромной водой, реакция с растворомперманганатакалияявляетсякачественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π -связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду.
Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни.
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации.
Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь.
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com
Найти что-нибудь еще? 

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена напишите уравнение реакций этилен
Источник