Получение металлического лития
Металлический литий получают двумя способами: электролизом и вакуумтермией. Вследствие высокой химической активности лития и термодинамической устойчивости его соединений процессы его получения связаны с рядом трудностей. Они заключаются в ограниченности выбора возможных способов получения, в необходимости защиты получающегося металла от действия кислорода, азота, углекислого газа и водяных паров, в подборе конструкционных материалов, устойчивых к действию лития и его соединений при повышенной температуре.
Электрохимическое получение лития. Электрохимические характеристики показывают, что литий можно получить только электролизом расплавов, электролиз водных растворов невозможен. В водных растворах электродный потенциал лития имеет очень большое отрицательное значение, вследствие чего на катоде при электролизе будет выделяться водород. Для электролиза обычно используют расплавы галогенидов, однако индивидуальные галогениды лития LiCl и LiF для этой цели непригодны вследствие высоких температур плавления, при которых давление паров лития становится довольно большим. Для снижения температуры плавления электролита используют смесь LiCl и КС1 в соотношении 1:1; такой состав близок к составу эвтектики в системе LiCl– КС1 [58,5 % (мол.) LiCl, Тпл = 361°С ]. Электролиз проводят при 400–430°С.
Напряжение разложения хлоридов магния, кальция и натрия в расплавах меньше напряжения разложения хлорида лития при 700°С, В:
2,60 3,38 3,39 3,41 3,53
Эти элементы будут восстанавливаться на катоде раньше лития и поэтому будут полностью переходить в металл. Напряжение разложения хлорида калия лишь очень немного больше напряжения разложения хлорида лития. Такая небольшая разница сохраняется в широком интервале температур. В результате выделение калия на катоде увеличивается при обеднении расплава электролита хлоридом лития, поэтому состав электролита постоянно нужно корректировать, добавляя LiCl и не допуская снижения его концентрации ниже 55–57%. Для уменьшения загрязнения металлического лития магнием, кальцием и натрием необходимо использовать исходный хлорид лития высокой степени чистоты.
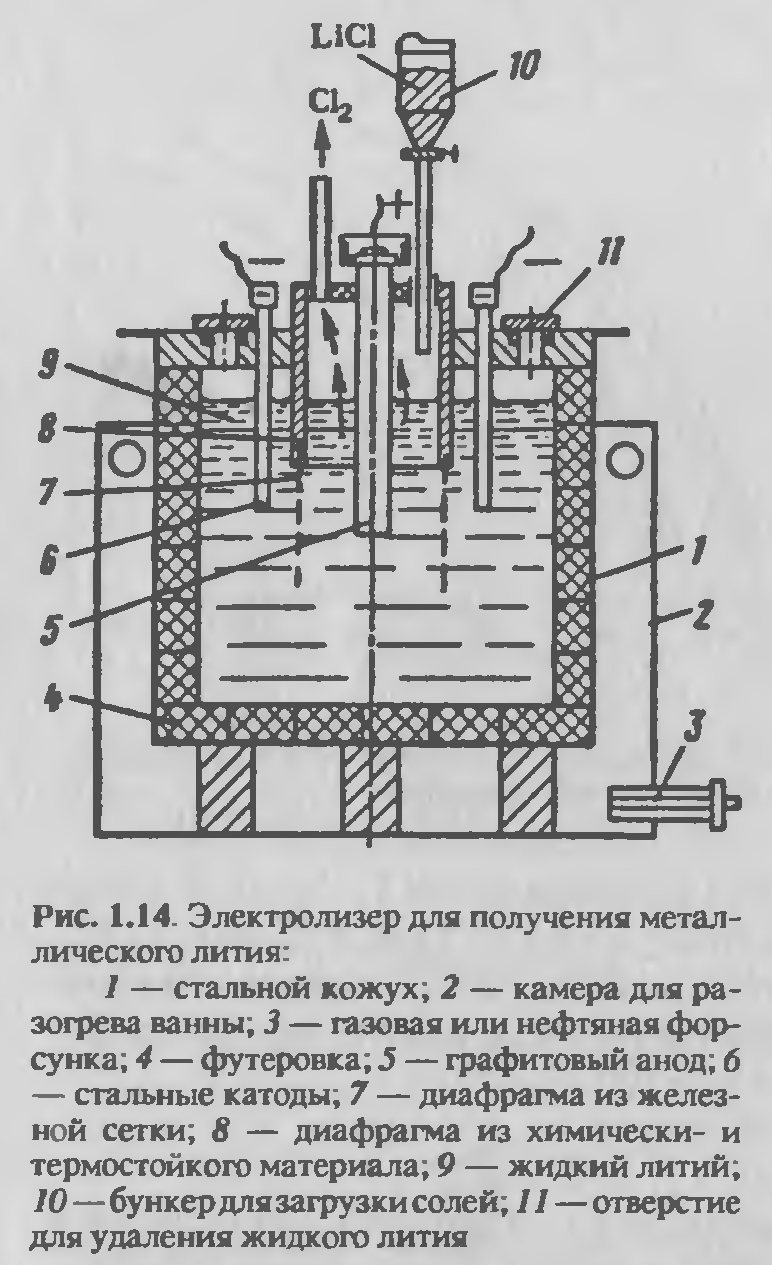
Для электролиза используют электролизеры с разделенными анодным и катодным пространствами (рисунок 2.13). Корпус электролизера стальной, футерован графитом, материалом, наиболее устойчивым по отношению к расплавленному хлориду лития. Футеровка из графита служит около трех месяцев, так как постепенно разрушается вследствие образования карбида лития. Более чистый металл получают в электролизерах со стальными водоохлаждаемыми стенками, на которых образуется гарнисаж из затвердевших солей электролита. Аноды графитовые, катоды — из малоуглеродистой стали, но могут использоваться и более стойкие металлы, такие как ниобий и тантал. Катодное и анодное пространство разделяют диафрагмой из железной сетки. При электролизе литий, вследствие меньшей плотности, чем расплав солей, собирается на поверхности расплава электролита в катодном пространстве. Расплавленный литий защищен от соприкосновения с воздухом тонкой пленкой расплавленных солей. По мере накопления расплавленного лития он удаляется вручную. Хлор из анодного пространства отсасывается вентиляторами и направляется на нейтрализацию известковым молоком.
Электролиз характеризуется следующими показателями: выход по току 90–93 %, расход электроэнергии на 1 кг лития до 144 кВт·ч. И извлечение лития до 95 %, напряжение на ванне 6–6,6В. Содержание примесей в электролитическом литии, %: 0,3–2,5 Na; 0,02–1,50 К; 0,002–0,12 А1; 0,003 Mg; 0,001–0,04 Са, Fe, Сu; 0,004–0,8 Si; 0,01 С1.
Электрохимический метод может быть использован для получения сплавов лития с другими металлами — магнием, алюминием, кальцием, свинцом и др. При получении сплавов с легкоплавкими металлами с невысокой плотностью возможны два варианта проведения процесса электролиза. По первому — хлорид соответствующего металла вводится в состав электролита; по второму — из этого металла изготовляется катод, который по мере выделения лития растворяется в нем. В обоих случаях образуется жидкий сплав, собирающийся на поверхности расплава электролита.
Электрохимический метод является достаточно эффективным и применяется в промышленных масштабах. В то же время он не лишен недостатков, важнейшие из которых следующие: необходимый для него безводный хлорид лития высокой чистоты является дорогим продуктом; получающийся металлический литий загрязнен примесями, прежде всего натрием, что требует дополнительной его очистки; выделяющийся при электролизе хлор необходимо обезвреживать.
Рисунок 2.13 — Электролизер для получения металлического лития.
Вакуумтермическое восстановление. Термодинамический анализ реакций типа приведенной ниже показывает, что большинство из них характеризуется положительными значениями изменения энергии Гиббса особенно велики они для восстановления фторидов и хлоридов:
LiX + M → Li + MX, где Х — F, С1, О.
Это является следствием того, что соединения лития с кислородом и особенно с фтором и хлором термодинамически более прочны, чем соответствующие соединения наиболее активных металлов-восстановителей (Na, Са, Mg, А1 и др.). При таких термодинамических характеристиках осуществление металлотермического процесса становится возможным при условии удаления получаемого металла из зоны реакции или связывания получаемых продуктов каким-либо компонентом, дополнительно вводимым в исходную шихту. В результате равновесие реакции смещается вправо, этому благоприятствует относительно низкая температура кипения лития.
Наиболее подходящими для восстановления оксида лития оказались элементарный кремний и металлический алюминий, имеющие высокие температуры кипения.
При восстановлении лития кремнием в шихту вводят оксид кальция, который связывает образующийся оксид кремния и препятствует образованию силиката лития. Суммарная реакция процесса может быть выражена уравнением:
Оксид лития, необходимый для процесса, получают термическим разложением карбоната лития. Для этого нагревают в вакууме при 850°С брикетированную смесь Li2CO3 и СаО, взятых в соотношении 1:1,5. Оксид кальция добавляют для предотвращения плавления карбоната и облегчения удаления углерода. Полученную смесь оксидов измельчают, шихтуют с кремнием, который берется с избытком 10 %, нагревают в вакуумной печи при давлении 0,1 Па и температуре 1000–1300°С. Извлечение лития при 1000°С составляет 75 %, а при 1300 °С увеличивается до 93 %. Основные примеси в металлическом литии: 0,01 % Si и 0,04 % Са.
При восстановлении оксида лития алюминием в шихту также добавляют оксид кальция, который связывает образующийся оксид алюминия и препятствует образованию алюмината лития:
Лучшие результаты по получению лития повышенной чистоты дает восстановление алюмината лития, которое не требует введения в шихту СаО.
Исходный алюминат получают путем взаимодействия стехиометрических количеств карбоната лития и оксида алюминия в вакууме при 900–1000°С. Процесс восстановления проводят при давлении 10 Па и температуре 1150–1200 °С. Извлечение лития достигает 95–98 %.
Металлотермическое восстановление оксида лития имеет некоторые преимущества перед электролизом расплавов: в качестве исходного сырья используется карбонат лития, являющийся основным продуктом большинства современных технологических схем переработки литиевого сырья. Способ позволяет получать из технических продуктов более чистый литий, чем электрохимический метод; восстановителями служат кремний и алюминий, относительно дешевые и доступные.
Дата добавления: 2015-06-22 ; просмотров: 3637 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
2.5. Получение металлического лития
Металлический литий получают двумя способами – электролизом и вакуумтермией. Вследствие высокой химической активности лития и термодинамической устойчивости его соединений процессы его получения связаны с рядом трудностей. Они заключаются в ограниченности выбора способов получения, в необходимости защиты получающегося металла от действия кислорода, азота, углекислого газа и водяных паров, в подборе конструкционных материалов, устойчивых к действию лития и его соединений и его соединений при повышенной температуре.
Электрохимическое получение лития.Металлический литий можно получить только электролизом расплавов, электролиз водных растворов невозможен, так как в водных растворах нормальный электродный потенциал лития имеет очень высокое отрицательное значение, вследствие чего на электроде будет выделяться водород (см. табл. 1). Обычно для электролиза используют расплавы галогенидов, однако индивидуальные галогениды лития непригодны из-за высоких температур плавления, при которых давление паров металлического лития становится довольно большим (см. табл. 1). Для снижения температуры плавления электролита используют смесь LiCl и KCl в соотношении 1:1, этот состав близок по составу к эвтектике в системе LiCl – KCl (58,5 мол. % LiCl, Т пл. = 361ºC). Электролиз проводят при 400 — 430 ºC. Напряжение разложения хлоридов магния, кальция и натрия в расплавах меньше напряжения разложения хлорида лития при 700 ºC, В:
MgCl2 CaCl2 NaCl LiCl KCl
2,60 3,38 3,39 3,41 3,53
Эти элементы будут восстанавливаться на катоде раньше лития, и поэтому будут полностью переходить в металл. Напряжение разложения хлорида калия лишь немного больше напряжения разложения хлорида лития (ΔΕ = 0,11 В). Эта небольшая разница сохраняется в широком интер-вале температур, при 405 ºC значения напряжений разложения LiCl и KCl 3,78 и 3,89 В соответственно. Выделение калия на катоде увеличивается при обеднении расплава электролита хлоридом лития, поэтому состав электролита нужно корректировать, не допуская снижения концентрации LiCl ниже 55-57%. Для уменьшения загрязнения металлического лития магнием, кальцием и натрием необходимо использовать исходный хлорид лития высокой степени чистоты.
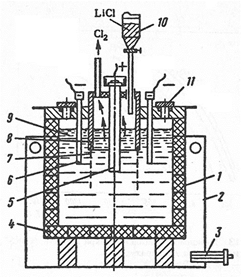
Для электролиза используют электролизеры с разделенным анодным и катодным пространствами (рис. 17).
Рис. 17. Электролизер
Корпус электролизера стальной, футерован графитом, который устойчив к расплавленному хлориду лития. Графитная футеровка служит около трех месяцев, так как постепенно разрушается из-за образования карбида лития. Более чистый металл получают в электролизерах со стальными водоохлаждаемыми стенками, на которых образуется гарниссаж из затвердевших солей электролита. Аноды графитовые, катоды – из малоуглеродистой стали, но можно использовать и более стойкие материалы (ниобий, тантал). Катодное и анодное пространство разделено диафрагмой из железной сетки. При электролизе литий вследствие меньшей плотности, чем расплав солей (см. табл. 1 и 3) собирается на поверхности расплава электролита в катодном пространстве. Расплавленный литий защищен от соприкосновения с воздухом пленкой расплавленных солей. По мере накопления расплавленного лития он удаляется вручную. Хлор из анодного пространства отсасывается вентиляторами и отправляется на нейтрализацию известковым молоком.
Электролиз характеризуется следующими показателями: выход по току 90-93 %, расход электроэнергии на 1 кг лития до 14 кВт∙ч, извлечение лития до 95 %, напряжение на ванне 6,0-6,6 В. Содержание примесей в электролитическом литии, %: 0,3 – 2,5 Na; 0,02 – 1,50K; 0,02 – 0,12 Al; 0,003 Mg; 0,001 – 0,04 Ca; 0,004 – 0,85 Si; 0,01 Cl.
Электрохимический метод можно использовать для получения сплавов лития с магнием, алюминием, кальцием, свинцом и др. При получении сплавов с легкоплавкими металлами с невысокой плотностью возможны два варианта проведения процесса электролиза. По первому – хлорид соответствующего металла вводится в состав электролита; по второму – из этого металла изготовляется катод, который по мере выделения лития растворяется в нем. Образующийся жидкий сплав собирается на поверхности расплава электролита. Электрохимический метод достаточно эффективен и применяется в промышленных масштабах.
Недостаток метода – необходимый для электролиза хлорид лития – дорогой продукт, получающийся металлический литий загрязнен примесями, главным образом натрием, выде-ляющийся хлор нужно обезвреживать.
Вакуумтермическое получение лития.Термодинамический анализ реакций восстановления соединений лития характеризуется положительными значениями ΔG; особенно они велики для восстановления хлоридов и фторидов:
LiX + M ↔ Li + MX, где X – F, Cl, O (39)
Это объясняется тем, что соединения лития с кислородом и особенно с фтором и хлором термодинамически более устойчивы, чем соответствующие соединения наиболее активных металлов-восстановителей (Na, Ca, Mg, Al). Только реакции восстановления оксида лития кальцием и магнием имеют значение ΔG порядка 10 кДж/моль, что свидетельствует об их обратимости. Сам литий используется как металл-восстановитель. При таких значениях ΔG осуществить металлотермический процесс возможно при условии удаления полученного металла из зоны реакции или связывания полученных продуктов дополнительно вводимым компонентом. В результате равновесие реакции (37) смещается вправо, чему благоприятствует относительно низкая температура кипения лития (1317 °C). Низкая температура кипения металлических кальция (1482 °C) и магния (1107 °C) исключает их использование как восстановителей. Наиболее подходящими восстановителями для оксида лития оказались элементарный кремний и металлический алюминий, имеющие высокие температуры кипения (
2500 °C соответственно). Реакция восстановления оксида лития кремнием характеризуется положительными значениями энтальпии и изменения энергии Гиббса:
ΔH = +285 кДж, ΔG = +246 кДж
Реакция (40) экзотермическая, поэтому смещению равновесия вправо помимо удаления лития способствует повышение температуры. Процесс восстановления осложняется протеканием вторичной реакции:
В ортосиликате, который термодинамически очень устойчив, связывается 50 % лития. В шихту вводят дополнительно оксид кальция, который образует устойчивый ортосиликат Ca2SiO4. В присутствии в шихте оксида кальция значительная часть образовавшегося оксида кремния взаимодействует с CaO, а образовавшийся силикат лития сам может восстанавливаться по реакции:
Суммарная реакция процесса выражается уравнением
Необходимый для процесса оксид лития получают термическим разложением карбоната лития. Для этого брикетированную смесь Li2CO3и CaO в соотношении 1:1,5 нагревают в вакууме до 850 °C. Оксид кальция добавляют для предотвращения плавления Li2CO3и облегчения удаления CO2. Полученную смесь оксидов Li2O и CaO измельчают, шихтуют с кремнием (избыток 10 %) и нагревают в вакуумной печи при давлении
0,1 Па и температуре 1000-1300 °C. Извлечение лития при 1000 °C – 75 %, а при 1300 °C – 93 %. Основные примеси – 0,01 % Si и 0,04 % Ca.
При восстановлении оксида лития алюминием часто литий связывается в алюминат LiAlO2:
Для предотвращения потерь лития в шихту добавляют CaO, который образует алюминат Ca(AlO2)2:
Лучшие результаты, позволяющие получать металлический литий повышенной чистоты, получаются при восстановлении алюмината лития по реакции:
Исходный алюминат получают при взаимодействии стехиометрических количеств Li2CO3и Al2O3в вакууме при 900-1000 °C. Процесс восстановления проводят при давлении
10 Па и температуре 1150-1200 °C. Извлечение лития – 95-98 %.
Металлотермическое восстановление оксида лития имеет преимущества перед электролизом: в качестве исходного сырья используется карбонат лития, являющийся основным продуктом большинства технологических схем переработки литиевого сырья. Способ позволяет получать более чистый литий, восстановителями являются кремний и алюминий, относительно дешевые и доступные.
Рафинирование лития.Металлический литий, полученный тем или иным способом, содержит примеси щелочных, щелочноземельных и тяжелых металлов, неметаллические примеси (кислород, азот), твердые частицы. При получении лития высокой степени чистоты прежде всего удаляют твердые частицы методом отстаивания расплав-ленного металла под слоем парафинового или трансформа-торного масла или фильтрованием через сетчатые фильтры из железной, титановой или молибденовой проволоки. Кислород и азот удаляют с помощью четтеров – порошкообразных или губчатых титана и циркония. После обработки при 800 °C в течение 24 ч литий содержит следы кислорода и азота. Натрий и калий удаляют методом, основанном на различной устойчивости гидридов.
При 700-800 °C в водороде гидриды NaOH и KOH не образуются. Гидрид лития разлагают нагреванием в вакууме. Наибольшее значение среди методов рафинирования лития имеет вакуумная дистилляция, которая позволяет очищать литий от щелочных, щелочноземельных и тяжелых металлов. Процесс проводят при остаточном давлении 10 -1 – 10 -5 Па. Сначала при 450 °C отгоняют натрий и калий, затем при 600-800 °C испаряют литий; температура в конденсаторе – 340-420 °C. При извлечении лития в конденсат содержание примесей снижается до n∙10 -3 %. Наибольшие трудности представляет удаление магния. Качество очистки лития во многом зависит от конструкционных материалов аппаратуры. Для переплавки лития используют тигли из ZrO2, футерованные LiF. Устойчивы к действию расплавленного лития и его паров до 800 °C высокохромистые стали (до 17 % Cr), чистые железо, титан, молибден, ниобий.
Источник