- Приготовление мазков и их фиксация
- Методы окраски мазков и красители, используемые в микробиологии.
- Для чего фиксируют мазок способы фиксации мазков
- Окрашенные мазки. Отбор материала для микроскопии
- Фиксация препарата. Фиксация мазка. Фиксация бактерий
- Для чего фиксируют мазок способы фиксации мазков
- Для чего фиксируют мазок способы фиксации мазков
- Окрашенные мазки. Отбор материала для микроскопии
- Фиксация препарата. Фиксация мазка. Фиксация бактерий
- Способы фиксации мазков из микробов и смешанного материала
- Ориентировочная окраска бактерий простыми методами.
- Микроскопия препарата с иммерсионным объективом
Приготовление мазков и их фиксация
Приготовление окрашенного препарата состоит из следующих этапов:
1) приготовление мазков;
2) высушивание мазка;
3) фиксация мазка;
Для приготовления препарата, на обезжиренное предметное стекло, наносят каплю воды или физиологического раствора, в которую петлей вносят исследуемый материал и распределяют тонким равномерным слоем по стеклу на площади приблизительно 1 см 2 . Если исследуемый материал находится в жидкой среде, то его непосредственно наносят петлей на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем спиртовки, не давая капле закипать.
Для фиксации мазка предметное стекло (мазком вверх) медленно проводят 3-4 раза через пламя спиртовки. Микроорганизмы при фиксации погибают, плотно прикрепляются к поверхности стекла и не смываются при дальнейшей обработке. Более длительное нагревание может вызвать деформацию клеточных структур.
При фиксации с помощью химических веществ используют хромовые соединения, формалин, осмиевую кислоту, ацетон. Один из распространенных приемов фиксации — обработка препарата метиловым или этиловым спиртом, или смесью Никифорова (равные объемы этилового спирта и эфира). При этом препарат погружают на 5-20 мин. в фиксирующую жидкость.
Методы окраски мазков и красители, используемые в микробиологии.
Существуют простые и сложные методы окраски. При простой окраске используют какой-либо один из красителей, например, фуксин водный (1-2 мин.), метиленовый синий (3-5 мин.). При окрашивании мазка препарат помещают на препаратодержатель. На мазок наносят несколько капель красителя. После истечения времени окрашивания препарат промывают водой, фильтровальной бумагой удаляют излишки воды, высушивают на воздухе и микроскопируют.
При сложной окраске последовательно наносятся на препарат определенные красители, различающиеся по химическому составу и цвету. Это позволяет выявить определенные структуры клеток и дифференцировать одни виды микроорганизмов от других. Таковы методы окраски по Грамму, по Цилю-Нильсену, окраска спор по методу Ожешки.
Красители, у которых при диссоциации выделяются водородные ионы, придающие красителю кислый характер, называются кислыми. Они окрашивают (в виде аниона) вещества основной природы. Красители, у которых при диссоциации выделяются гидроксильные ионы, — основными.
В микробиологической практике кислые и основные красители используются в виде солей, так как они способны вступать в реакцию с кислотами и основаниями. Основные красители чаще применяются в виде солей соляной, реже уксусной и серной кислот; кислые красители – в виде натриевых или калийных солей.
Источник
Для чего фиксируют мазок способы фиксации мазков
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
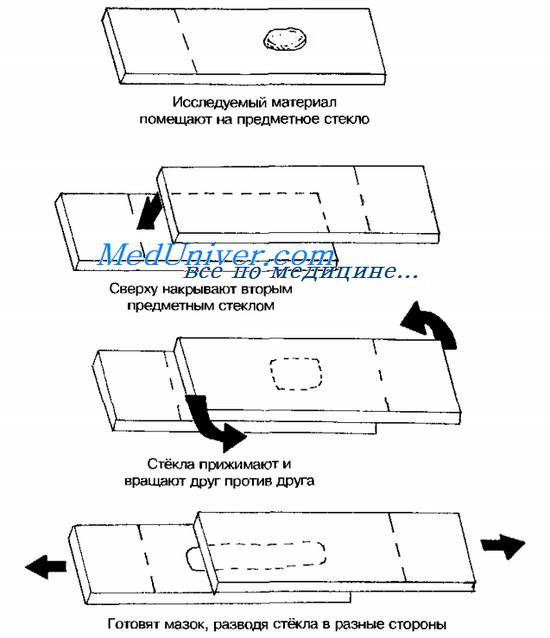
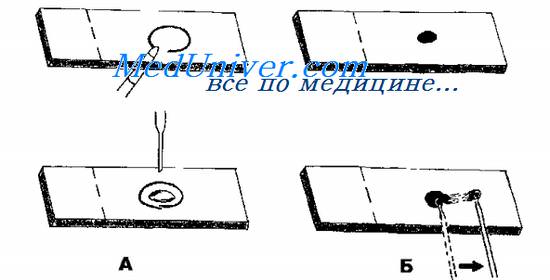
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).
Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.
Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Источник
Для чего фиксируют мазок способы фиксации мазков
Содержимое заднего свода влагалища для исследования берут браншей пинцета, узким деревянным шпателем или стеклянной пипеткей длиной 20 см, диаметром 5—7 мм с изогнутым дистальным концом и резиновым баллоном на проксимальном конце. Так как особенности влагалищного содержимого могут быть различными в зависимости от длительности пребывания во влагалище и особенностей его моторной функции, рекомендуется за 2 дня до взятия мазка механически очистить влагалище от содержимого и воздерживаться от влагалищных манипуляций и половых сношений. У девственниц содержимое влагалища берут проволочной петлей через ушное или носовое зеркало или с помощью детского вагиноскопа.
Предметные стекла для влагалищных мазков должны быть предварительно обезжирены. Мазок делают с помощью шлифопанного стекла. Он должен быть тонким. При скудном содержимом влагалища насасывают в пипетку до взятия мазка каплю изотонического раствора хлорида натрия и разведенные выделения наносят на стекло. Мазок фиксируют по влажном состоянии в течение 15 мин смесью 96% этилового спирта и диэтилового эфира (1 : 1). Мазок может оставаться в фиксирующем растворе в течение 15 дней.
При подготовке влагалищного мазка для полихромной окраски рН фиксирующего раствора снижают с 6,9—7 до 5,6—6, что способствует большей восприимчивости клеток к ацидофильной окраске. Для этого мазок фиксируют смесью из изопропилового спирта (97,5 части) и ледяной уксусной кислоты (2,5 части).
1. Упрощенный метод окраски. Высушенный на воздухе мазок окрашивают 1 % раствором метиленового синего в течение 2 мин или раствором фуксина (3 г фуксина+96 мл абсолютного спирта) в течение 1 мин. Краску смывают проточной водой и мазок высушивают.
2. Окраска гематоксилин-эозином. Фиксированный в смеси спирта с эфиром мазок окрашивают в течение 15 мин в растворе гематоксилина, смывают краску водой, окрашивают на протяжении 3—5 мин эозином и повторно смывают водой. Для обесцвечивания ядер мазок проводят последовательно через 70% (5 мин), 95% (5 мин) и 100% (8 мин) спирт, высушивают, помещают на 15 мин в ксилол и заключают в канадский бальзам.
3. Полихромная окраска. Применяются три краски — гематоксилин для окрашивания ядер клеток влагалищного эпителия, оранж 0,6 (ацидофильная) и зелень лихтгрюн Lumiere EA-31 (базофильная).
Фиксированный мазок проводят последовательно через 70% и 50% спирт, погружают в дистиллированную воду, окрашивают в течение 5— 10 мин гематоксилином. Промывают в дистиллированной воде, 4—5 раз в 0,5% водном растворе НСl, а затем проточной водой. На 1 мин мазок погружают в карбонат кальция (3 капли насыщенного водного раствора на 100 мл воды) и проводят последовательно через 50%, 70%, 80% и 95% спирт, в течение 3—4 мин окрашивают оранжем, проводят дважды через 95% спирт, погружают на 10—15 мин в краску ЕА-31, затем в 95% и абсолютный спирт и заключают в канадский бальзам.
Ядра влагалищных клеток окрашиваются интенсивно в светло-синие, темно-пурпурные тона, цитоплазма базофильных клеток — в голубовато-зеленоватые тона, цитоплазма ацидофильных клеток — в желтовато-оранжевые, розовато-красные тона.
Влажный фиксированный мазок окрашивают специальным сложным составом из ряда красок в течение 2 мин. Последовательно проводят мазок через 70%, 90% и абсолютный спирт, помещают в ксилол и заключают в канадский бальзам.
Состав краски: а) этилового спирта 100 мл, шарлаха бибиховского 0,5 г, оранжа 0,25 г, зеленой 0,075 г, фосфорно-молибденовой кислоты 0,5 мл, фосфорно-вольфрамовой кислоты 0,5 мл, ледяной уксусной кислоты 1 мл;
б) фосфорно-вольфрамовой кислоты 0,5 мл, фосфорно-молибденовой кислоты 0,5 мл, ледяной уксусной кислоты 1 мл, эритрозина 0,5 г, бриллиантового зеленого 0,075 г, 20% водного раствора анилинового синего 20 мл, 60% спирта 80 мл.
Окраска цитоплазмы и ядер клеток аналогична окраске по методу Паваниколау.
Комбинация приведенных выше методов окраски. Фиксированный мазок на 2—4 мин помещают в приготовленный полихромный протоплазменный краситель, затем последовательно помещают в 75% и 95% спирт и ксилол. Высушивают и заключают в кедровое масло.
Состав краски: оранжа 0,100 г, эритрозина 0,250 г, лихтгрюна 0,200 г, фосфорно-молибденовой кислоты 0,200 г, фосфорно-вольфрамовой кислоты 0,200 г, ледяной уксусной кислоты 1 г, 50% спирта 100 мл. Для приготовления краски 50% спирт разделяют на три равные части, в каждой из них растворяют отдельно оранж, лихтгрюн и эритрозин. После полного растворения каждой краски все смешивают и добавляют остальные реактивы.
Цитоплазма базофильных клеток окрашивается в светло-зеленые тона, ацидофильных — в золотисто-розовые.
Для лучшего прокрашивания ядер способ окраски несколько видоизменяют. Фиксированный мазок окрашивают гематоксилином в течение 1 мин, промывают проточной водой, после чего в течение 2—4 мин окрашивают описанным выше способом полихромным красителем.
Фиксированный одним из описанных выше способов мазок промывают в течение 2 мин в дистиллированной воде, окрашивают в течение 1—3 мин гематоксилином, промывают в течение 4—10 мин проточной водой, на 2 мин помещают в смесь из 70% изопропилового спирта с 2,5% уксусной кислоты; окрашивают по второму способу, промывают и снова помещают на 2 мин в смесь изопропилового спирта с уксусной кислотой (2,5%), на 2 мин в изопропиловый спирт, на 2 мин в ксилол и заключают в канадский бальзам.
Источник
Для чего фиксируют мазок способы фиксации мазков
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).

Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.

Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Источник
Способы фиксации мазков из микробов и смешанного материала
Фиксация необходима для инактивации бактерий и прикрепления (фиксации) их к стеклу, предотвращения аутолизиса клеток и улучшения восприятия красителя.
а) Самым распространённым методом фиксации бактерий считается обработка жаром, что осуществляется путём трёхкратного проведения препарата мазком кверху через пламя спиртовки или газовой горелки. Препарат находится в пламени спиртовки З секунды. После чего препараты из бактерий окрашиваются разными способами. Метод применим при работе с чистой культурой микробов.
б) Фиксация химическими веществамииспользуется для выявления и дифференциации структурных элементов: жгутиков, протоплазмы, нуклеоида, оболочки, при работе со смешанным материалом (кровь, отпечатки органов, соскобы со слизистых, гной, мокрота). В качестве фиксаторов используют:
— метиловый спирт (фиксируют 5 минут),
— этиловый спирт (фиксируют 20 минут),
— смесь Никифорова: равные объёмы спирта и эфира (фиксируют 20 минут),
— спирт — формол: смесь 5мл неразведённого формалина мл и 96 % этилового спирта (фиксируют 15 минут),
— жидкость Боуэна: неразбавленный формалин 10 мл, ледяная уксусная кислота 2 мл, насыщенный водный раствор пикриновой кислоты 30 мл (фиксируют 30 минут),
— жидкость Карнуа — ледяная уксусная кислота 10 мл, хлороформ 30 мл и 96 % спирт (фиксируют 15 минут).
Ориентировочная окраска бактерий простыми методами.
Окраска выявляет морфологию и частично структуру клетки.
Для простой окраски используют один из красителей:
а) разведённый (1:10) карболовый фуксин, окрашивают 10-30 сек. (метод Леффлера), промывают водой, высушивают на воздухе;
б) водньий раствор метиленовой синьки Леффлера окрашивают 3-10 минут, промывают водой, высушивают на воздухе.
Микроскопия препарата с иммерсионным объективом
Иммерсионный объектив даёт увеличение х90 при условии отсутствия рассеивания потока лучей в связи с неоднородностью среды при их прохождении.
В этой связи, во избежание такого дефекта применяется иммерсионное кедровое масло или его заменитель — вазелиновое масло. Процесс микроскопии с иммерсионным объективом х90 ведут с окулярами х7, х10, но чаще с первым из них. Техника микроскопии состоит из нескольких этапов:
1. На готовый окрашенный мазок наносят каплю масла.
2. Под контролем глаза сбоку осторожно опускают тубус, погружая объектив в каплю масла. При неосторожном выполнении можно раздавить либо линзу объектива, либо предметное стекло.
3. После прикосновения объектива к маслу дальнейшее опускание тубуса ведётся с помощью микровинта микроскопа до появления микрообъектов в окуляре.
4. Просмотр препарата ведут только за счёт манипуляций с микровинтом и движения стекла.
5. После окончания микроскопии тубус поднимают, объектив выходит из капли масла.
6. Масло с объектива удаляют чистой ваткой или марлей и протирают жирорастворителем — либо ксилолом, либо спиртом, либо хлороформом. Оставлять масло на линзе объектива нельзя.
7. Револьверную часть на тубусе устанавливают на объектив х8, конденсор и тубус опускают, переводя в нерабочее состояние, и закрывают микроскоп колпаком.
Источник