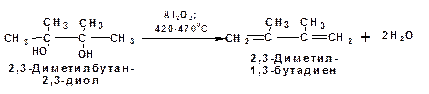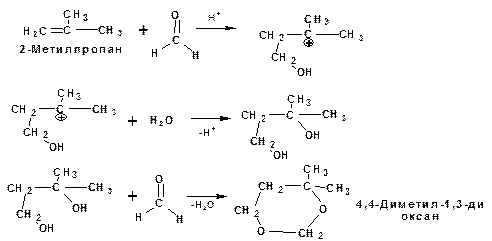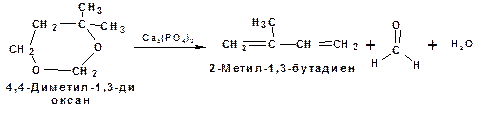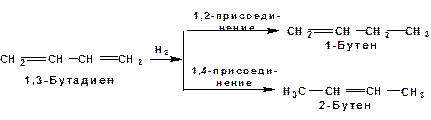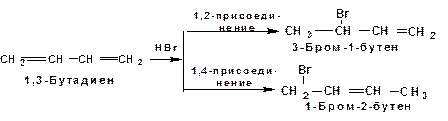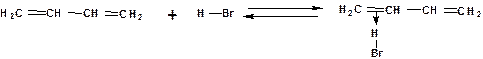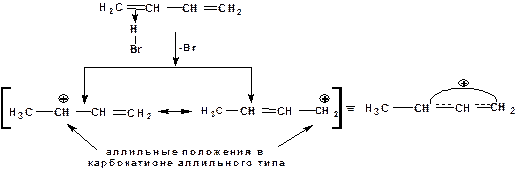- Получение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
- 3. Дегидратация двухатомных спиртов
- 4. Дегидрогалогенирование дигалогеналканов
- Реакция Лебедева: формула, механизм реакции. Получение бутадиена
- Принцип реакции
- Реагенты и продукты
- Механизм реакции
- Использование в промышленности
- Дальнейшее изучение
- Диеновый синтез
- Получение 1,3-бутадиена по Лебедеву.
Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
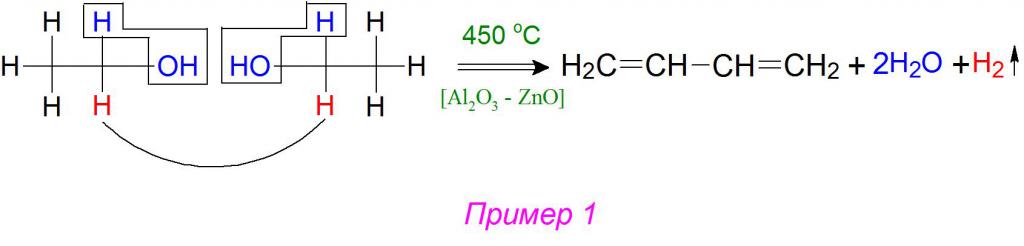
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Реакция Лебедева: формула, механизм реакции. Получение бутадиена
Реакция Лебедева Сергея Васильевича стала отправной точкой в исследованиях способов получения диеновых непредельных углеводородов, которые хорошо применяются до сих пор при создании синтетических каучуков. Данное открытие позволило использовать относительно дешевый и рентабельный метод синтеза искусственной резины для военного и технического назначения, что обеспечило в советские времена выпуск качественной и прочной замены натуральных каучуков.
Принцип реакции
По принципу протекания данный синтез относят к каталитическому пиролизу (термическому разложению), который проходит в присутствии алюмо-цинковых оксидных катализаторов при температуре около 450 °С.
В химии реакция Лебедева примечательна тем, что она проходит в одну стадию, но при этом внутри нее происходит сразу три изменения:
- отщепляется вода;
- отрывается водород;
- происходит присоединение между алкильными остатками.
Синтез неоднократно совершенствовался, применялись новые алюминиевые катализаторы с добавлением солей марганца и других металлов, а также варьировались условия проведения, что позволило снизить энергозатратность при поддержании температуры (360–370 °С) и увеличить степень превращения спирта в ходе реакции (до 50%, выход бутадиена–1,3 составляет 42%).
Реагенты и продукты
В ранних исследованиях С. В. Лебедев прибегал к созданию бутадиена из нефтяных фракций. Однако впоследствии он стал получать данный диен из этилового спирта, полученного путем брожения картофеля. Для получения одной лишь автомобильной шины требовалось переработать до 500 кг картофеля, что, естественно, было экономически невыгодно.
Позже, в период 1926-928 гг., С.В. Лебедев вместе со своей командой из учеников и вольных слушателей усовершенствовал способ получения бутадиена из этилового спирта. Выход диена на момент демонстрации результатов был 22%. Благодаря стараниям, ученые одержали победу на конкурсе, организованном И.В. Сталиным среди сейчас уже бывших стран Советского Союза, по предложениям способов производства синтетического каучука.
Так, теперь в конечном варианте синтеза, в основных продуктах получают бутадиен‒1,3 CH2=CH‒CH=CH2, воду H2O и свободный водород H2. Дополнительно могут образоваться некоторые ароматические соединения, этилен, пропилен, бутилены, высшие спирты и ацетальдегид, но в основном уравнении реакции Лебедева формулы этих веществ не указываются. Поскольку этот диен является газообразным веществом, нерастворимым в воде, его от всех других углеводородов отделяют конденсацией, адсорбцией спиртом, отмывкой H2O или же ректификацией.
Механизм реакции
В синтезе при расщеплении (разложении) 2 молекул этилового спирта, благодаря дегидратирующе-дегидрирующим катализаторам, от них отрываются 2 молекулы воды и 1 молекула газообразного водорода. Согласно механизму реакции Лебедева, алкильные остатки присоединяются друг другу, образуя две непредельные сопряженные двойные связи в 1,3–положениях (пример 1).
Использование в промышленности
После триумфальной победы на международном конкурсе ученому дали возможность осуществить производство синтетического каучука в промышленном масштабе. Так как получение бутадиена по реакции Лебедева было признано очень ценным, его профинансировали, и в 1930 году в Ленинграде был построен опытный завод «Литер «Б»», который вплоть до 1990 года занимал первое место в мире по производству искусственного каучука. На базе этого предприятия впоследствии был создан Всесоюзный научно-исследовательский институт синтетического каучука, который продолжает заниматься изучением полимерных соединений.
Дальнейшее изучение
Открытия С. В. Лебедева послужили началом изучения свойств диеновых углеводородов, благодаря которым был открыт так называемый «диеновый синтез». Существуют три версии, по которым он в ходе научной деятельности изучил реакцию димеризации диенов. Первая предполагает, что в результате синтеза ученый получил димер циклопентадиена. Вторая версия говорит о димеризации изопрена с получением дипентена. А третья описывает получение винилциклогексена из двух молекул бутадиена‒1,3. Во всяком случае этот синтез лег в основу дальнейшего изучения свойств сопряженных диенов, которые развивали Отто Дильс и Курт Адлер, удостоенные Нобелевской премии в 1950 году.
Диеновый синтез
Реакция Дильса-Адлера позволила получать циклосоединения по довольно простым механизмам, не прибегая к сложным многостадийным реакциям. Суть реакции сводится к взаимодействию сопряженного диена и диенофила, который может быть представлен алкенами и алкинами с электроакцепторными заместителями, а также соединениями, содержащими двойные связи с гетероатомом, например –C=O, ‒C=N и др. В результате образуется циклический углеводород, поэтому эту реакцию еще называют «циклоприсоединением».
Синтез по Дильсу-Адлеру может проходить в присутствии кислот Льюиса, которые значительно ускоряют ход реакции и чаще всего способствуют хорошему выходу основного продукта, а также влияет на образование энантиомеров и цис-/транс- изомерии.
Примером такой реакции без катализатора может служить присоединение бутадиена–1,3 к пара-бензохинону в среде бензола при температуре 35 °С, в результате которого выход продукта достигает 100%. Синтез проходит с переходом протонов водорода между углеродными атомами для образования второго цикла и создания прочного соединения. В конце реакции образуется производное 1,4–нафтохинона, который может дальше реагировать с бутадиеном‒1,3 при 100 °С с образованием цикла на противоположной стороне. Из конечного продукта реакции путем дегидрирования можно получить антрахинон, производные которого используются в качестве красителей, например ализарин.
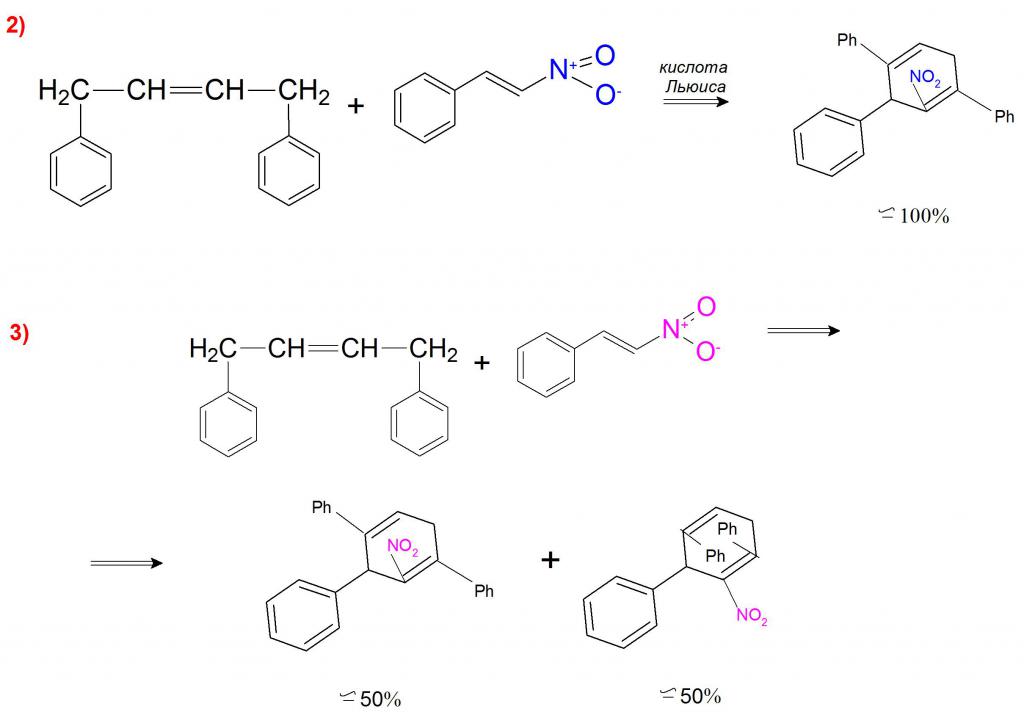
А примером каталитического синтеза может являться реакция 1,4–дифенилбутадиена с β-нитростиролом, где в присутствии кислоты Льюиса образуется только эндо-нитроаддукт (пример 2). Без участия катализатора эта реакция проходит с образованием эндо-нитросоединения и эндо-дифениловых продуктов в соотношении 1:1 (пример 3).
Такие реакции подтверждают целесообразность использования каталитически активных веществ в диеновом синтезе, так как они существенно ускоряют процесс и значительно влияют на регио- (орто-, пара- и мета-положения) и стереоселективность (оптические и эндо-/экзо-положения заместителей).
Источник
Получение 1,3-бутадиена по Лебедеву.
Эта реакция промышленного значения уже практически не имеет, но имеет большое историческое значение, поскольку в канун второй мировой войны способ Лебедева противостоял способу Реппе.
По С.В. Лебедеву 1,3-бутадиен получают из этилового спирта, который получают из крахмала. Крахмал получают из картофеля, а картофель хорошо растет в Татарстане.
Дегидрогенизация (дегидрирование).
Самым выгодным экономически способами производства 1,3-бутадиена и 2-метил-1,3-бутадиена является пиролиз бутана и 2-метилбутана. Реакция идет в две стадии. На первой стадии образуется смесь 1- и 2-алкена, от которых на второй стадии отщепляется еще одна молекула водорода:
В качестве сырья могут быть использованы фракции, образующиеся при крекинге нефти, которые уже содержат смесь исходных алканов и алкенов.
Дегидратация алкандиолов
Дегидратация соответствует одной из стадий в получении 1,3-бутадиена по Реппе. Эта реакция проводится в присутствии минеральных кислот, например:
или в газовой фазе на гетерогенных катализаторах на основе оксида алюминия:
Получение 2-метил-1,3-бутадиена по реакции Принса.
Используемый для производства основного массового каучука СКИ-3 изопрен получают в России (в СССР), в частности в Татарстане в г. Нижнекамск на АО «Нижнекамскнефтехим» — по реакции Принса из изобутилена и формальдегида:
На первой стадии из изобутилена двух молекул формальдегида и воды получают 4,4-диметил-1,3-диоксан. На второй стадии диоксан разлагают на гетерогенном катализаторе на основе фосфата кальция. При этом образуется 2-метил-1,3-бутадиен формальдегид и вода.
Физические свойства.
1,3-Бутадиен при обычных условиях является газом. Изопрен и другие простейшие алкадиены являются жидкостями. Для алкадиенов с сопряженными двойными связями наблюдаются аномально высокие значения показателя преломления света. С использованием показателя преломления составляет основу величины называемой молекулярной рефракцией. Молекулярная рефракция вычисляется по формуле Лорентц-Лоренца с использованием экспериментальных данных по показателю преломления и плотности:
где: МR – молекулярная рефракция;
М – молярная масса;
n D 20 – показатель преломления.
Но молекулярную рефракцию можно рассчитать по системе специальных инкрементов. Например, по системам инкрементов можно достаточно точно рассчитать молекулярную рефракцию алканов, алкенов и алкинов. Но расчеты по системам инкрементов молекулярной рефракции алкадиенов приводили к систематическому занижению результатов, по сравнению с экспериментальными данными. Разница между расчетными значениями и значениями, полученными на основании экспериментальных данных — составляет обычно 1 – 1.5 единицы. Эта разница называется молекулярной экзальтацией.
Наличие системы сопряженных двойных связей в молекулах 1,3-алкадиенов обеспечивает возможность поглощения квантов электромагнитного излучения длинноволновой ультрафиолетовой части спектра. Введение заместителей позволяет поглощать кванты видимой части спектра. Поэтому наличие окрашивания органического соединения указывает на наличие системы сопряженных двойных связей.
Химические свойства.
Две сопряженные π-связи образуют общее облако π-электронов. Наличие этого облака делает возможным присоединение не только к соседним атомам углерода, так называемое 1,2-присоединение:
но и к крайним атомам сопряженной системы, так называемое 1,4-присоединение:
Гидрирование
В условиях гетерогенного катализа, аналогичных гидрированию алкенов, водород присоединяется в 1,2- и 1,4-положения с образованием смеси продуктов:
Гидрогалогенирование
При присоединении галогенводородов к сопряженным диенам образуются два структурных изомера:
Механизм присоединения галогенводорода включает следующие стадии:
1. На первой стадии образуется π-комплекс:
2. На второй стадии образование промежуточного карбкатиона. Эта стадия является медленной (скоростьлимитирующей). Особенностью карбкатиона является возможность представления его в форме резонансных структур:
Образуются два сопряженных карбкатиона.
3. На третьей стадии бромид-ион, образовавшийся на второй стадии, быстро присоединяется к сопряженным карбкатионам с образованием двух возможных изомеров:
Карбкатионы, образующиеся в реакциях электрофильного присоединения к сопряженным диенам, принято называть карбкатионами аллильного типа. Такие карбкатионы характеризуются повышенной устойчивостью. Они более устойчивы, чем третичные карбкатионы. По этой причине сопряженные диены в реакциях электрофильного присоединения более реакционноспособны, чем алкены и алкины.
Поскольку в карбкатионе аллильного типа имеется два реакционных центра присоединение бромид-иона может протекать в двух направлениях. Соотвественно образуется смесь продуктов 1,2-присоединения (прямое присоединение и 1,4-присоединение (сопряженное присоединение).
Однако из двух сопряженных карбкатионов один (с зарядом во втором положении) более стабильный поскольку алльный катион дополнительно стабилизирован метильным радикалом. Соответственно протекание реакции через стадию этого катиона будет более предпочтительным. Белее стабильный из двух карбкатионов приводит к образованию продукта 1,2-присоединения. Следствием большей стабильности карбкатиона является меньшая высота потенциального барьера на пути от реагентов к продуктам. Определение:Один из двух возможных продуктов, образование, которого связано с меньшей высотой потенциального барьера – называется кинетически контролируемым. О таком ходе реакции говорят как о кинетически контролируемой реакции.
Повышенная стабильность карбкатиона приводит к тому, что катион образуется при обратной реакции. За счет резонанса более устойчивый катион может изомеризоваться в менее устойчивый, который также образует продукт. Но в силу меньшей стабильности катиона обратная реакция протекает очень медленно и постепенно идет накопление второго продукта. Такой продукт называется термодинамически контролируемым, а реакцию называют термодинамически контролируемой реакции.
Различие кинетически и термодинамически контролируемых реакций в том, что кинетически контролируемый продукт образуется быстро и при низких температурах. Термодинамически контролируемый продукт накапливается медленно, а реакции идут при повышенных температурах.
Так присоединение бромистого водорода к 1,3-бутадиену при –80 0 С приводит к смеси продуктов, в которой 81% 3-бром-1-бутена и 19% 1-бром-2-бутена. При 20 0 С образуется смесь, в которой 3-бром-1-бутена 44%, 1-бром-2-бутена 56%.
Галогенирование
При галогенировании 1,3-диенов также образуется смесь продуктов кинетического и термодинамического контроля. При присоединении брома к 1,3-бутадиену при -80 0 С основным продуктом является 3,4-дибром-1-бутен с примесью 1,4-дибром-2-бутена. При проведении реакции при 40 0 С основным продуктом является 1,4-дибром-2-бутен, а в качестве примеси присутствует 3,4-дибром-1-бутен.
Радикальное присоединение
Как и другие алкены, сопряженные диены способны присоединять свободные радикалы. Например, бром в условиях радикального процесса присоединяется к 1,3-бутадиену преимущественно по типу 1,4-присоединения независимо от температуры.
Источник