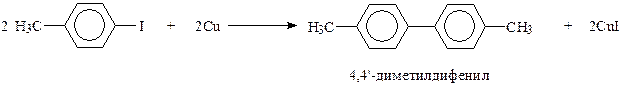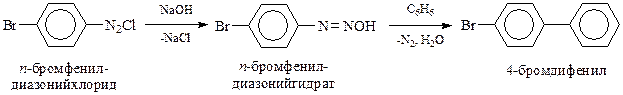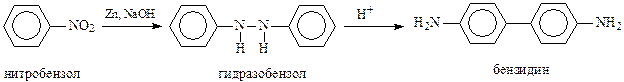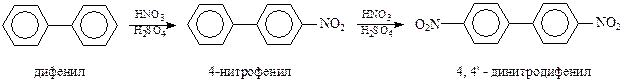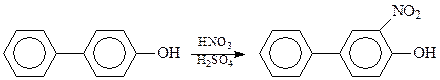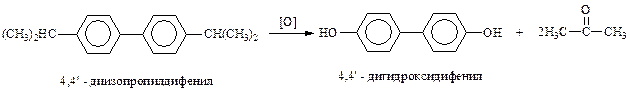Группа дифенила
Способы получения.Имеется несколько удобных методов получения соединений ряда дифенила.
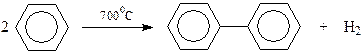
Для получения самого дифенила обычно используется термическое дегидрирование бензола, сопровождающееся конденсацией двух молекул этого углеводорода (Бертло, 1867 г.)
При получении дифенила можно исходить также из ароматических галогенпроизводных. Найдено, что для этого лучше всего подходят иодпроизводные. При их нагревании с медным порошком с высоким выходом образуются дифенилы, например,
Этот синтез с участием иодпроизводных аренов и меди носит название реакции Ульмана (1903 г.). Видно, что рассматриваемая реакция, как и реакция Фиттига – это реакция Вюрца в приложении к ароматическому ряду.
Реакция Гомберга-Бахмана, заключающаяся во взаимодействии солей диазония с бензолом в щелочной среде, позволяет получать несимметричные замещенные дифенилы
Для получения функциональных производных дифенила используются различные реакции. Так, n,п’-диаминодифенил (бензидин), широко используемый в производстве красителей, получают бензидиновой перегруппировкой (Зинин) гидразосоединений
Получаемая из бензидина диазотированием соль диазония легко вступает в реакцию азосочетания с подходящим партнером с образованием соединений, которые относят к азокрасителям. Так, известный краситель – конго-красный – получают азосочетанием дифенилдиазониевой соли с нафтионовой кислотой
Химические свойства. До обсуждения химических свойств дифениловых соединений отметим, что бензольные кольца в этом соединении находятся в одной плоскости (копланарны). Хотя их заместители, даже водородные атомы, стремятся нарушить копланарность. Электроны бензольных колец взаимодействуют друг с другом, сопрягаются. Это приводит к существенному уменьшению длины σ-связи между бензольными ядрами. В дифениле эта связь имеет длину 0,148 нм, в то время как в этане связь между углеродами составляет 0,154 нм.
Соединения ряда дифенила по своим химическим свойствам повторяют свойства бензола и его производных. Они проявляют ярко выраженный ароматический характер и легко вступают в реакции электрофильного замещения. При этом одно бензольное кольцо ведет себя по отношению к другому как электронодонорный заместитель, т.е. как о-, п-ориентант. Однако о-ориентирование не может проявиться в полной мере из-за пространственных затруднений. Поэтому реакции хлорирования, нитрования и сульфирования идут как п-замещение. В этих реакциях новый электронодонорный заместитель вступает во второе кольцо также в п-положение, например,
В случае дифенилов, уже содержащих в качестве заместителя заместитель первого рода, второй заместитель входит в то же ядро в положение 3
Поскольку дифенил – это фенилзамещенный бензол и фенил в данном случае выступает как электронодонорный заместитель, то дифенил в реакциях электрофильного замещения более реакционоспособен, чем бензол. По этой причине реакция ацетилирования дифенила может быть осуществлена в среде бензола как растворителя.
Дифенил обладает высокой устойчивостью к нагреванию и окислению. Как уже было упомянуто, даже при 700 – 800 о С как раз образуется, а не разрушается.
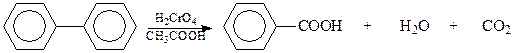
Хромовая кислота в среде уксусной кислоты с трудом окисляет дифенил в бензойную кислоту
В то же время, алкильные заместители в дифениле окисляются гораздо легче. Это позволяет, кроме получения соответствующих кислот дифенилового ряда, синтезировать и фенолы в результате процесса, напоминающего получение фенола и ацетона окислением изопропилбензола
Благодаря высокой термической и химической устойчивости дифенила он широко используется в качестве высокотемпературного теплоносителя.
В технике находят применение и хлорированные дифенилы. Однако следует отметить, что некоторые из них чрезвычайно токсичны.
Самым высокотоксичным ксенобиотиком признан 2,3,7,8-тетрахлор-р-дибензодиоксин. Если его токсичность принять за единицу, то токсичности некоторых полихлорированных дифенилов имеют следующие значения
Источник
Дифенил
| Дифенил | |
 | |
| Общие | |
|---|---|
| Химическая формула | C12H10 |
| Физические свойства | |
| Молярная масса | 154.21 г/моль |
| Плотность | 0.992 г/см³ |
| Термические свойства | |
| Температура плавления | 68.93 °C |
| Температура кипения | 256 °C |
| Классификация | |
| Рег. номер CAS | 92-52-4 |
| SMILES | c1ccccc1(c2ccccc2) |
| Регистрационный номер EC | E230 |
Дифенил (или бифенил) — органическое соединение, углеводород, сдвоенный фенильный радикал.
Содержание
Внешний вид и физические свойства
Бесцветные или белые кристаллы, со специфическим запахом. Не растворим в воде, растворим в большинстве органических растворителей.
Температура плавления 68.93°С, температура кипения 254—255°С.
Химические свойства
Слабо реакционноспособен по общим реакциям ароматических углеводородов (нитрование, сульфирование и т. д.).
Стереохимия
Некоторые из орто-замещенных аналогов молекулы проявляют оптическую активность.
Нахождение в природе и биологическая роль
Дифенил встречается в каменноугольной смоле и нефти. Ингибирует рост грибов, поэтому применяется для предохранения цитрусовых и яблок во время транспортировки (запрещён в ЕС и США из-за канцерогенности). Препарат среднетоксичен, но биологически разлагается до малотоксичных соединений [1] .
Применение
Применяется как прекурсор в синтезе полихлорированных дифенилов, а также других соединений, используемых как эмульгаторы, инсектициды и красители.
Примечания
 Углеводороды Углеводороды | |
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан . |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен . |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Дифенил» в других словарях:
дифенил — сущ., кол во синонимов: 1 • даутерм (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Дифенил — C6H5 C6H5, бесцветные кристаллы; tпл 171°С, tkип 254 255°С. Д. нерастворим в воде, хорошо растворим в органических растворителях; содержится в антраценовом масле, выделяемом из каменноугольной смолы. В промышленности его получают… … Большая советская энциклопедия
Дифенил — см. Углеводороды аромат … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ДИФЕНИЛ — (C6H5)2 бесцветные кристаллы; tnл 71 °С. Фунгицид. Смесь Д. с дифенилоксидом (C6H5)2O высокотемпературный теплоноситель … Большой энциклопедический политехнический словарь
дифенил — органическое соединение, углеводород ароматического ряда; твердый бесцветный кристаллический продукт; содержится в каменноугольной смоле; примен. в производстве красителей и синтетических смол. Новый словарь иностранных слов. by EdwART, , 2009 … Словарь иностранных слов русского языка
дифенил — дифен ил, а … Русский орфографический словарь
дифенил — бифенил … Cловарь химических синонимов I
дифенил-уксусный — дифени/л у/ксусный … Слитно. Раздельно. Через дефис.
N,N-ДИФЕНИЛ-N-ПИКРИЛГИДРАЗИЛЬНЫЙ РАДИКАЛ — (дифенилпикрилгидразил, ДФПГ), мол. м. 394,32; фиолетовые кристаллы с металлич. блеском; для одной из полиморфных модификаций т. пл. 137 138°С; m 16,4.10 30 Кл. м; легко раств. в орг. р рителях. Длина трехэлектронной связи NЧN 0,133 нм,… … Химическая энциклопедия
Полихлорированный дифенил — Полихлорированные дифенилы (ПХД) или полихлорированные бифенилы (ПХБ) группа органических соединений, включающая все хлорозамещённые производные дифенила (1 10 атома хлора, приложенные к бифенилу, который является молекулой, составленной из двух… … Википедия
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |