Дендритные клетки способ поглощения
Лимфоидные дендритные клетки или плазмацитоидные дендритные клетки являются основными IFN-a-продуцирующими клетками Лимфоидные ДК образуются в тимусе из унипотентного предшественника Т-лимфоцитов, а именно из CD11cIL-3Ra-клеток. Основной ростовой фактор для лимфоидных ДК — IL-3 (он также является антиапоптотическим фактором); ранние стадии их гематопоэза стимулируют также FltЗ-лиганд, G-CSF и CSF. Плазмацитоидные ДК на всех этапах дифференцировки экспрессируют высокие уровни a-цепи рецептора к IL-3 (CD123). Описаны два специфических поверхностных маркера плазмацитоидных ДК человека: CD303 (BDCA-2) и CD304 (BDCA-4).
Лимфоидные дендритные клетки присутствуют в крови, лимфатических узлах, селезенке и тимусе. Судьба лимфоидных ДК, поступающих в Т-клеточные области лимфоузлов из крови, неизвестна. В тимусе лимфоидные ДК принимают участие в процессе отрицательной селекции, то есть отвечают за элиминацию Т-клеток, реагирующих на собственные антигены.
Незрелые дендритные клетки и их предшественники избирательно реагируют на патогены. В отличие от миелоидных пре-ДК плазмацитоидные пре-ДК заселяют преимущественно Т-клеточные зоны вторичных лимфоидных органов, а в нелимфоидных практически отсутствуют Незрелые ДК и их предшественники (пpe-DCs) вовлекаются во врожденное распознавание микробов, в то время как пре-DCsl (предшественники миелоидных ДК) фагоцитируют и вызывают киллинг различных бактерий и грибков. Пpe-DCs2 (предшественники лимфоидных ДК) играют главную роль в раннем антивирусном иммунном ответе, продуцируя IFN-a и В. Эти клетки были названы натуральными интерферонпродуцирую-щими клетками (NIPCs).
NIPCs продуцируют в 200-1000 раз больше IFN, чем другие клетки крови после микробной инфекции или после стимуляции ЛПС и бактериальными ДНК. Пре-DCs составляют менее 1% мононуклеаров крови и имеют фенотип lin CD11сCD123CD303CD304*HLA-DR.
В отличие от других клеток врожденного иммунитета (нейтрофилы, эозинофилы и базофилы), которые погибают после выполнения их функций, пре-DCsl и пpe-DCs2 дифференцируются в ДК.
Плазмацитоидные дендритные клетки участвуют в В-клеточном ответе на вирусы: после их элиминации из культур МЛПК уровень продукции антител резко падает. За счет секреции интерферонов I типа лимфоидные ДК стимулируют пролиферацию плазмобластов, а проведение сигналов с TLRs ДК способствует выработке ими IL-6 и индукции синтеза специфических антител В-клетками.
При аллергических реакциях и некоторых видах хронического воспаления пpe-DCs привлекаются как в пораженные нелимфоидные ткани, так и в реактивно измененные регионарные лимфатические узлы; они инфильтрируют также опухолевую ткань при некоторых злокачественных новообразованиях.
В тканях незрелые дендритные клетки могут поглощать антигены различными способами:
— макропиноцитозом (растворимые АГ);
— рецептор-опосредованным эндоцитозом через лектиновые рецепторы, FcR и рецептор комплемента (CR3) (поглощают иммунные комплексы, опсонизированные частицы и бактерии);
— путем фагоцитоза через CD36 и ар-интегрины (латекс, вирусы, бактерии, внутриклеточные паразиты);
— через TLRs идет распознавание патогенов и сбор информации о природе микроорганизмов);
— через поверхностные рецепторы (CD91) поглощают белки теплового шока gp96 и др70.
Созревание дендритных клеток инициируется различными факторами:
— после воздействия PAMPs на TLRs;
— TNF-подобными сигналами (TNF, FasL, CD40L), поступающими от лимфоцитов (Т, В, NK, NKT), тромбоцитов, тучных клеток;
— провоспалительными и противовоспалительными цитокинами (IL-1, -2, -6, -13, TNF-a), GM-CSF;
— механическим стрессом.
Морфология, иммунофенотип и функциональная активность ДК зависят от активации и дифференцировки. Основным морфологическим признаком ДК является наличие многочисленных подвижных отростков разнообразной формы — нитевидной, вуалевидной, луковичных псевдоподий. Благодаря отросткам, ДК обладают большой совокупной поверхностью, обеспечивающей уникальные условия для эффективного межклеточного взаимодействия. Для ДК характерно наличие крупных митохондрий, большого количество эндосом и лизосом, имеющих важное значение для процессинга антигена.
Дендритные клетки весьма лабильны в отношении путей активации и дифференцировки под воздействием многочисленных факторов на разных стадиях созревания, в связи с чем у авторов статей, изучающих морфо-функциональную характеристику ДК, нет единства мнений относительно иммунофенотипических особенностей этой клеточной популяции. Однако в настоящее время выявлены некие общие закономерности в экспрессии поверхностных клеточных маркеров, характерных для зрелых и незрелых ДК.
На поверхности мембран ДК экспрессируются маркеры антигенного представления (CDIa, МНС I и II), костимулирующие молекулы (CD80, CD86, CD40) (перечисленные маркеры экспрессируются преимущественно на зрелых ДК); маркеры моноцитов/макрофагов (CD14, CD68, CD115), адгезивные молекулы (CD54, CD58, семейство молекул CD11, CD29 и т.д.), хемокиновые рецепторы (CCR-1, -2, -5, -6, -7, СХ-CR-4) и другие молекулы.
Незрелые дендритные клетки экспрессируют хемокиновые рецепторы CCR-1, -2, -5, -6 и CXCR-1 и способны активно мигрировать в очаг воспаления в ответ на воспалительные хемокины семейства МСР и MIP-1, а также RANTES и IL-8.
В процессе созревания ДК теряют способность захватывать антиген, но они приобретают свойство экспрессировать процессированный пептидный антиген в контексте собственных молекул МНС I и МНС II. Зрелые ДК продуцируют провоспалительные и регуляторные цитокины IL-6, IL-10, IL-12, IL-18, IL-23, IL-27 и TNF-a, лимфоидные ДК экспрессируют TLR7-9 и продуцируют IFN-a. Напротив, миелоидные ДК и моноциты отличаются экспрессией TLR1-6, TLR8. Индукция IFN-B осуществляется через лигацию TLR3 и 4 с двуспиральными РНК и ЛПС. Эти различия в экспрессии TLRs и пути INF-индукции свидетельствуют, что субпопуляции ДК распознают дифференцированно микробные патогены.
Источник
Дендритные клетки
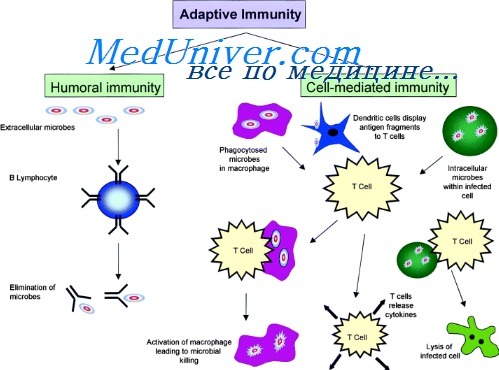
Дендритные клетки (ДК), названные так из-за их «древовидной», имеющей отростки (дендриты), формы, являются антигенпрепрезентирующими клетками (АПК) иммунной системы, то есть обрабатывают антигенный материал и представляют его на своей поверхности для Т-клеток иммунной системы. Они служат связующим звеном между врожденной и приобретенной иммунными системами.
Пауль Лангерганс впервые описал ДК, найденные в человеческой коже в 1868 году, но ошибочно принял их за нервные клетки. Ральф Штейнман и Занвил Кон открыли ДК в 1973 году, но идея о том, что ДК имеют уникальную роль в иммунной системе, десятки лет воспринималась скептически. В XXI веке стало понятно, как именно ДК инициируют приобретенные иммунные ответы. Сейчас все более очевидным становится их вклад в индукцию толерантности к аутоантигенам. Изучаются связи и сигнальные пути ДК с другими иммунными клетками, их роль в развитии различных патологий, разрабатываются лекарства и вакцины против некоторых патогенов, опухолей и аутоиммунных заболеваний. В знак признания важности открытия дендритных клеток Ральф Штайнман был удостоен нескольких престижных премий, в том числе международной премии Фонда Гарднера в 2003 году, премии Альберта Ласкера в 2007 году и Нобелевской премии по физиологии и медицине в 2011 году.
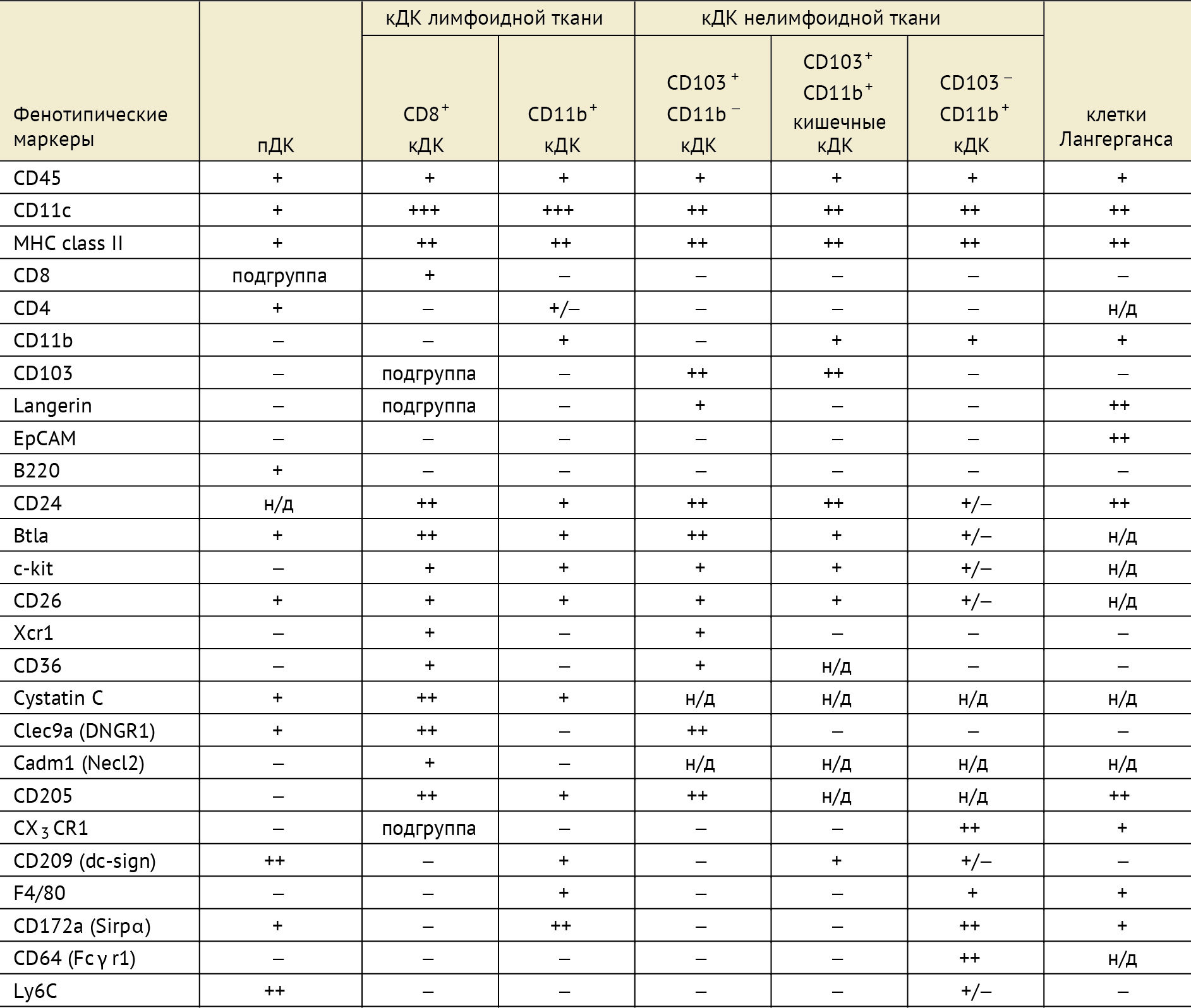
ДК — это образующиеся в костном мозге лейкоциты, которые являются наиболее эффективным типом антигенпредставляющих клеток. ДК также могут быть получены in vitro из костного мозга и крови с использованием различных комбинаций факторов роста, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и Flt3-лиганд. ДК специализированы для захвата и обработки антигенов, превращения белков в пептиды и их представления на основных комплексах гистосовместимости (MHC-II), распознаваемых Т-клетками. Они являются гетерогенной, т. е. разнородной по происхождению и составу, группой клеток, включающей в себя миелоидную (или классическую, открытую Штайнманом) и плазмоцитоидную субпопуляции. Отдельно в классической субпопуляции выделяют ДК лимфоидной и нелимфоидной ткани, а также те самые клетки Лангерганса кожи. Хотя все ДК способны поглощать, обрабатывать и представлять антигены наивным Т-клеткам, вышеперечисленные подвиды имеют свои четкие фенотипические маркеры и различаются по местоположению, миграционным путям, специфическим иммунологическим функциям, а также по наличию зависимости их образования от инфекций или воспалительных стимулов.
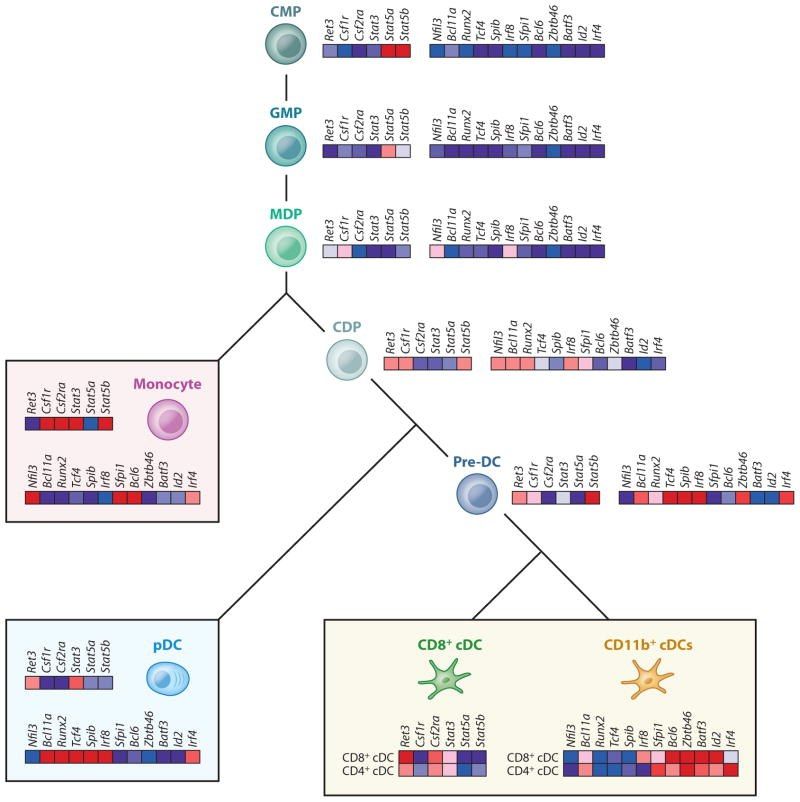
Рисунок 1 | Транскрипционный контроль дифференциации ДК. На иллюстрации изображена тепловая карта цитокинов, TLR и некоторых факторов транскрипции, которые экспрессируются в миелоидной линии, начиная от обычных миелоидных предшественников (CMP) до предшественников гранулоцитов макрофагов (GMP), предшественников макрофагов ДК (MDP), общих предшественников ДК (CDPs), циркулирующих кДК-предшественников (pre-cDCs), моноцитов, плазмоцитоидных ДК (pDCs) и клеток лимфоидной ткани CD8+ и CD11b+ ДК.
Плазмоцитоидные ДК (пДК) представляют собой небольшую субпопуляцию, происхождение которой сходно с классической, но их жизненный цикл протекает иначе. Они накапливаются преимущественно в крови и лимфоидных тканях и попадают в лимфатические узлы через кровоток, экспрессируют низкие уровни MHC-II, костимулирующих молекул и интегрина CD11c в неактивном состоянии, а также узкий диапазон паттерн-распознающих рецепторов (PRR), которые включают в себя Toll-подобные рецепторы (TLR) 7 и 9. При распознавании чужеродных нуклеиновых кислот пДК продуцируют интерфероны типа I и приобретают способность представлять чужеродные антигены.
Классические ДК (кДК) являются субпопуляцией тканевых гемопоэтических клеток, которые заполняют большинство лимфоидных и нелимфоидных тканей. Они более тонко ощущают тканевые повреждения, захватывая связанные с окружающей средой и чужеродными клетками антигены, обрабатывая и представляя их Т-лимфоцитам. Благодаря этому кДК индуцируют иммунитет к любым чужеродным антигенам, нарушающим целостность тканей, и обеспечивают толерантность к аутоантигенам. Они отлично подходят для выполнения этих функций из-за нескольких ключевых особенностей:
- они локализованы практически в любой нелимфоидной ткани и в маргинальной зоне селезенки, где они постоянно контактируют с антигенами;
- вырабатывают ферменты для обработки и представления антигенов;
- в ответ на взаимодействие с некоторыми хемокинами, такими как CCL19 и CCL21, они «проползают» через клетки тканей, пересекают эндотелий лимфатических сосудов и начинают перемещаться в лимфоузлы. Активированные ДК не захватывают новые антигены, синтезируют костимулирующие молекулы, такие как CD80, CD86 и C-C-рецептор хемокина 7 типа, а также провоспалительные цитокины TNF-α и IL-12;
- в лимфоузлах ДК мигрируют в Т-зону, где и вызывают ответ CD4 и CD8 T-лимфоцитов, при этом одна ДК вызывает ответ нескольких Т-клеток.
Дендритные клетки присутствуют в тканях, контактирующих с внешней средой — например, в коже (где имеется специализированный тип дендритных клеток — клетки Лангерганса), слизистых оболочках дыхательных путей, легких, желудка и кишечника. Также они могут быть обнаружены в незрелом состоянии в крови и соединительной ткани. Зрелые/активные формы ДК мигрируют в лимфоузлы.
Таблица 1 | Фенотипы мышиных кДК лимфоидной и нелимфоидной тканей.
Дефицит дендритных клеток у человека
У людей описано три генетических синдрома дефицита ДК. Первый — синдром дефицита DCML, вызван мутацией GATA-связывающего фактора 2 (GATA2), ведущей к полному отсутствию ДК, циркулирующих моноцитов, B- и NK-лимфоцитов, но не влияющей на гранулоциты и тромбоциты. Этот синдром также связан с отсутствием лимфоидных предшественников и уменьшением предшественников гранулоцит-макрофагов (GMP), что указывает на то, что дефицит GATA2 предотвращает дифференциацию этих предшественников в ДК. У пациентов с DCML значительно (примерно в 100 раз) был повышен уровень сывороточного FLT3L без признаков миелопролиферации.
Второй синдром связан с мутациями регуляторного фактора интерферона 8 (IRF8), который участвует в дифференциации общего миелоидного предшественника в ДК и моноциты. У одного пациента с ноль-мутацией IRF8 наблюдалось увеличенное количество гранулоцитов, полное отсутствие циркулирующих моноцитов, пДК, кДК и дермальных ДК, а также недостаточная продукция IL-12. Интересно, что эпидермальные клетки Лангерганса у этого пациента присутствовали в нормальном количестве, из чего можно сделать предположение, что эпидермальные клетки Лангерганса и кДК имеют различное происхождение. Другой вид мутации IRF8, наблюдаемой у двух пациентов, приводил к уменьшению количества CD1c+ кДК в крови и дефектам в продукции IL-12, но нарушения образования гранулоцитов, моноцитов или пДК не происходило.
Третий синдром связан с мутацией аденилаткиназы 2-фосфотрансферазы, необходимой для нуклеотидного гомеостаза. Эта мутация вызывает особую форму тяжелого комбинированного иммунодефицита, известную как ретикулярный дисгенез. Синдром характеризуется нарушением образования всех зародышевых клеток крови, включая нейтрофилы, лимфоциты, моноциты, кДК и клетки Лангерганса.
Иммунотерапия
Использование иммунорегуляторных возможностей дендритных клеток имеет большие перспективы в лечении онкозаболеваний, аутоиммунных заболеваний и профилактики отторжения трансплантата. Манипуляции с ДК могут превратить их в наиболее эффективный адъювант для усиления иммунной защиты хозяина. Было показано, что злокачественные новообразования подавляют ДК, выделяя противовоспалительные цитокины, такие как IL-10, чем обусловливают образование супрессивных Т-клеток. Для того, чтобы подорвать эти механизмы, можно создать нацеленные на опухолевые антигены ДК ex vivo и ввести их пациенту для повышения иммунитета к опухолевым клеткам. Дендритные клеточные вакцины, создаваемые таким образом, безопасны, имеют минимум побочных эффектов и в целом выглядят как выполнимый, перспективный и эффективный метод лечения.
Источники:
- Merad M. et al. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting //Annual review of immunology. – 2013. – Т. 31. – С. 563-604.
- Ali Roghanian. Dendritic Cells. Ali Roghanian, University of Southampton Faculty of Medicine, UK
- Luckashenak N., Eisenlohr L. C. Dendritic cells: Antigen processing and presentation //Cancer immunotherapy. – Academic Press, 2013. – С. 55-70.
Источник
Дендритные клетки способ поглощения
Дендритные клетки, полученные из клеток костного мозга мышей, были протестированы на способность к фагоцитозу. Фагоцитарную активность ДК на различных стадиях дифференцировки, активированных Иммуновак-ВП-4, АСО и классическим индуктором созревания TNF-a, оценивали по поглотительной способности в отношении штаммов S. aureus и S. typhimurium. В качестве контроля были использованы макрофаги, которые получали из тех же клеток костного мозга, путем культивирования их с GM-CSF в течение 7 суток.
Незрелые дендритные клетки более активно фагоцитировали бактерии в отличие от ДК, обработанных Иммуновак-ВП-4, АСО и TNF-a.
Фагоцитарная активность макрофагов и дендритных клеток была в динамике изучена в отношении S. aureus и S. typhimurium.
Наиболее активными были макрофаги, фагоцитарный индекс у них по отношению к S. aureus уже через 30 мин инкубации составлял 86,0±4,8 %, и он оставался на высоком уровне в течение трех часов наблюдения.
Фагоцитарная активность незрелых ДК и стимулированных иммуномодуляторами микробного происхождения значительно отличались.
При добавлении в среду культивирования TNF-a или Иммуновак-ВП-4 (группы 2 и 3) фагоцитарная активность была существенно ниже, причем при прибавлении Иммуновак-ВП-4 фагоцитарный индекс был несколько выше, чем в случае созревания ДК под влиянием TNF-a. Под воздействием АСО также отмечалось снижение фагоцитоза ДК, однако его уровень был выше по сравнению с Иммуновак-ВП-4, что может свидетельствовать о наличии в культуре незрелых ДК и макрофагов. При сопоставлении степени фагоцитоза S. aureus и S. ty-phimurium существенных различий не выявлено.
Вполне вероятно, что более высокая активность поглощения бактерий дендритными клетками, стимулированными Иммуновак-ВП-4 и АСО, обусловлена экспрессией Toll-подобных рецепторов на ДК и макрофагах, которые обладают сродством к патоген-ассоциированным структурам бактерий. После взаимодействия с бактериальными продуктами, ДК переходят в новое функциональное состояние, выражающееся в снижении фагоцитарной активности и способности к более мощной презентации антигена по сравнению с макрофагами.
Изучение иммунофенотипических характеристик дендритных клеток на разных стадиях их созревания проводили с использованием флюоресцеинизотиоцианат и РЕ-меченых моноклональных антител фирмы «Caltag», США.
Степень дифференцировки и зрелости дендритных клеток, полученных из клеток эмбриональной печени мышей, определяли по изменению уровня экспрессии дифференцировочных молекул CD34, CD38, CD40, CD80, CD86, CD83, F4/80, МНС I, МНС II через 3 суток после добавления к незрелым дендритным клеткам Иммуновак-ВП-4, бактериального лизата К. pneumoniae или TNF-a.
Полученные данные свидетельствуют о том, что TNF-a и Иммуновак-ВП-4 в исследуемых концентрациях стимулировали созревание ДК. Однако, судя по экспрессии дифференцировочных маркеров, TNF-a активировал созревание ДК в большей степени, чем Иммуновак-ВП-4 и лизат К. pneumoniae. Концентрация 25 мкг/мл Иммуновак-ВП-4 оказалась оптимальной для индукции созревания ДК; в этих условиях уровень экспрессии костимулирующих молекул был более высоким. Однако экспрессия Р4/80-молекул на ДК, стимулированных Иммуновак-ВП-4 и лизатом К. pneumoniae, оставалась повышенной (23,8±2,6 % и 21,2±3,4 %, соответственно) по сравнению с ДК, обработанными TNF-a (0,6±0,2 %).
Был исследован также иммунофенотип дендритных клеток, полученных из клеток костного мозга мышей. В качестве индукторов созревания использовали иммуномодуляторы бактериального происхождения — Иммуновак-ВП-4, ГМДП, АСО, а в качестве контроля — лизат и ЛПС К. pneumoniae и TNF-a.
Активация клеток с помощью Иммуновак-ВП-4 и ГМДП приводила к созреванию клеток. Усиливалась экспрессия костимулирующих молекул, адгезивной молекулы CD38. При этом используемые концентрации Иммуновак-ВП-4 по-разному влияли на уровень МНС. При дозе 25 мкг/мл экспрессия МНС I была в 2,7 раза больше, чем при концентрации 50 мкг/мл. Экспрессия МНС II была высокой при обеих дозах и не имела существенных отличий. ГМДП увеличивал содержание ДК, экспрессирующих МНС II класса.
Использование лизата и ЛПС К. pneumoniae повышало уровень экспрессии костимулирующих молекул, молекул антигенного представления МНС I и II.
При использовании АСО в качестве индуктора созревания ДК экспрессия маркера CD34 претерпевала существенные изменения в зависимости от дозы. Его динамика отмечена только при максимальных дозах. При применении АСО в дозе 0,3 ЕС/мл увеличивалось содержание CD80, CD86, МНС I экспрессирующих клеток. Однако уровень CD86 был ниже, чем при использовании других индукторов созревания. Экспрессия маркера F4/80 на ДК, стимулированных Иммуновак-ВП-4, может быть связана с присутствием в вакцине бактериальных ЛПС. Эти результаты подтверждаются полученными ранее данными о способности ДК, обработанных ЛПС, экспрессировать не только антигены зрелых ДК, но и рецепторы к ЛПС.
В следующих экспериментах изучали экспрессию этих маркеров при комбинации имммуномодуляторов микробного происхождения (ИММП) с TNF-a. Культивирование ДК в присутствии GM-CSF и IL-4 с добавлением на шестые сутки 2,5 нг/мл TNF-a и ИММП стимулировало созревание ДК в большей степени, чем эта доза TNF-a, и снижало в культуре содержание макрофагов. Сам по себе TNF-a в концентрации 2,5 нг/мл (группа 3) не вызывал созревания ДК по сравнению с контролем (группа 2), маркер незрелости CD34 был выше в 5 раз, F4/80 — в 11,4 раза, что свидетельствует о наличии в культуре существенного процента макрофагов. Однако при коинкубации 2,5 нг/мл TNF-a с иммуномодуляторами происходило увеличение экспрессии адгезивной молекулы CD38, костимулирующих молекул CD40, CD80, CD86, а также МНС I и II класса.
Особенно это касается АСО, поскольку коинкубация его с TNF-a стимулировала экспрессию поверхностных маркеров, присущих ДК. При этом снижался маркер CD34 по сравнению с незрелыми ДК (группа 1) в 3,4 раза, увеличивалась экспрессия адгезивной молекулы CD38 в 3,2 раза, костимулирующих молекул CD40 в 38 раз, CD80 и CD86 почти в 9 раз, МНС I в 2,7 и МНС II в 1,5 раза, уровень макрофагального маркера снижался в 3,6 раза. При внесении в среду культивирования TNF-a и Иммуновак-ВП-4 также выявлена стимуляция эффекта, выразившегося в том, что существенно увеличилась экспрессия МНС I и II и снизилось содержание F4/80 по сравнению с действием Иммуновак-ВП-4 в той же дозе (табл. 7). Близкие результаты получили при комбинации TNF-a (2,5 нг/мл) и ГМДП, но экспрессия CD40, CD80, CD86 и МНС II была больше в случае комбинации TNF-a и Иммуновак-ВП-4.
Полученные данные свидетельствуют, что внесение в среду культивирования небольшого количества TNF-a повышает потенциал созревания ДК под воздействием иммуномодуляторов микробного происхождения.
Источник