Гаструляция. Типы. Способы образования мезодермы.
Процесс разделения зародыша на зародышевые листки называется гаструляцией, а сам зародыш на этой стадии — гаструлой.
Способы гаструляции разнообразны и отчасти связаны со строением бластулы.
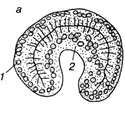
Иммиграционный тип гаструляции встречается у кишечнополостных. Этот процесс сводится к вселению в полость бластоцеля отдельных клеток, выклинивающихся из стенки бластулы. Когда процесс происходит по всей поверхности бластулы, говорят о мультиполярной иммиграции. Чаще выселение происходит с одного определенного полюса — униполярная иммиграция. Известна также биполярная иммиграция, когда выселение идет с двух противоположных полюсов.
У кишечнополостных, где дробление заканчивается морулой без полости, наблюдается другой тип гаструляции, который получил название деламинация (расслоение). В данном случае происходит выравнивание внутренних стенок клеток наружного слоя. Далее вдоль выровненных поверхностей формируется базальная мембрана, отделяющая внешний слой эктодермы от внетренней массы клеток энтодермы. Таким образом, при деламинации клеточные перемещения практически отсутствуют.
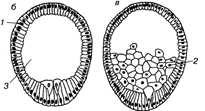
В целом процесс гаструляции приобретает в ходе эволюции более организованных характер и осуществляется обычно путем инвагинации. В этих случаях внутрь бластоцеля входят не отдельные клетки, а клеточный пласт, не утративший эпителиальной структуры. Полость вворачивания называется гастроцелем, а ведущее в нее отверстие — бластопором (первичным ртом). Края бластопора называются его губами.
Так как при инвагинации механическая целостность стенки бластулы не нарушается, вворачивание дна бластулы должно сопровождаться смещением клеточного материала боковых стенок. Такие движения всегда происходят, и скорость их, как правило, не меньше скорости вворачивания. Движения слоя, который в данный момент еще находится на поверхности гаструлы, называют эпиболией (обрастанием).
В соответствии с тем типом движения, в результате которого образовалась гаструла, выделяют несколько типов гаструл:
1. инвагинационная
2. иммиграционнная
3. деляминационная
4. эпиболическая
Материал, оставшийся на поверхности зародыша после завершения гаструляции — эктодерма. Погрузившийся внутрь листок лишь у кишечнополостных представляет собой чистую энтодерму. У всех вышестоящих систематических групп погрузившийся внутоб материал содержит кроме энтодермы еще и материал мезодермы.
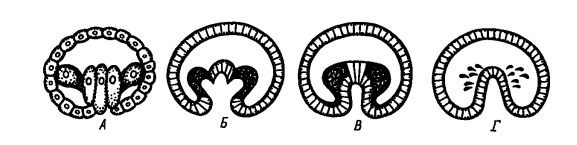
Выделяют следующие типы закладки мезодермы:
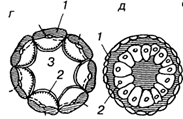
Телобластический (А), встречается у спирально дробящихся форм. В процессе дробления обособляются две крупные клетки, расположенные в полости бластоцеля в области губ бластопора. Они дают начало всей целомической мезодерме личинки. эти бластомеры называются мезобластами или мезотелобластами. Более мелкие мезодермальные клетки отпочковываются от этих крупных бластомеров. В результате возникает пара мезодермальных полосок, которые затем подразделяются на парные сомиты. Внутри сомитов путем расхождения клеток образуются участки вторичной полости тела — целома. Способ образования полостей путем расхождения клеток называется шизоцелевым, или кавитационным. В данном случае мезодерма никак не связана с энтодермой, образующейся из других бластомеров.
Принципиально другой — энтероцельный (Б) — способ закладки мезодермы наблюдается у иглокожих и ланцетника. В данном случае материал будущей мезодермы вворачивается вместе с энтодермой в составе гастрального впячивания, которое называется первичным кишечником или архентероном. Мезодерма выделяется из архентерона путем выпячивания его стенок и отшнуровки возникших выпячиваний.
Если мезодерма выделяется из архентерона путем деламинации, то выделяют деламинационный (В) тип закладки мезодермы.
иммиграционный (Г) тип выделяют в том случае, когда мезодерма отделяется от архентерона путем иммиграции.
Дата добавления: 2019-02-12 ; просмотров: 1693 ; Мы поможем в написании вашей работы!
Источник
«А.А. Присный Белгород 2011 А.А. Присный БИОЛОГИЯ РАЗМНОЖЕНИЯ И РАЗВИТИЯ Учебное пособие Белгород 2011 . »
На внутренних сторонах обоих верхнечелюстных отростков образуют ся нёбные отростки, срастающиеся и разделяющие первичную ротовую по лость на собственно ротовую и носовую, в которую открываются первичные хоаны. Параллельно с этими процессами на внутренней поверхности средне го лобного отростка образуется носовая перегородка, разделяющая носовую полость на правую и левую. Края нёбных отростков срастаются между собой и с нижним краем носовой перегородки, вследствие чего нёбо приобретает окончательное строение. В дальнейшем происходит формирование носовых раковин из складок, возникающих на поверхности носовых полостей.
Зубы развиваются из клеточного материала эктодермы (или энтодермы у других животных), являющегося источником эмали, и из клеточной мезен химы ганглионарной пластинки, идущей на развитие «сосочка» зуба. Язык (lingua) возникает в виде небольшого выступа нижней поверхности глоточ ной кишки между челюстной и подъязычной дужками.
Развитие жаберной полости За первичной ротовой полостью находится глоточный, или жаберный, отдел кишечной трубки. Часть ее принимает участие в образовании оконча тельной ротовой полости, эпителий которой, таким образом, грубо говоря, составлен из участка эктодермального и из участка энтодермального проис хождения. В развитии глоточной области важную роль играют энтодермаль ные производные, в их теснейшей связи с производными других зародыше вых пластов. О ведущей роли энтодермы в некоторых из процессов формо образования можно говорить лишь условно.
У амфибий жаберный отдел кишки со свойственными ему структурами развивается из передней, расширенной, кишки. В конце нейруляции возни кают попарно, одна вслед за другой, начиная с участка, лежащего позади нижнечелюстной дуги, выпячивания боковых стенок глоточной области.
Это – жаберные мешки. Разрастаясь, они проникают через массу мезодер мальных клеток до презумптивного эпидермиса, на поверхности которого возникают борозды (желобки), соответствующие приблизившимся энтодер мальным мешкам. Происходит соединение наружных слоев клеток энтодер мальных выпячиваний и внутреннего клеточного пласта желобка. В резуль тате перфорации образовавшейся пластинки появляются жаберные щели.
Благодаря этим отверстиям полость глоточной кишки сообщается с внешней средой. Закладка жаберных щелей наблюдается у всех позвоночных. У вод ных дышащих жабрами животных формируются органы дыхания – жабры, на стенках жаберных щелей развиваются жаберные нити – внутренние жаб ры.
Однако даже у некоторых водных позвоночных (у костистых рыб и у амфибий) жаберные мешки первой пары остаются замкнутыми, и соответст вующие жаберные щели и жаберные структуры не развиваются.
У рептилий, птиц, млекопитающих и человека жабры никогда не функ ционируют как органы дыхания, но жаберные мешки и жаберные щели раз виваются. У зародыша человека с каждой стороны возникают четыре жабер ные щели, чаще же всего закладывается еще и слабо развивающаяся пятая щель.
Однако дальнейшего развития жаберного аппарата, образования жа берных нитей не происходит. Это характерно для всех высших позвоночных, причем у некоторых даже не возникают и жаберные отверстия. На это явле ние давно обратили внимание зоологи, и оно считается одной из ярких иллю страций рекапитуляции. Однако этот случай нельзя рассматривать просто как «воспоминание» эмбрионов высших животных о своем происхождении от низших, дышащих жабрами форм. Хотя почти вся система структур начи нающего развиваться жаберного аппарата редуцируется, развитие некоторых органов обусловлено этим кажущимся бесполезным формированием жабер ного аппарата. У зародышей человека и у всех высших позвоночных первая пара жаберных мешков участвует в возникновении наружных слуховых от верстий, полости среднего уха и евстахиевой трубы. Вторая пара глоточных щелей у зародыша человека принимает участие в образовании нёбных мин далин. За счет энтодермальных клеток, отделяющихся от стенок третьего, четвертого и пятого жаберных мешков, развиваются железы с внутренней секрецией: зобная (тимус), околощитовидные, (паратиреоидные) железы или эпителиальные тельца. С глоточной кишкой связано и развитие щитовидной железы, а именно зачаток ее возникает в виде кармана на вентральной стенке глотки, отделяется от нее и перемещается в вентральном направлении к тра хее (у наземных животных).
Развитие легких, печени и поджелудочной железы Органы дыхания – гортань (larynx), дыхательная трубка (bronchus) и легкие (pulmo) – возникают общим зачатком – карманоподобным выпячива нием на вентральной стороне пищеварительного канала, позади жаберной области. Конец выпячивания, расширяясь и дифференцируясь, разветвляется;
две ветви, вырастающие в сторону и назад, развиваются в бронхи и легкие.
Срединная (между этими ветвями) часть развивается в трахею. На верхнем конце выпячивание, преобразовавшись в трубку, остается связанным с киш кой;
при этом передний расширенный участок ее дифференцируется в гор тань. У низших позвоночных зачатками легких являются мешкообразные расширения на концах бронхов.
У птиц и млекопитающих в результате обильного ветвления бронхов, развития на их концах многочисленных легочных пузырей и благодаря спе цифической тканевой дифференциации создается орган дыхания очень слож ной дифференциации. Хотя у человека легкие начинают функционировать лишь после рождения, развитие легких с легочными пузырьками происходит на ранних стадиях развития. На восьмой неделе закладывается и хрящевой скелет дыхательной трубки.
Печень (hepar) у всех позвоночных возникает из энтодермального эпи телия брюшной стороны duodenum. Зачаток желчного пузыря возникает на заднем конце первичного зачатка печени. Параллельно развивается и подже лудочная железа (pancreas), один из двух зачатков которой возникает из брюшной стенки duodenum. Образующееся здесь выпячивание развивается в проток поджелудочной железы. Второй дорсальный зачаток поджелудочной железы у амниот образуется на спинной стороне duodenum, впереди зачатка печени.
Литература 1. Белоусов Л.В. Проблема эмбрионального формообразования. – М.: Изд-во МГУ, 1971. – 175 с.
2. Белоусов Л.В. Основы общей эмбриологии. – М.: Изд-во Московского государствен ного университета, 2005. – 368 с.
3. Газарян К.Г. Биология индивидуального развития животных /К.Г. Газарян, Л.В. Бело усов – М.: Высшая школа, 1983. – 287 с.
4. Голиченков В.А. Эмбриология /В.А. Голиченков, Е.А. Иванов, Е.Н. Никерясова. – М.:
«Академия», 2004. – 224 с.
5. Данилов Р.К. Общая и медицинская эмбриология /Р.К. Данилов, Т.Г. Боровая. – СПб.:
СпецЛит, 2003. – 231 с.
6. Дондуа А.К. Биология развития: В 2 т. Т.1: Начала сравнительной эмбриологии. – СПб.: Изд-во СПбГУ, 2005. – 295 с.
7. Иванова-Казас О.М. Эволюционная эмбриология животных. – СПб.: Наука, 1995. – 565 с.
8. Станек И. Эмбриология человека. – Братислава: Издательство Словацкой академии наук «Веда», 1977. – 442 с.
9. Токин Б.П. Общая эмбриология. – М.: Высшая школа, 1987. – 480 с.
РАЗВИТИЕ ПРОИЗВОДНЫХ МЕЗОДЕРМЫ Различают два принципиально отличных типа закладки мезодермы.
Первый – телобластический – в наиболее чистом виде встречается у спи рально дробящихся форм, относящихся к первичноротым животным. Две крупные клетки – производные бластомера, симметрично расположенные в полости бластоцеля в области губ бластопора, дают начало всей так называе мой целомической мезодерме личинки. Эти бластомеры называются мезо бластами или мезотелобластами. Более мелкие мезодермальные клетки от почковываются от этих крупных бластомеров путем серии последовательных делений. В результате возникает пара мезодермальных полосок. Позже они подразделяются на сомиты, внутри которых путем расхождения клеток обра зуются участки вторичной полости тела, или целома. Способ формирования полостей путем расхождения клеток называется шизоцельным или кавитаци онным. Таким образом, при телобластическом способе закладки целомиче ская мезодерма возникает из двух бластомеров со строго определенной ге неалогией (рис. 37, А). Мезодерма при этом никак не связана с энтодермой, образующейся из других бластомеров. Закладка мезодермы из отдельных, предназначенных к тому бластомеров наблюдается также у большинства круглых червей, некоторых ракообразных и у ряда мелких групп первично ротых животных. В разных случаях генеалогия порождающих мезодерму бластомеров неодинакова.
Рис. 37. Способы закладки мезодермы А – телобластический;
Затемненные участки – целомическая мезодерма.
Принципиально другой – энтероцельный – способ закладки мезодермы свойствен вторичноротым животным (иглокожие, низшие хордовые) и в за чаточной форме – некоторым червеобразным (плеченогие). Здесь материал будущей мезодермы вворачивается вместе с энтодермой в составе единого гастрального впячивания (рис. 37, Б), и в процессе инвагинации граница ме жду обеими закладками, как правило, неразличима. Только прослеживая путь развития закладок в ретроспективном порядке, т, е. идя от поздних стадий развития назад, к ранним, можно выяснить, что материал будущей мезодер мы локализован в верхней части гастрального впячивания.
Такое впячивание, стенка которого включает материал, как энтодермы, так и мезодермы (а у хордовых – еще и хорды), называется первичным ки шечником или архентероном. Соответственно гастроцель в этих случаях на зывается полостью первичной кишки или полостью архентерона. Мезодерма выделяется из архентерона путем выпячивания его стенок и отшнуровки воз никших выпячиваний, реже путем деламинации стенок архентерона (рис. 37, В) или иммиграции клеток из них (рис. 37, Г). После отделения мезодермы и хорды в составе стенки архентерона остается чисто энтодермальный матери ал и архентерон превращается в полость вторичной (дефинитивной) кишки.
В редких случаях (некоторые низшие хордовые – кишечнодышащие) цело мическая мезодерма отшнуровывается от эктодермы.
Так же, как полость сомитов первичноротых, полость отшнуровавших ся мезодермальных пузырьков (часть бывшей полости архентерона) называ ется целомом или вторичной полостью тела.
В мезодерме зародыша на стадии нейрулы можно различить пять об ластей. Первая из них дает начало хорде, провизорному органу, основные функции которого состоят в индукции нервной трубки и установлении оси тела. Вторая область – дорсальная мезодерма. Из этой мезодермы, локали зованной по обе стороны нервной трубки и хорды, будут образовываться многие ткани тела – кости, хрящ, дерма и поперечнополосатая мускулатура.
Третья область – промежуточная мезодерма (материал сегментных ножек).
Из нее формируются органы выделения и протоки половых желез. На боль шем расстоянии от материала хорды находится четвертая область – несег ментированная мезодерма боковых пластинок, из которой развиваются сердце, кровеносные сосуды, клетки крови, гладкая мускулатура, выстилка полости тела (целома) и все мезодермадьные компоненты конечностей, кро ме поперечнополосатой мускулатуры. Боковые пластинки принимают также участие в формировании внезародышевых оболочек. Пятая область мезо дрмы – мезенхима головы.
Одной из главных задач гаструляции является перемещение энтодермы глубоко внутрь зародыша и мезодермальных клеток между слоями эктодер мы и энтодермы. У куриного зародыша мезодермальные клетки, не участ вующие в формировании хорды, мигрируют латерально, образуя толстые по лосы, идущие продольно вдоль каждой стороны хорды и нервной трубки.
Эти полосы дорсальной мезодермы у птиц называют сегментарной пластин кой, у млекопитающих – несегментированной мезодермой. Когда первичная полоска претерпевает регрессию, а нервные валики в центральной части за родыша начинают сближаться, дорсальная мезодерма постепенно разделяет ся на треугольные блоки клеток, называемые сомитами. Первые сомиты по являются в переднем отделе зародыша, новые сомиты формируются позади них через равные интервалы времени. Поскольку при слегка различных тем пературах инкубации зародыши развиваются с разными скоростями, число имеющихся сомитов служит обычно наилучшим показателем того, насколько далеко продвинулось развитие. Конечное число сомитов является видоспе цифичным признаком.
Механизм образования сомитов не вполне выяснен, но известно, что клетки сегментной пластинки куриного зародыша организуются в виде розе ток, называемых сомитомерами. В сегментной пластинке куриного зародыша постоянно видны от 10 до 11 пар сомитомеров, которые затем становятся со митами. Превращение сомитомера в сомит можно наблюдать тогда, когда клетки самого переднего сомитомера становятся плотно упакованными. По мере того как сомит становится совокупностью сцепленных друг с другом клеток, его клетки приобретают характер эпителиальных, а клетки наружного слоя соседних сомитов соединяются между собой плотными контактами. Во круг сомита образуется базальная мембрана, состоящая из коллагена, фибр онектина, ламинина и гликозаминогликанов (ГАГ). Под воздействием ГАГ вентральные клетки сомита начинают делиться митотически, теряют призна ки, характерные для округлых эпителиальных клеток, и снова становятся ме зенхимными клетками. Часть сомита, в которой образуются эти клетки, на зывают склеротомом, мезенхимные клетки, в конечном счете, становятся хондроцитами. Хондроциты ответственны за секрецию специфических типов коллагенов и гликозамингликанов (таких, как хондроитин-сульфат), харак терных для хряща. Эти хондроциты участвуют в образовании осевого скеле та.
После того как прекращается миграция клеток склеротома из сомита, оставшиеся эпителиальные клетки (совокупность которых называется дер мамиотомом) формируют двухслойную плотную трубку (рис. 38). Наружный слой ее называется дерматомом;
он дает начало мезенхимной соединитель ной ткани кожи – дерме, или кориуму. Внутренний слой называется миото мом;
эти клетки образуют поперечнополосатые мышцы стенки тела и конеч ностей.
Рис. 38. Схематическое изображение поперечного среза через туловище зародыша человека в начале (А) и в конце (Б) четвертой недели развития.
А. Клетки склеротома начинают мигрировать, удаляясь от миотома и дерматома.
Б. К концу четвертой недели клетки склеротома конденсируются и образуют хрящевые позвонки, дерматом начинает формировать дерму, а клетки миотома распространяются вниз в вентральном направлении вдоль стенок тела зародыша.
Остеогенез: развитие кости Кости – наиболее четко выраженные производные соматической мезо дермы. Существуют два способа остеогенеза, и оба включают в себя транс формацию предсуществующей соединительной ткани в костную ткань. Пре вращение малодифференцированной соединительной ткани в костную назы вается интрамембранным окостенением, а замещение хряща костью – эндо хондральным окостенением. Образование плоских костей осуществляется посредством интрамембранного окостенения. Рыхло расположенные мезен химные клетки пролиферируют и образуют плотные скопления. Некоторые из этих клеток дают начало капиллярам, а другие изменяют свою форму и становятся остеобластами – клетками, способными секретировать костный матрикс, обладающий способностью связывать соли кальция, приносимые капиллярами в область окостенения. Таким образом, матрикс становится кальцифицированным (обызвествленным). В большинстве случаев остеобла сты отделяются от области обызвествления слоем остеоидного матрикса, ко торый они секретируют. Однако время от времени остеобласты захватывают ся костным матриксом, и тогда они становятся остеоцитами – костными клетками. По мере обызвествления костные спикулы распространяются ради ально от центра, где началось окостенение. Кроме того, целая область обыз вествленных спикул окружается плотно лежащими над ней мезенхимными клетками, формирующими периост, или надкостницу. Клетки на внутренней поверхности надкостницы также становятся остеобластами и секретируют костный матрикс параллельно с матриксом уже образовавшихся спикул. Та ким образом, формируется много слоев кости.
Эндохондральное окостенение заключается в замещении хрящевой ткани костной. В данном случае хрящ служит моделью для последующего формирования кости. Сначала образуется хрящевой зачаток будущих костей позвоночного столба, таза и конечностей, а позже хрящ замещается костной тканью. Этот процесс координирует хондрогенез (образование хряща) с ос теогенезом (ростом кости), в течение которого скелетные элементы одновре менно испытывают нагрузку, растут в ширину и отвечают на локальные стрессы. Механизм этой координации объясняется сдвигом в функции мито хондрии, вызываемым изменением количества кислорода и питательных ве ществ, доступных клеткам. У зародыша человека в возрасте семи недель «длинные кости» образованы только хрящом, окруженным оболочкой из плотной мезенхимы. Эта оболочка становится надкостницей. Затем капилля ры из надкостницы проникают в центр хрящевого зачатка, ранее лишенного кровеносных сосудов. Хрящ реагирует на это формированием зон интенсив ной клеточной пролиферации (разрастание ткани организма путем новообра зования и размножения клеток и неклеточных элементов ткани), гипертро фии клеток (увеличения их размеров) и клеточной гибели.
Если клетка находится в зоне пролиферации, то она лежит вблизи не сущего кислород кровеносного сосуда и хорошо снабжается гликогеном – источником энергии. Митохондрии этих делящихся клеток синтезируют АТФ, необходимый для митоза. Однако в зоне гипертрофии снабжение кле ток кислородом ухудшается. Согласно этой теории, дыхание клеток в зоне гипертрофии становится анаэробным, и митохондрии переключаются с обра зования АТФ на накопления кальция. В анаэробном участке зоны гипертро фии снабжение клеток гликогеном полностью прекращается, и митохондрии более не могут накапливать кальций (его накопление – активный энергоем кий процесс). В результате отмирающие хондроциты высвобождают каль ций, и за его счет формируется провизорный обызвествленный (кальцифици рованный) матрикс. Остеобласты выстраиваются в ряд вдоль обызвествлен ных полос матрикса и начинают откладывать на них кость. В конечном счете, эти полосы исчезают, и остается лишь кость, сформированная остеобластами.
Таким образом, кость оказывается там, где ранее находился хрящ.
Однако происхождение начальных запасов фосфата кальция во внекле точном матриксе может быть различным. Есть пузырьки матрикса, которые представляют собой специализированные участки плазматической мембраны хондроцита, которые отпочковываются от клетки и прилипают к внеклеточ ному матриксу. Попав на это место, они накапливают большие количества кальция и фосфата из окружающей лимфы.
Замещение хондроцитов остеобластами зависит от минерализации вне клеточного матрикса. У куриных зародышей источником кальция служит уг лекислый кальций скорлупы яйца. За время развития кровеносная система переносит около 120 мг кальция от скорлупы к скелету. Если у развивающе гося куриного зародыша на третьи сутки инкубации удалить скорлупу, по местить его в пластиковую оболочку и культивировать до конца эмбриогене за, то в условиях дефицита кальция большая часть хрящевого скелета не пре вращается в костную ткань.
Остеогенез в длинных костях начинается в диафизе и постепенно рас пространяется к концам хрящевого зачатка. У новорожденного младенца диафизы длинных костей обызвествлены, тогда как их концы (эпифизы) все еще образованы хрящом. Вскоре после рождения в хрящевых эпифизах (по мере того как в них проникают кровеносные сосуды) возникают вторичные центры окостенения. Между кальцинированной тканью в эпифизах и диафи зом продолжает сохраняться хрящевая пластинка. Эта эпифизарная пластин ка играет важную роль в росте ребенка после рождения, так как она отвечает пролиферацией на поступающий в нее гормон роста. Гормоны также ответ ственны и за прекращение роста: высокие концентрации эстрогена или тесто стерона вызывают слияние центров окостенения в эпифизах и диафизе. что приводит к утрате эпифизарной пластинки. Такое эпифизарное слияние про исходит в юношеском возрасте, причем у девушек на два года раньше, чем у юношей.
По мере увеличения костного матрикса на периферии кости в ее внут ренней части образуются полости, и формируется костный мозг. Эта дест рукция костной ткани осуществляется остеокластами – многоядерными клет ками, поступающими в кость по кровеносным сосудам. Остеокласты проис ходят из тех же клеток-предшественников, что и клетки крови: они раство ряют как неорганические, так и белковые компоненты костного матрикса.
Остеокласт направляет многочисленные отростки в матрикс и накачивает ионы водорода в окружающий его материал, тем самым, окисляя и растворяя его. Кровеносные сосуды поставляют в костный мозг также кроветворные клетки, которые остаются в нем на всю жизнь.
Мезодерма боковых пластинок Мезодермальная мантия не полностью превращается в сомиты. К мезо дерме сомитов прилегает область промежуточной мезодермы – материал сег ментных ножек, из которых развиваются почки и протоки половых желез.
Далее находится несегментированная мезодерма боковых пластинок. Эти пластинки расщепляются продольно на соматическую (или париетальную) мезодерму, которая подстилает покровный эпителий, и спланхническую (вис церальную) мезодерму, лежащую над энтодермой. Между этими двумя слоя ми образуется вторичная полость тела – целом, который простирается от бу дущего шейного отдела до заднего конца тела. На более поздних стадиях развития соматическая мезодерма образует складки, разделяющие целом на отдельные полости. У млекопитающих целом подразделен на плевральную, перикардиальную и перитонеальную полости. Механизм образования мезо дермы сомитов и выстилки тела мало изменялся в процессе эволюции позво ночных.
Из мезодермы боковых пластинок развивается система замкнутого кровообращения, которая состоит из сердца, сложной сети кровеносных со судов и форменных элементов крови.
У зародышей позвоночных сердце исходно развивается в переднем от деле, в области спланхнической мезодермы;
лишь позже оно перемещается в область груди. У амфибий две зачатковые области образования сердца вна чале находятся в самом переднем участке мезодермальной мантии. Во время нейруляции эти две области сходятся в вентральной части зародыша, форми руя сердечную трубку и общую перикардиальную полость. У амниот – птиц и млекопитающих – сердце также развивается путем слияния парных зачат ков, но слияние происходит значительно позже в развитии. У этих позвоноч ных зародыш представляет собой уплощенный диск и мезодерма боковых пластинок не окружает желток полностью. Зачатковые клетки сердца начи нают мигрировать из боковых участков мезодермы (на уровне гензеновского узелка), когда зародыш достигнет возраста всего 6-7 часов. К этому времени зародыш еще относительно просто устроен, он состоит только из трех заро дышевых листков. Клетки будущего сердца, двигаясь между эктодермой и энтодермой к середине зародыша, сохраняют тесный контакт с поверхностью энтодермы. Когда же они достигают передней области зародыша, где нахо дится кишка, их миграция прекращается. Два формирующих сердце зачатка независимо друг от друга претерпевают четко выраженную дифференциров ку. У птиц и млекопитающих каждый из них превращается в трубку с двой ными стенками: внутренней – эндокардом и наружной эпимиокардом. Эндо кард будет формировать внутреннюю выстилку сердца, а эпимиокард – мышцу сердца, которая в течение всей жизни организма будет служить насо сом, перекачивающим кровь.
Пока зародыш проходит период нейруляции, выпячивание складки спланхнической мезодермы приводит к обособлению передней кишки. В ре зультате две трубки сердца сближаются и, в конце концов, сливаются вместе, соединяя эпимиокард в одну трубку. Два эндокарда в течение короткого вре мени находятся в общей камере, но они также сольются. К этому времени исходно парные целомические камеры объединяются, образуя полость тела, в которой располагается сердце. Следующей ступенью формирования сердца является слияние эндокардиальных трубок в единую насосную камеру. Это слияние происходит у куриного зародыша примерно через 29 часов инкуба ции, а у человека – через три недели беременности. Не слившиеся задние участки эндокарда становятся отверстиями желточных вен в сердце. Эти ве ны будут нести питательные вещества из желточного мешка в венозный си нус. Затем кровь через похожий на створку клапан проходит в предсердный отдел сердца. Сокращения артериального ствола быстро прогоняют кровь в аорту.
Пульсация сердца начинается еще во время слияния парных зачатков.
Водителем ритма сердечных сокращений является венозный синус. Затем на чинается сокращение, а затем волна сокращений распространяется по труб чатому сердцу. Таким образом, сердце начинает перекачивать кровь еще до того, как завершится образование сложной системы клапанов. Клетки сер дечной мышцы обладают собственной внутренне присущей им способностью к сокращению: изолированные мышечные клетки 7-дневного зародыша кры сы или куриного зародыша, помещенные в чашку Петри, продолжают со кращаться. У зародыша эти сокращения начинают регулироваться электриче скими стимулами, поступающими из мозжечка через блуждающий нерв. Че рез 4 дня ЭКГ у куриного зародыша становится очень сходной с ЭКГ взрос лой особи.
Формирование кровеносных сосудов Потребности развивающегося зародыша отличаются от потребностей взрослого организма, и эти различия отражает его система кровообращения.
Во-первых, пища поступает в зародыш не через кишечник, а либо из желтка, либо из плаценты. Во-вторых, процесс дыхания осуществляется не в жабрах или легких, а во внезародышевых оболочках – хорионе или аллантоисе. Та ким образом, главные кровеносные сосуды формируются для обслуживания этих внезародышевых оболочек.
Конструкция кровеносных сосудов помимо необходимости удовлетво рять физиологические потребности зародыша диктуется также эволюцией вида. У млекопитающих кровеносные сосуды зародыша будут распростра няться по желточному мешку, даже если он не содержит желтка. Кроме того, сосуд, по которому кровь покидает сердце, образует над передней кишкой петли, входящие в спинную аорту. Эти шесть петель – артериальные дуги – образуют арки над глоткой. У примитивных рыб эти дуги сохраняются и обеспечивают кровообращение в жабрах, где кровь насыщается кислородом.
У взрослых птиц и млекопитающих, у которых этот процесс осуществляется в легких, такая система имеет мало смысла. И хотя у зародышей млекопи тающих и птиц формируются все шесть пар артериальных дуг, затем система их упрощается, редуцируясь до единственной дуги. Следовательно, наше эм бриональное развитие отражает эволюцию, хотя физиология зародыша не требует такой структуры.
Главными кровеносными сосудами зародыша являются сосуды, полу чающие питательные вещества и приносящие их к телу зародыша, а также сосуды, транспортирующие кислород к органам, в которых происходит газо обмен, и уносящие от них диоксид углерода. У позвоночных с большим ко личеством желтка в яйце желточные (пупочно-брыжеечные) вены формиру ются посредством агрегации спланхнических мезенхимных клеток в ангио генных скоплениях (кровяных островках), расположенных в стенке желточ ного мешка. Эти клетки впервые обнаруживаются на стадии, когда первичная полоска достигает максимальной длины. Вскоре тяжи мезенхимных клеток изгибаются, образуя двустенные трубки, подобные двойной трубке сердца.
Клетки внутренней стенки становятся плоскими эндотелиальными клетками, выстилающими сосуды, а клетки наружной – гладко-мышечными клетками.
Между слоями эндотелиальных и гладкомышечных клеток располагается ба зальная мембрана, содержащая коллаген, специфичный для кровеносных со судов. Было высказано предположение, что эта базальная мембрана иниции рует дифференцировку клеток разных типов в сосудах. Центральные клетки кровяных островков дифференцируются в зародышевые клетки крови. Кро вяные островки по мере их роста сливаются и образуют сеть капилляров, впадающих в две желточные вены, приносящие питательные вещества и клетки крови к формирующемуся сердцу.
Капиллярные сплетения в системе кровообращения – те области в каж дой ткани, где происходит газообмен и обмен питательными веществами,— могут возникать двумя различными путями. В некоторых органах сплетение капилляров возникает независимо от самой ткани. При этом образование ка пилляров не является результатом прогрессивного утоньшения разветвлений главных кровеносных сосудов, растущих от сердца. Вероятнее, что мезодер ма каждого из этих органов содержит клетки, называемые ангиобластами, которые преобразуются в капилляры. Эти органоспецифичные сплетения ка пилляров, в конце концов, соединяются с выростами главных сосудов. В дру гих органах (а именно в зачатке конечности, в почках и в мозге) существую щие кровеносные сосуды проникают между клетками, формирующими ор ган. Полагают, что органообразующие области секретируют ангиогенные факторы, побуждающие эндотелиальные клетки к митозу и к миграции в эти области. Из мозга трехдневного куриного зародыша был выделен фактор, способствующий миграции эндотелиальных клеток в мозг из кровеносных сосудов, расположенных на поверхности мозга.
Зародыши млекопитающих получают пищу и кислород из плаценты.
Таким образом, хотя зародыш млекопитающих имеет сосуды, аналогичные желточным венам, пища и кислород поступают в него преимущественно че рез пупочную вену, которая соединяет зародыш с плацентой. Эта вена пере носит кровь, содержащую кислород и питательные вещества, обратно в заро дыш и образуется из той вены, которая у птиц становится правой желточной веной. Пупочная артерия, несущая кровь с конечными продуктами обмена в плаценту, у куриного зародыша соответствует аллантоисной артерии. Она отходит от каудальной части аорты, проходит вдоль аллантоиса и впадает в плаценту.
У млекопитающих кровь, после попадания ее в сердце зародыша, пере качивается в дорсальном направлении по артериальным дугам, окружающим глотку. Четвертая левая дуга – единственная, достигающая аорты у млекопи тающих. Четвертая правая дуга образует у них корень подключичной арте рии. Третья пара артериальных дуг трансформируется в сонные артерии, снабжающие кровью головной мозг и голову. Из шестой пары дуг формиру ются легочные артерии, а первая, вторая и пятая пара дегенерируют. Таким образом, аорта и легочная артерия в течение значительного времени развития зародыша открываются в сердце одним общим отверстием. Затем в артери альном стволе образуется перегородка, и в результате он подразделяется на два разных сосуда. Только после того, как первый вдох новорожденного жи вотного докажет, что его легкие готовы насыщать кровь кислородом, сердце начнет перекачивать кровь в легочную артерию.
Ткани развивающегося плода так же нуждаются в кислороде и пита тельных веществах, как и ткани взрослого организма. Однако физиология плода чрезвычайно резко отличается от физиологии взрослого. Главное из этих отличий – отсутствие функционирующих легких и кишечника. Весь ки слород и все питательные вещества должны поступать к плоду через плацен ту. Это обстоятельство ставит перед нами два вопроса: первый – как плод получает кислород из материнской крови, и второй – каким образом меняется направление тока крови так, что она после перерезки пупочного канатика на чинает поступать в легкие.
В решении проблемы снабжения плода кислородом из материнской крови участвует плодный (фетальный) гемоглобин. В плаценте – среде с низ ким содержанием кислорода – он высвобождается из гемоглобина взрослого.
В той же среде гемоглобин плода будет не отдавать, а, напротив, связывать кислород. Это небольшое различие в сродстве к кислороду обусловливает возможность переноса кислорода от матери к плоду. Миоглобин мышц плода имеет еще более высокое сродство к кислороду, поэтому молекулы кислоро да будут переходить из гемоглобина плода в его миоглобин, накапливаться в мышцах и использоваться ими. Гемоглобин плода не вреден для новорож денного, и замещение эритроцитов, содержащих этот гемоглобин, эритроци тами, содержащими гемоглобин взрослого, у человека завершается примерно через полгода после рождения.
Однако, когда плод уже не получает кислорода от матери, как пере страивается его кровообращение, для того чтобы он смог получить кислород из своих легких? Во время развития плода отверстие (артериальный проток) направляет ток крови из легочной артерии в аорту (и, следовательно, в пла центу). Поскольку кровь из легочной вены не возвращается в плод, разви вающийся плод млекопитающих должен иметь какой-то иной способ полу чения крови, которую следует перекачать в левый желудочек. Это осуществ ляется с помощью овального отверстия в перегородке, разделяющей левое и правое предсердия. Кровь может поступить в правое предсердие, пройти че рез овальное отверстие в левое предсердие, а затем перейти в левый желудо чек. После первого вдоха новорожденного кислород в крови вызывает со кращение мышц, которые окружают артериальный проток;
в результате это отверстие закрывается. Как только возрастает давление крови в левой поло вине сердца, оно заставляет захлопнуться створку над овальным отверстием, и тем самым происходит разделение двух потоков крови: легочного и обще го. Так, когда начинается дыхание, осуществляется переключение потока крови с плаценты на легкие.
Литература 1. Белоусов Л.В. Проблема эмбрионального формообразования. – М.: Изд-во МГУ, 1971. – 175 с.
2. Белоусов Л.В. Основы общей эмбриологии. – М.: Изд-во Московского государствен ного университета, 2005. – 368 с.
3. Газарян К.Г. Биология индивидуального развития животных /К.Г. Газарян, Л.В. Бело усов – М.: Высшая школа, 1983. – 287 с.
4. Голиченков В.А. Эмбриология /В.А. Голиченков, Е.А. Иванов, Е.Н. Никерясова. – М.:
«Академия», 2004. – 224 с.
5. Данилов Р.К. Общая и медицинская эмбриология /Р.К. Данилов, Т.Г. Боровая. – СПб.:
СпецЛит, 2003. – 231 с.
6. Дондуа А.К. Биология развития: В 2 т. Т.1: Начала сравнительной эмбриологии. – СПб.: Изд-во СПбГУ, 2005. – 295 с.
7. Иванова-Казас О.М. Эволюционная эмбриология животных. – СПб.: Наука, 1995. – 565 с.
8. Станек И. Эмбриология человека. – Братислава: Издательство Словацкой академии наук «Веда», 1977. – 442 с.
9. Токин Б.П. Общая эмбриология. – М.: Высшая школа, 1987. – 480 с.
ЭМБРИОНАЛЬНАЯ ИНДУКЦИЯ Под эмбриональной индукцией понимают взаимодействие эмбрио нальных закладок, ведущее к формообразовательному эффекту. Этот эффект достигается через реакцию ткани-мишени, которая становится детерминиро ванной к определенному типу развития. Далее детерминированное состояние реализуется в процесс дифференцировки.
Первичной эмбриональной индукцией принято называть взаимодейст вие хордомезодермы и презумптивной нейроэктодермы в ходе гаструляции, обусловливающее процесс первичного органогенеза – формирование нерв ной трубки. В результате этого взаимодействия запускается цепь морфогене тических (формообразовательных) событий. В зависимости от типа образуе мых при этом структур различают следующие варианты первичной эмбрио нальной индукции:
— архенцефалическая – в результате нее образуются передний мозг, глаз, хру сталик;
— дейтеренцефалическая – средний мозг, задний мозг, слуховые пузырьки;
— мезодермально-энтодермальная – представлена тремя вариантами:
а) спино-каудальная – спинной мозг, хвостовая хорда, сомиты;
б) туловищно-мезодермальная – туловищная хорда, сомиты, почечные канальцы, мезотелий, кровяные островки;
в) энтодермальная – глотка, пищевод, кишечник.
Явление первичной эмбриональной индукции открыл в 20-е годы XX в.
выдающийся немецкий эмбриолог Г.Шпеман. Он считал, что весь процесс индивидуального развития складывается из цепи эмбриональных индукций, шаг за шагом определяющих формообразование, дифференцировку органов и их систем и становление внешнего облика развивающейся особи, ее региона лизацию.
Г.Шпеман, проводя опыты по трансплантации участка губы бластопора от одного зародыша тритона на брюшную часть другого зародыша, получил следующий результат: на брюшной стороне экспериментального зародыша формировалась вторая нервная пластинка, развивавшаяся позднее в нервную трубку. На каждой ее стороне образовывались слуховые пузырьки, ряды со митов и таким образом возникала вторая закладка осевых органов. Эти опы ты и заложили основы учения об эмбриональной индукции, до сих пор зани мающего центральное место в биологии индивидуального развития. В 50-60 е годы XX в. голландский эмбриолог П.Ньюкуп продемонстрировал, что пер вым индуцирующим событием в развитии зародыша является не воздействие хордомезодермы на презумптивную нервную пластинку, а стимуляция энто дермой преобразования смежных клеток в хордомезодермальную закладку.
По сути дела, это событие и является истинно первичной эмбриональной индукцией.
Каждая эмбриональная индукция характеризуется тремя факторами:
индуктор, компетентная ткань, взаимодействие индуктора и компетентной ткани.
Индуктор (более старое название – организатор) – тканевая закладка, воздействующая на компетентную ткань. Характеризуется рядом особенно стей: образованием индуцирующих агентов, созреванием способности к ин дукции, автономностью созревания.
Эффект эмбриональной индукции обусловлен индуцирующими аген тами. В исследованиях лабораторий Х.Тидемана, С.Тойвонена, Т.Ямады бы ло показано, что это низкомолекулярные белки, которые выделяются инду цирующей тканью и воспринимаются компетентной тканью, вызывая фор мообразовательный эффект. Предполагалось существование двух индуци рующих агентов – нейрализующего и мезодермализующего, от соотношения которых зависит региональная специфичность индуцирующего эффекта. Это так называемая двухградиентная гипотеза эмбриональной индукции. Со гласно этой гипотезе, в развивающемся яйце существует два типа эмбрио нальных индукторов – мезодермальный и нейральный. Первый индуцирует нейральные структуры, второй – мезодермальные производные. Региональ ная специфичность зависит от количественного соотношения концентраций этих индуцирующих агентов в соответствующей области зародыша. Ней ральный агент в чистом виде должен индуцировать только переднеголовные структуры, добавление мезодермального агента ведет к сдвигу индукции в сторону заднеголовных структур, мезодермальных производных в зависимо сти от количества мезодермального агента В действительности механизм влияния индуцирующих агентов более сложен. Они образуются еще в период оогенеза и распределяются по объему развивающегося яйца неравномерно, формируя градиенты распределения, важные для нормального процесса эмбрионального развития. Х.Тидеман об наружил, что индуктор находится в связанном с белком-ингибитором инак тивированном состоянии, так что акт индукции сопровождается высвобож дением индуктора из этой связи.
Таким образом, поступающие в компетентную ткань молекулы индук тора являются как бы триггерным сигналом к началу цепной реакции – уда лению ингибитора и высвобождению собственных белков-индукторов. От крытие ингибиторов позволило объяснить на молекулярном уровне явление открытой Дж. Гольтфретером так называемой самонейрализации, дифферен цировки без воздействия индуктора. Дифференцировка эктодермы гаструлы может быть вызвана различными веществами и без добавления индуцирую щих агентов – щелочи, мочевины, тиоцианата, кислоты. Общее в них то, что они более или менее токсичны для эктодермы. Дифференцировка эктодер мальных эксплантатов (кусочков ткани, вырезанных из зародыша и поме щенных в среду для культивирования) может быть вызвана изменением со става среды. Такого рода экстремальные воздействия, переводящие клетку в состояние, которое граничит с лизисом, способствуют разрыву связи индук тор-ингибитор, так что индуцирующие факторы, прикрепленные вместе с ин гибитором к мембранным структурам, могут высвобождаться из этих струк тур и «организовывать» дифференциальную экспрессию генов в самодиффе ренцирующихся клеточных системах.
Созревание способности к индукции заключается в регионализации – постепенном приобретении каждой частью индуцирующей ткани способно сти индуцировать определенный набор структур. Ткань индуктора не сразу приобретает способность к индукции всего того спектра структур, который образуется под ее влиянием в ходе эмбриогенеза. На самых ранних стадиях созревания она обладает способностью индуцировать лишь образование пиг ментных клеток, затем переднеголовных структур и, наконец, мезодермаль ных структур. Индуцирующая хордомезодерма постепенно расчленяется на зоны, дающие разный региональный эффект.
Созревание индуктора осуществляется автономно, независимо от ок ружающих тканей зародыша. В ходе созревания изменяются индуцирующие свойства ткани в строго определенном направлении и закономерно.
Компетентная ткань (реагирующая система) – это та тканевая закладка, которая подвергается действию индуктора и отвечает на него формообразо вательным процессом. Как и индуцирующая ткань, ее характеризуют три свойства: компетенция, автономность созревания, эффект минимальной мас сы.
Компетенция – это физиологическое состояние реагирующей системы, в котором она способна воспринимать воздействие индуктора. Дело в том, что клетки реагирующей системы должны пройти определенные фазы разви тия, прежде чем они приобретут способность к восприятию сигналов индук тора к детерминации и дифференцировке.
До сих пор неизвестны молекулярно-генетические основы компетен ции, но предполагают, что она может быть связана с образованием рецепто ров, способных «опознавать» молекулы индуктора и обеспечивать их транс портировку внутрь клетки.
Таким образом, реагирующая система, подобно индуктору, должна со зреть для осуществления индукции. Это созревание реализуется в данном случае на уровне изменения компетенции. Созревание компетентной ткани, как и созревание индуктора, автономно, строго направлено, закономерно и не зависит от тканевого окружения.
В созревании компетентной ткани важную роль играет не только кле точный, но и тканевый уровень. Презумптивная нейроэктодерма гетерогенна и состоит из двух клеточных популяций. С помощью электронного микро скопа в нейроэктодерме у тритона были обнаружены электронноплотные и прозрачные клетки. Если на эксплантаты презумптивной эктодермы подейст вовать мезодермализующим индуктором, то электронноплотные клетки де генерируют, а прозрачные дают начало различным производным мезодермы.
С помощью электрофореза диссоциированные клетки презумптивной экто дермы удается разделить на две группы (по их компетентности): 1) реаги рующие на нейрализующий индуктор и гибнущие при обработке мезодерма лизующим агентом и 2) с противоположным типом реакции на эти агенты. В дальнейшем оказалось, что изменения в компетенции диссоциированных клеток презумптивной эктодермы коррелируют с изменениями в их чувстви тельности к разрушающему действию индуктора. Следует обратить внима ние на то, что морфогенетические процессы вообще обычно сопровождаются гибелью значительных масс клеток, и это обеспечивает последовательную смену популяций клеток в ходе онтогенеза. Начиная с самых ранних этапов развития она наблюдается в различных тканях – нервной, мышечной и др.
Чтобы компетентная ткань реагировала на действие индуктора, кроме всего прочего, необходимо наличие в ней определенного, минимального ко личества клеток, т.е. требуется некоторый «порог массы». Впервые это обна ружил К.Гробстайн у цыпленка, но более демонстративны опыты на амфиби ях Г.В.Лопашова. Он сращивал 2-10 фрагментов, выделенных из области презумптивной головной мезодермы ранней гаструлы. Эксплантаты из одно го фрагмента развивались в поперечнополосатые мышцы без хорды или ка ких-нибудь других тканевых компонентов. Однако при совместном культи вировании 2-4 таких фрагментов они образовывали компактную массу, в ко торой развиваются участки хорды. Комбинация 4-5 таких фрагментов приво дила к образованию мышц, хорды и эпидермиса. При культивировании 6- фрагментов возникали мозговые структуры, обычно на другом конце экс плантата. Суммарную картину развития можно представить следующим об разом:
— 1 фрагмент – мышцы;
— 2-4 фрагмента – мышцы + хорда;
— 4-5 фрагментов – мышцы + хорда + эпидермис;
— 6-10 фрагментов – мышцы + хорда + эпидермис + ЦНС.
Г.В.Лопашов предположил, что на стадии ранней гаструлы в зоне бу дущей мезодермы изменяются свойства в направлении от краевой зоны к эк тодерме. Между эктодермальной и мезодермальной компетенцией этой зоны (т.е. способностью формировать эктодермальные и мезодермальные произ водные) существуют определенные соотношения, так что увеличение общего количества презумптивных мезодермальных тканей приводит к нейрализа ции надголовной ткани.
Взаимодействие индуктора и компетентной ткани характеризуют сле дующие три параметра: проникновение индуцирующих агентов в компетент ную ткань, пространственные закономерности взаимодействия, временные закономерности взаимодействия.
В опытах Ж.Браше, К.Гробстайна, Л.Саксена и др. было показано, что отделение индуктора от компетентной ткани с помощью мембранных фильт ров, предотвращающих их контакт, не допускающих диффузию индуцирую щих агентов, не предотвращает индукцию. Более того, если прокультивиро вать индуцирующую ткань в физиологическом растворе, затем удалить ее и поместить в этот раствор компетентную ткань, последняя обнаружит способ ность ко всем формообразовательным процессам, происходящим в ходе обычной индукции. Это наводит на мысль, что для осуществления индуци рующего эффекта важен не контакт индуктора и компетентной ткани, а транспорт индуцирующих агентов в компетентную ткань.
Прямые доказательства этого положения были получены еще в 60-е го ды XX в. группой финского эмбриолога С.Тойвонена. Суть проведенных ими экспериментов такова. Получили антисыворотку против индуктора и поме тили ее флуоресцеином изотиоцианата так, чтобы она светилась в ультра фиолетовом свете. После этого готовили сэндвич из компетентной ткани (ис пользовали эктодермы тритона) и ткани индуктора, который культивировали 1, 3, 6 и 12 часов. По прошествии этих промежутков времени изучали, во первых, морфогенез, а во-вторых, с помощью меченой антисыворотки (анти сывороткой обрабатывали срез с сэндвича так, что в месте расположения ин дуктора он связывался с антисывороткой и светился) распределение индуци рующего вещества в сэндвиче. Оказалось, что оно в течение 3 часов культи вирования не проникает в эктодерму, и морфогенетические процессы отсут ствуют. После 3-го часа культивирования индуцирующий агент начинает проникать в эктодерму. При этом обнаруживаются первые признаки морфо генеза. Через 6 часов вся эктодерма заполнена индуцирующим агентом – и морфогенез в полном разгаре. Налицо, таким образом, корреляция между развертыванием во времени процесса эмбриональной индукции и транспор тировкой индуцирующих веществ в эктодерму.
Пространственные закономерности взаимодействия индуктора с ком петентной тканью проявляются в строгом соответствии положения ткани ин дуктора и реагирующей системы друг относительно друга. К.Равен и Дж.
Клоос показали, что ткань организатора (каковым у амфибий является крыша первичной кишки) приобретает в ходе развития кранио-каудальный и медио латеральный градиенты.
Первый проявляется в том, что прехордальная пластинка становится переднеголовным индуктором, а в каудальном направлении способность к индукции переднеголовных структур постепенно падает. Второй выражается в максимальной способности медиальной зоны к индукции нервной системы.
В латеральном направлении эта способность падает и заменяется свойством индуцировать образование лишь некоторых производных нервного гребня.
Временные закономерности взаимодействия индуктора и компетентной ткани проявляются в величине времени контакта тканей организатора и реа гирующей системы для достижения положительного эффекта индукции.
Они изучаются с помощью использования сэндвичей, из которых в лю бой момент времени можно легко удалить ткань индуктора. Оказалось, что минимальное необходимое для осуществления индукции время контакта двух взаимодействующих систем весьма различно для разных животных (и для разных видов индукции) Так, для получения эффекта архенцефалической индукции в эктодерме аксолотлей достаточно 5 минут контакта с тканью ор ганизатора, в то время как для тритона это время достигает 4 часов. Чтобы получить спино-каудальные и туловищно-мезодермальные структуры для за родышей аксолотля, необходимо 10-часовое взаимодействие этих систем, а для тритонов время контакта еще более продолжительное.
Г.Эйял-Гилади обнаружила, что в зависимости от времени контакта ткани организатора и реагирующей системы может измениться эффект ин дукции, так что индуцируемые структуры располагаются в следующий ряд:
нормальный эпидермис – производные нервного гребня (пигментные клетки) передне-головная индукция – каудальная структура.
Следовательно, для регионализации (или, как говорят, индивидуации) основное значение имеет не продолжительность контакта, а строгое про странственно-временное соответствие физиологически активного состояния индуктора и реагирующей системы. Нарушение этого соответствия ведет к нарушению эффекта индукции.
Эктодерма ранней гаструлы амфибий используется как тест-система для выявления молекул-индукторов (морфогенов).
Биологическое тестирование различных веществ на их индуцирующий эффект и выявление активных в этом отношении молекул (которые обычно называют морфогенами) осуществляется, как правило, с помощью эктодермы ранней гаструлы (ЭРГ) в связи с тем, что именно в этой эмбриональной за кладке развертываются события, обозначаемые как первичная эмбриональная индукция.
ЭРГ представляет собой пласт клеток анимальной половины ранних зародышей. Ее принято подразделять на анимальную, вентральную и дор сальную зоны. Первые две обычно развиваются в эпидермисе, значительная часть дорсальной зоны образует зачаток ЦНС, при этом ее наружный слой формирует выстилку полости нервной трубки, а в образовании самой ткани мозга участвуют клетки внутреннего слоя эктодермы гаструлы. Области дор сальной эктодермы, прилежащие к верхней губе бластопора, дифференциру ются в мезодермальном направлении.
Для тестирования биологической активности морфогенов используют два подхода: 1) имплантацию морфогенов in vivo и 2) комбинирование мор фогенов с эктодермой in vitro.
Независимо от способа биотестирования индукторы (ткань, экстракт, фракция) приводятся в контакт с внутренней поверхностью ЭРГ амфибий.
Эффекты морфогенов оцениваются, в основном, на гистологическом уровне спустя 5-14 суток от момента воздействия. При этом в эктодерме обнаружи ваются разные типы дифференцированных клеток, эпидермис, малодиффе ренцированная ткань, эпителиальные пузыри, клетки мезенхимы, меланофо ры (пигментные клетки), погибшие клетки.
К первому морфогенетическому взаимодействию в ходе развития ам фибий относят открытое П.Ньюкупом взаимодействие между анимальной и вегетативной частями зародыша на стадии морулы. К этому моменту (64 клеточный зародыш) клетки вегетативного полюса способны оказывать вы раженное мезодермализующее влияние на анимальную половину зародыша.
В результате этого воздействия в экваториальной зоне зародыша возникает зачаток мезодермы, а остальные клетки анимальной половины детерминиру ются в эктодермальном направлении. Разные зоны вегетативного полюса ин дуцируют в эктодерме мезодермальные территории (дорсальную, вентраль ную) с различной судьбой.
Источником последующих индукционных влияний является зачаток мезодермы. В процессе развития он разделяется на две зоны – дорсальную и вентральную. В период гаструляции-нейруляции различные участки мезо дермы приходят в контакт с другими тканями зародыша и оказывают на них индуцирующее влияние. В результате к концу нейруляции в пределах каждо го из трех зародышевых листков (эктодерма, мезодерма, энтодерма) имеются определенные компартменты, содержащие клетки-предшественники соответ ствующих линий дифференцировки.
Следовательно, к этому моменту развития дефинитивный план тела уже достигнут и стабилизирован. Отсюда можно сделать вывод, что морфо гены, ответственные за построение данного плана, действуют главным обра зом на стадии бластулы-нейрулы.
Молекулярная природа индукторов Мезодермальная индукция Первое индуцирующее событие в эмбриогенезе заключается в стиму ляции презумптивной (будущей) энтодермой образования презумптивной ме зодермы. Оказалось, что если эксплантировать клетки анимального и вегета тивного полюса со стадии бластулы Xenopus laevis, то они сформируют толь ко эктодерму и энтодерму, но эктодерма может быть индуцирована к форми рованию мезодермальной ткани в комбинации, содержащей вместе эктодер мальные и энтодермальные клетки. Эти наблюдения позволили предполо жить, что вегетативная энтодерма продуцирует индуцирующий образование мезодермы сигнал в период стадии дробления. Энтодерма, кроме того, может определять дорсовентральный паттерн мезодермы: дорсальные вегетативные клетки индуцируют дорсальную мезодерму, в то время как латеральные и вентральные вегетативные клетки – вентролатеральную мезодерму (мезен хима, кровь и небольшое количество мышц). Трансплантированные дорсаль ные вегетативные бластомеры могут индуцировать эктопические дорсальные осевые структуры, в связи с чем эти клетки принято называть энтодермаль ным организатором, или центром Ньюкупа.
Идентификация мезодермальных индукторов была облегчена культи вированием эмбриональных тканей амфибий в среде, содержащей предпола гаемые индуцирующие факторы, а также инъекцией в бластомеры соответст вующей мРНК. Таким способом было обнаружено несколько субстанций, индуцирующих образование мезодермы.
Vgl – локализованный в вегетативной части зародыша индуцирующий мезодерму фактор, член суперсемейства transforming growth factor-beta (TGF бета), локализован в вегетативной области ооцитов и эмбрионов Xenopus на стадии дробления. TGF-родственные молекулы формируют дисульфидсвя занные димеры, которые дробятся, высвобождая зрелые COOH-terminal пептиды как сецернируемый биологически активный димер. Белок Vgl явля ется уникальным по своей способности индуцировать дорсальную мезодерму и организовывать полную дорсальную ось. Продукция зрелого Vgl может быть достаточной для индукции дорсальной мезодермы.
Активин – один из самых известных белков, источников индукции дор сальной мезодермальной ткани. Это доказывается в экспериментах по обра ботке активином эксплантатов ткани анимального полюса эмбрионов. При высоких дозах активина формируются «эмбриоиды», обнаруживающие ру диментарные осевые и головные структуры. Несмотря на отсутствие синте зирующей активин материнской РНК, активиноподобная активность опреде ляется в ооцитах и ранних эмбрионах: по-видимому, этот белок образуется еще в период оогенеза или передается в созревающий ооцит из окружающих фолликулярных клеток. Микроинъекция активиновой мРНК в эксплантаты клеток анимального полюса индуцирует образование дорсальной мезодермы.
В отличие от экспрессии Vgl, инъекции активиновой мРНК организуют толь ко часть дорсальной оси: отсутствуют нотохорда и головные структуры.
Предполагается, что градиент распределения активина может детерминиро вать характерный мезодермальный паттерн. Однако, по-видимому, не только одна концентрация индуктора устанавливает соответствующий паттерн. Есть основания считать, что реагирующая ткань также содержит определенную информацию о паттерне, в частности о том, что формировать нотохорду под влиянием активина могут эксплантаты клеток проспективного дорсального анимального полюса.
Рецепторы для семейства TGF- бета, принадлежащие к одному из двух классов – тип I и тип II, кодируют цитоплазматическую серин-треонин кина зу и функционируют как гетеродимерный комплекс. У Xenopus мРНК для ак тивинового рецептора типа II экспрессируется по материнскому типу и рас пределяется равномерно. Экспрессия «урезанного» рецептора, у которого от сутствует домен цитоплазматической киназы, блокировала активность акти вина в анимальном полюсе. Микроинъекция этого доминантного тормозяще го рецептора в ранний эмбрион полностью ингибировала формирование ме зодермы, о чем свидетельствуют как гистологические, так и молекулярные критерии. Эти наблюдения подтверждают роль активина в эндогенной мезо дермальной индукции.
Естественным ингибитором активина является активинсвязывающий белок фоллистатин. У Xenopus фоллистатин экспрессируется по материнско му типу и блокирует активинопосредованную индукцию на анимальном по люсе эксплантата, однако, в отличие от действия фоллистатина в ранних эм брионах, не тормозит индукцию мезодермы Vgl. Функции активина были ис следованы во множестве систем позвоночных. У цыпленка активиновая мРНК экспрессируется в гипобласте (индуцирующая ткань) в период форми рования осевой мезодермы, а растворимый активин индуцирует осевую орга низацию в эпибласте (реагирующая система). У рыб известен доминантный активинингибирующий мутант, у которого блокируется формирование мезо дермы и всей системы осевых органов. У мышей мутация гена, кодирующего активин бета-В не вызывает серьезных дефектов в развитии, но при этом функционирует второй активиновый ген, возможно, компенсирующий вы званный мутацией дефект.
Bone morphogenetic protein (BMP) – способен стимулировать образова ние кости и у эмбрионов Xenopus экспрессируется по материнскому типу.
ВМР4 индуцирует вентральную мезодермальную ткань, включая кровь и вентролатеральные молекулярные маркеры. Кроме того, экспрессия ВМР4 в эксплантатах клеток анимального полюса модифицирует индукцию активи ном, вызывая супрессию формирования дорсальной мезодермы. У эмбрионов ВМР4 тормозит формирование переднедорсальных структур, оказывая «вен трализующий» эффект на мезодерму. Изоляция рецепторов ВМР2 и ВМР4 у позвоночных позволила исследовать функции BMP у эмбрионов. Так, экс прессия доминантных ингибиторных мутантов, сходных с таковыми по туло вищному активиновому рецептору, блокировала индукцию мезодермы ВМР в эксплантатах анимального полюса и опосредованную ВМР4 вентрализацию эмбрионов. Под влиянием эмбриональной экспрессии индукция эндогенной мезодермы не блокировалась, но возникала «дорсализация» мезодермы, вы зывая формирование эктопических дорсальных осевых структур. Отсюда следует, что действие BMP несущественно для индукции мезодермы, но включено в дорсовентральную организацию мезодермы и в формирование вентральной мезодермы в особенности. Туловищный рецептор BMP не бло кирует активность активина. Туловищный рецептор активина тормозит ин дукцию мезодермы ВМР4. Это подтверждает, что путем блокирования эндо генного формирования мезодермы туловищный рецептор активина тормозит несколько различных TGF-бета-родственных факторов. В индукцию мезо дермы включен дополнительный TGF-родственный ген – ген nodal мыши.
Этот ген экспрессируется перед началом гаструляции, что существенно для формирования мезодермы и осевых структур. Эмбрионы, гомозиготные по его нарушению, утрачивают способность к формированию организованной мезодермальной ткани, и вследствие этого не формируются первичная по лоска и осевая организация.
Fibroblast growth factor (FGF) – это первый очищенный фактор, демон стрировавший способность индуцировать образование мезодермы в эксплан татах клеток анимального полюса. Транскрипты и белок для нескольких форм FGF- и FGF-рецепторов Xenopus экспрессируются по материнскому типу. FGF-белок индуцирует вентро-латеральную мезодерму, включая ме зенхиму и небольшое количество мышц, но неспособен индуцировать дор сальную мезодерму и дефинитивную вентральную ткань, кровь. Экспрессия доминантного ингибирующего FGF-рецептора тормозит индукцию мезодер мы FGF в эксплантатах клеток анимального полюса. У таких эмбрионов на блюдаются дефекты в развитии туловища и задней части при нормальном со стоянии передних отделов. Отсюда следует, что FGF-сигнал требуется для формирования туловищной и задней мезодермы, включая нотохорду и мыш цы. В то же время активин-сигнал зависит от функционального FGF-сиг нала. Следовательно, FGF-сигнал необходим для ответа туловищных клеток и клеток заднего отдела развивающегося эмбриона на индукцию активином, однако формирование переднедорсальных мезодермальных структур не за висит от FGF-сигнала. Неясно, стимулируются ли сигнальные пути активина и FGF внутри одной клетки или в различные периоды внутри общей клеточ ной популяции.
Wnt – это семейство состоит из генов, родственных гену сегментарной полярности wingless Drosophila. Индукция эктопических дорсальных осевых структур после сверхэкспрессии мышиного wnt-1 у эмбрионов Xenopus сти мулировала исследование генов wnt Xenopus (Xwnt). Инъекция Xwnt-1 или Xwnt-8 мРНК индуцировала формирование полной дорсальной оси, включая головные структуры. Однако мРНК Xwnt-8 проявляла слабую или не прояв ляла совсем мезодерминдуцирующую активность в эксплантатах клеток ани мального полюса, показывая, что формирование эктопической оси является результатом модификации дорсовентрального паттерна предсуществующей мезодермы. Дополнительные исследования продемонстрировали, что ген wnt может действовать как модификатор компетенции, изменяя ответ клетки на воздействие индуцирующего агента и усиливая формирование дорсальных мезодермальных структур. В то же время показано, что активность этого гена определяется на стадии гаструлы в вентральной, а не в дорсальной мезодер ме. В связи с этим предполагается, что его продукт способствует трансфор мации дорсальной ткани в вентральную.
Экспрессия мышиного гена wnt-3А ограничивается первичной полос кой, презумптивной осевой мезодермой. Нарушение его функционирования обусловливает отсутствие организованных мезодермальных структур позади передних конечностей.
Noggin – этот ген кодирует сецернируемый полипептид, восстанавли вающий способность к формированию дорсальной оси у облученных ульт рафиолетом эмбрионов. Он экспрессируется одинаково в ооцитах и дробя щихся эмбрионах Xenopus. Его транскрипты локализуются в дорсальной губе бластопора (организатор Шпемана) на стадии гаструлы и позднее – в ното хорде. Ноггин не индуцирует мезодерму в эксплантатах клеток анимального полюса, но может дорсализовать эксплантаты вентральной маргинальной зо ны гаструлы. Следовательно, ноггин может функционировать как дорсали зующий модификатор мезодермального паттерна.
Нейральная индукция Мезодермальная индукция и мезодермальный паттерн связаны непо средственно со сложными клеточными движениями в ходе гаструляции. Осе вые мезодермальные структуры формируются из дорсальной маргинальной зоны, при этом изменения тканевого взаиморасположения в результате гаст руляционных движений обеспечивают дополнительные индуктивные собы тия, включая феномен нейральной индукции.
То, что центральная нервная система позвоночных возникает в процес се гаструляции в результате взаимодействия дорсальной эктодермы и, под стилающей ее, дорсальной мезодермы, было впервые продемонстрировано Г.Шпеманом и О.Мангольд в экспериментах по трансплантации ткани орга низатора. Предполагалось, что при этом функционирует два рода сигналов.
Впячивающаяся в ходе гаструляции хордомезодерма (презумптивная ното хорда) посылает вертикальный сигнал вышележащей эктодерме, и мезодер мальные организующие сигналы распространяются горизонтально внутри эктодермы. Мангольд показала, что передне-задний паттерн (А-Р) индуциро ванной нервной ткани отражает А-Р-характер индуцирующей мезодермы.
В опытах П.Ньюкупа была отчетливо показана роль горизонтального уровня в передаче сигналов и осуществлении эмбриональной индукции. Роль вертикальных сигналов в нейральной индукции была подтверждена в экспе риментах по экзогаструляции. Дифференцировка мезодермы в экзогаструле происходит, однако нейральные структуры не образуются, демонстрируя, что в таких условиях индуцирующие сигналы не доходят до эктодермы. Однако недавно было показано, что молекулярные нейральные маркеры экспресси руются в эктодерме экзогаструлы. По-видимому, молекулярно-генетические системы, обусловливающие специфическую нейральную дифференцировку и специфические формообразовательные процессы, разделены и функциони руют автономно, независимо друг от друга.
В то же время следует отметить, что в презумптивной эктодерме име ется своеобразная региональная преформированность к специфическому от вету на индуктивный стимул. Она выявляется с помощью молекулярных маркеров: так, эпидермальный маркер Epil экспрессируется в презумптивной ненейральной эктодерме, но не в будущей нервной пластинке. Это обстоя тельство обусловливает дифференциальный ответ дорсальной и вентральной эктодермы на нейральную индукцию. Рекомбинанты хордомезодермы и дор сальной эктодермы характеризуются выраженной экспрессией нейральных маркеров, в то время как вентральная эктодерма экспрессирует эти маркеры на очень низком уровне в ответ на те же самые сигналы. Однако вентральная эктодерма способна продуцировать полный спектр нейральных производных.
Диссоциация презумптивной эктодермы на клетки с их последующим культивированием обеспечивает дополнительный импульс к нейральной дифференцировке. В отсутствие какой-либо обработки интактные экспланта ты клеток анимального полюса дифференцируются в атипический эпидер мис, но если такие эксплантаты подвергали диссоциации с последующим культивированием в виде отдельных клеток в течение нескольких часов, то в реагрегатах наблюдались нейральная дифференцировка и экспрессия ней ральных маркеров. Этот результат показывает, что клеточные взаимодейст вия тормозят нейральную дифференцировку, а диссоциация на отдельные клетки способствует снятию этой репрессии.
Молекулярная природа нейроиндуцирующих факторов была выяснена в основном благодаря исследованиям, проведенным на цыпленке и на Xenopus. Был выявлен целый ряд секретируемых факторов, способных инду цировать паттерн нервной ткани.
Noggin – это основной нейроиндуцирующий агент. Был изолирован благодаря способности дорсализовать мезодерму. Транскрипты ноггинового гена экспрессируются в ткани организатора на стадии гаструлы и в нотохор де на более поздних стадиях развития, вызывая в обоих случаях нейроинду цирующий эффект. Добавление белка ноггина к эктодерме бластулы, компе тентной к образованию мезодермы и нейральной индукции, стимулирует по явление нейральных маркеров в отсутствие определимой мезодермы, демон стрируя прямую индукцию нервной ткани. Обработка ноггином индуцирует появление общих и передних нейральных маркеров, но в эксплантатах не вы являются маркеры заднего и спинного мозга. Предполагается, что ноггин яв ляется начальным передним индуктором, однако в индуцированной к ней ральному развитию ткани экспрессируется также фоллистатин. Он непосред ственно индуцирует передние нейральные структуры, являясь, возможно, не зависимым индуктором переднеголовных структур.
Были, в частности, проведены эксперименты по прямой индукции нервной ткани ноггином, который добавляли в среду, где культивировали клетки анимального полюса бластулы Xenopus. При этом наблюдали селек тивную экспрессию нейральных и мезодермальных специфических транс криптов. В качестве маркеров служили: NCAM – молекула клеточной адге зии, экспрессируемая в нервной системе, изоформа бета-тубулина, свойст венная заднему и спинному мозгу, экспрессирующийся в нервной ткани ген промежуточных филаментов XIF3 и мышечный актин.
Notch – ген открыт и впервые выделен у дрозофилы. Он кодирует трансмембранный белок, участвующий в определении судьбы клеток нейро эктодермы, выборе ими нейрального или эпидермального пути развития.
Плейотропный эффект этого гена (например, при развитии крыльев) указы вает на его участие в детерминации судьбы и многих других клеток. У Xenopus обнаружен гомолог гена Notch (Xotch), который экспрессируется, как и у дрозофилы, по материнскому типу (т.е. продукт его появляется в яйце еще до оплодотворения, в ходе оогенеза). Его продукт локализуется в дор сальной эктодерме нейрулы, включая и презумптивную нервную пластинку, и ненейральную эктодерму. Активация мутации Xotch, вызывающей утрату большей части экстрацеллюлярной области, вызывала нарушения развития, сходные с выявленными у дрозофилы, – гипертрофию нервной трубки и от сутствие передних эктодермальных структур. Этот эффект не является ре зультатом прямой нейральной индукции, поскольку экспрессия гена в компе тентной эктодерме не сопровождается дифференцировкой нервной ткани.
Однако мутация Xotch вызывает усиленный ответ эктодермального эксплан тата на действие нейрального индуктора, что может быть результатом увели чения периода компетенции в эктодермальной ткани и нарушения ее способ ности дифференцироваться в эпидермальном направлении. Кроме того, эти результаты показывают, что ген Xotch в презумптивной нервной пластинке действует как фактор, регулирующий пропорцию некоммитированных кле ток, способных отвечать на воздействие нейрального индуктора.
Wnt – члены этого семейства генов обусловливают развитие ограни ченного разнообразия фенотипических паттернов в развивающейся цен тральной нервной системе. У нормальных мышей ген wnt-1 экспрессируется в области среднего и заднего мозга. В случае его мутации наблюдается утра та среднего мозга и мозжечковых структур, в то время как остальные отделы ЦНС, как и другие эмбриональные образования, не страдают. Гиперэкспрес сия гена wnt-1 в вентральной зоне нервной трубки вызывает существенные расстройства в морфогенезе нервной трубки. Эти изменения обусловлены увеличением клеточной пролиферации в ее вентральной области, в то время как при дальнейшей экспрессии вентральных маркеров последующих нару шений развития дорсо-вентрального паттерна не обнаружено. Следователь но, ген wnt-1 функционирует как регулятор клеточной пролиферации Dorsalin – член семейства TGF-beta. Соответствующий ген выделен из спинного мозга цыпленка. Транскрипты этого гена впервые обнаруживаются при замыкании нервной пластинки в трубку. Экспрессия гена ограничивается нервной трубкой и нервными валиками. Трансплантация нотохорды в дор сальную область нервной трубки тормозит экспрессию гена dorsalin 1, что совпадает с эктопической индукцией вентральных структур, включая мото нейроны вентральных рогов спинного мозга. Очевидно, ограничение экс прессии этого гена проистекает из тормозящих вентральных сигналов. В экс плантатах нервной пластинки dorsalin 1 стимулирует дифференцировку оп ределенных клеток, производных нервного гребня (дорсальная ткань) и тор мозит дифференцировку мотонейронов (вентро-латеральная ткань).
Основываясь на изложенных результатах, можно придти к заключе нию, что клеточная дифференцировка вдоль дорсовентральной оси контро лируется соотношением локальной концентрации двух диффундирующих сигналов – один из них продуцируется дорсальной нервной трубкой (dorsalin 1), второй – вентрально локализованной нотохордой.
При этом первоначально вся нервная трубка компетентна к экспрессии гена dorsalin 1, но эта способность впоследствии ограничивается дорсальной третью нервной трубки вследствие диффундирующего сигнала из нотохорды, который одновременно индуцирует дифференцировку мотонейронов.
Белок dorsalin 1 стимулирует дифференцировку клеток нервного гребня в дорсальной части нервной трубки, его диффузия в вентральном направле нии подавляет вентральные сигналы, устанавливая таким способом верхнюю границу дифференцировки мотонейронов.
Следовательно, и в этом случае морфогенетические процессы, как и клеточная дифференцировка, осуществляются в результате взаимодействия стимулирующих и тормозящих сигналов.
Какой ген отвечает за продукцию вентрального сигнала, производного нотохорды? В настоящее время биологи убеждены, что у позвоночных наи лучший кандидат на эту роль – гомолог гена hedgehog.
Hedgehog – выполняет у дрозофилы функции гена сегментарной по лярности и синтезирует секретируемый фактор, контролирующий паттерн распределения клеток в ходе сегментации и развития имагинальных дисков.
Его гомолог у позвоночных был изолирован и изучен. Оказалось, что его экс прессия происходит в нескольких тканях, оказывая регулирующее влияние на формирование клеточного паттерна в нотохорде, основании нервной трубки (вентральная область) и почках задних конечностей. Экспрессии гена hedgehog, инъецированного зародышам лягушек или Zebrafish, а также у трансгенных мышей вызывает эктопическую экспрессию маркеров вентраль ной части нервной трубки и формирование ее основания в дорсальной и про межуточной частях спинного мозга.
Следовательно, подобно мезодермальной индукции, нейральная ин дукция включает индукторы нервной ткани (ноггин), модификаторы ней рального паттерна (белки xotch, dorsalinl, hedgehog) и ингибиторы (ВМР4).
Морфологические преобразования и клеточные процессы, лежащие в основе органогенезов Процессы органогенезов сложны и многообразны даже при сравни тельно беглом их рассмотрении. Тем не менее, оказывается возможным вы делить общие типы морфологических преобразований, которые лежат в ос нове большинства из них.
Почти все органы и структуры позвоночных животных формируются из участков столбчатого (поляризованного) эпителия. Наиболее существен ными исключениями из этого правила являются элементы скелета и крове носные сосуды, строящиеся из мезенхимных клеток. Другие закладки, даже если они возникают из отдельных, разрозненных мезенхимных клеток мезо дермального происхождения (сомиты, зачатки органов выделения), по ходу своего развития непременно проходят эпителизацию, т.е. превращаются в участки эпителиальных пластов.
По современным данным, в основе которых лежат работы американ ского ученого Д. Эдельмана, эпителизация мезенхимы, а также усиление контактов между эпителиальными клетками (происходящее при их поляри зации) связаны с синтезом в данных клетках так называемых молекул кле точной адгезии (англ. – cell adhesion molecules, или САМ, по-русски читается «кам»). Они представляют собой гликопротеины. Описаны и выделены гены, кодирующие различные виды САМ. Широкое распространение в зародышах и взрослых организмах имеет разновидность этих молекул, названная N CAM. Эти молекулы определяют, в частности, адгезию нейроэпителиальных клеток зародыша друг к другу (N – от neural). У зародышей шпорцевой ля гушки они появляются перед началом нейруляции, когда возрастают кон тактные зоны между поляризующимися клетками нервной пластинки. При сутствуют они и в других столбчатых эпителиях. Другая разновидность мо лекул клеточной адгезии называется L-CAM. Она выделена из печени (L – от liver – печень), но встречается и во многих типах клеток. При подавлении синтеза САМ клетки данного типа не образуют между собой контактов. На оборот, если в мезенхимные клетки, лишенные генов L-CAM, ввести эти ге ны, то клетки склеиваются в плотный эпителий. Наконец, описаны так назы ваемые Ng-CAM, ответственные за установление контактов между нейрона ми и клетками нейроглии.
Наличие и распределение различных видом САМ резко меняются по ходу развития зародышей. В бластодерме куриного зародыша до начала гаст руляции наблюдается более или менее равномерное распределение как N CAM, так и L-CAM по всему эпибласту и гипобласту. При миграции мезо дермальных клеток через первичную бороздку на их поверхности вообще не обнаруживается САМ. Вскоре, однако, на поверхности клеток презумптив ной нервной системы и осевых органов обнаруживаются исключительно мо лекулы N-CAM, а на клетках будущей покровной эктодермы и энтодермы – исключительно L-CAM.
Сходные молекулы клеточной адгезии – кадгерины – обнаружены у за родышей млекопитающих, причем один из них (Е-кадгерин) выявляется уже на стадии зиготы. Позже в трофобласте, а также в стенке матки обнаружива ется другой вид молекул – Р-кадгерин, возможно, ответственный за клеточ ные контакты при имплантации зародыша. Клетки нейроэктодермы утрачи вают Е-кадгерин, но приобретают новый – N-кадгерин. Таким образом, па раллельно с морфологическими изменениями происходят сложные молеку лярные перестройки клеточных поверхностей, определяющие, какие клетки будут в дальнейшем развиваться совместно, а какие – отделяться друг от дру га.
Поляризация эпителиальных клеток, конечно, не сводится к синтезам молекул клеточной адгезии. Она связана со сложными процессами преобра зования элементов цитоскелета и клеточной мембраны, распространяющихся на весь поляризующийся участок пласта. Изменения формы клеточных пла стов при гаструляции и нейруляции связаны с активными сокращениями по ляризованных и часто при этом скошенных клеток. Судя по всему, такая же последовательность событий – поляризация клеток и их сокращение вдоль длинных осей – лежит в основе формообразования и других зачатков орга нов. Такой способ формообразования не требует особых факторов, направ ляющих клеточные движения. Например, если участок эмбрионального эпи телия выпячивается в какую-либо сторону, это не значит, что должен суще ствовать некоторый фактор, привлекающий клетки в эту сторону: направле ние выпячивания заранее и однозначно задано ориентацией поляризованных клеток, а ориентация – тем, какая из двух поверхностей пласта (внешняя или внутренняя) сократилась. Последнее обычно определяется исходной поляр ностью клеток данного пласта. Как правило, в поляризованных участках эк тодермы (нейроэпителий, плакоды органов чувств) сокращается наружная поверхность, отчего последующие впячивания направлены всегда внутрь. Но после завершения нейруляции исходно наружная поверхность нейроэпителия оказывается внутри (образует выстилку невроцеля), поэтому ее же дальней шие сокращения образуют выпячивания, направленные наружу (глазные пу зыри, отделы головного мозга).
Таким образом, в основе морфологических преобразований при орга ногенезах лежат процессы поляризации и сокращения клеток.
Размножение клеток вопреки ряду прежних представлений играет в морфологических преобразованиях при органогенезах сравнительно малую роль. Клеточное размножение, конечно, необходимо, чтобы создать опреде ленный запас клеток, но, как правило, не оно определяет форму зачатка. По казано, например, что наиболее существенные морфологические преобразо вания в развитии центральной нервной системы происходят в период мини мальной митотической активности ее клеток.
Определенную роль в формообразовании играет запрограммированная гибель клеток – апоптоз. Такие провизорные (не присутствующие во взрос лом состоянии) эмбриональные закладки, как пронефрос и мезонефрос заро дышей высших позвоночных, гибнут путем апоптоза. Возможно, что апоптоз участвует в образовании полостей и канальцев, если зачатки органов были вначале сплошными. Пальцевые фаланги у птиц и млекопитающих разъеди няются потому, что клетки в промежутках между ними гибнут. В последнем случае, однако, процессы апоптоза лишь «дорисовывают» ранее намеченное.
Так, гибель межфаланговых клеток происходит уже после того, как сформи ровались хрящи фаланг, и покровный эпителий соответствующим образом подразделился.
Направленные движения эмбриональных клеток и их факторы Основную роль в органогенезах играет кооперативное, согласованное поведение (поляризация, сокращение) обширных групп клеток, в ходе кото рого отдельные клетки перемещаются и меняют своих соседей сравнительно мало. Однако наряду с этими процессами в некоторых случаях наблюдаются весьма далекие миграции клеточных групп или одиночных клеток. На ранних стадиях развития зародышей позвоночных сюда можно отнести вентродор сальные движения мезодермы. На более поздних стадиях развития самыми активными мигрантами являются клетки, произошедшие из нервного гребня.
Источник