- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
- Альтернативные методы получения этилена
- Цели разработки альтернативных методов получения этилена
- Окислительное дегидрирование этана
- Дегидратация биоэтанола
- Выводы
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник
Альтернативные методы получения этилена
Автор: А.И. Абсаттаров, Н.И. Зеленцова (ООО «ВНИИОС-наука»), Ю.А. Писаренко (МТУ).
Опубликовано в журнале Химическая техника №11/2016
В последнее время все чаще стал возникать вопрос о малотоннажных установках производства этилена.
Зачастую это связано с потребностью в обеспечении сырьем производств сопоплимеров. Большая удаленность потребителей и производств этилена друг от друга, сложности при транспортировке этилена все чаще заставляют большие компании задумываться об самостоятельных установках получения этилена.
В таких случаях, как правило, рассматривают целесообразность строительства производства этилена путем пиролиза углеводородного сырья. При пиролизе углеводородов, кроме этилена, продуктами термической обработки являются метан, ацетилен, углеводородные фракции С3, С4, С5, С6+ и др. компоненты. Даже при пиролизе этана селективность по основному продукту – этилену, составляет не более 80% при конверсии этана 60-65 %.
Наличие вышеуказанных продуктов требует их дальнейшей переработки, реализации, или утилизации. Выделение этилена полимеризационной чистоты из такой смеси продуктов требует высоких эксплуатационных и капитальных затрат. Для предприятий, нуждающихся исключительно в небольших количествах этилена и не имеющих потребности в побочных продуктах пиролиза (такие как производства полимеров/сополимеров) строительство установки пиролиза углеводородного сырья может быть крайне невыгодно по следующим причинам:
- несмотря на низкую производительность установки, технология выделения этилена из продуктов пиролиза остается по-прежнему сложной, т.е. снижение производительности установки не исключает каких-либо стадий и узлов газоразделения;
- на фоне низкой производительности по целевому продукту и высоких капитальных затрат, обусловленных причинами, указанными в пункте выше, такая установка имела бы высокие удельные капитальные затраты и, как следствие, длительный потенциальный срок окупаемости капиталовложений;
- как уже было указано, даже при пиролизе этана получаются побочные продукты, которые необходимо отделять и впоследствии утилизировать или перерабатывать;
- в результате такой проект имел бы крайне мало шансов на получение инвестиций на реализацию.
Спрос на этилен со стороны производств сополимеров гарантирует переработку этилена в более дорогие продукты. Переработка дешевого сырья в этилен и впоследствии в сополимеры в рамках одного промышленного комплекса позволит достичь наименьших значений себестоимости товарной продукции, и, следовательно, высокой прибыли от ее реализации.
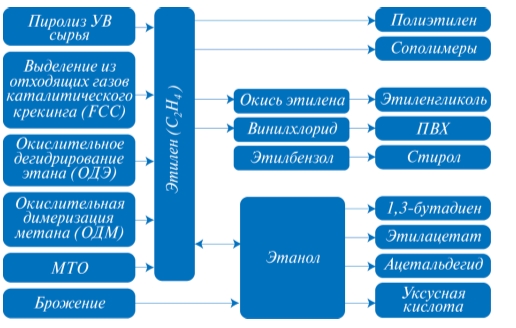
В связи с вышеуказанными причинами все чаще в качестве способов малотоннажного производства этилена рассматриваются альтернативные методы получения этилена. Среди таких методов: выделение этилена из отходящих газов каталитического крекинга (при наличии поблизости НПЗ, эксплуатирующего каталитический крекинг), окислительное дегидрирование этана, окислительная димеризация метана, получение этилена из низших спиртов – этанола и метанола (рис. 1). ООО «ВНИИОС-наука» уже много лет работает в области промышленного производства этилена, пропилена и других продуктов нефтехимии. Компания участвует в модернизациях и разработках технологий различных методов получения этилена: как основного способа получения этилена – пиролиза, так и альтернативных методов получения этилена, в том числе выделение этилена из отходящих газов каталитического крекинга, окислительное дегидрирование этана, окислительная димеризация метана, получение этилена из этанола. По данным процессам имеются патенты и готовые разработки.
Цели разработки альтернативных методов получения этилена
В данной статье более подробно остановимся на двух альтернативных методах получения этилена: окислительном дегидрировании этана и дегидратации биоэтанола. С учетом указанных недостатков пиролиза в условиях низкой производительности, требования к данным альтернативным процессам очевидны:
- достижение приемлемых удельных затрат на производство этилена при условиях низкой производительности (ориентировочно до 30 тыс. т/год по этилену). Также стоит рассматривать альтернативные процессы получения этилена в условиях отсутствия нефтяного сырья, что зачастую актуально для стран Европы, Латинской Америки и Южной Азии. В таких случаях цель ставится таким образом:
- достижение конкурентоспособной себестоимости по сравнению с себестоимостью этилена, получаемого путем пиролиза углеводородного сырья.
Окислительное дегидрирование этана
Реакция окислительного дегидрирования этана (ОДЭ) производится по следующей формуле:
C2H6 + 1/2O2 = C2H4 + H2O (1)
В качестве окислителя может применяться как концентрированный кислород, так и кислород в составе воздуха. Последние опыты по окислительному дегидрированию этана показали следующие результаты (в качестве окислителя применялся кислород с концентрацией 99,5 %):
- конверсия этана 74,0 %;
- селективность по этилену 82,0 %.
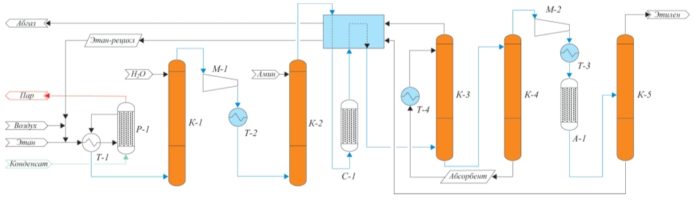
С использованием полученных данных была разработана схема выделения этилена из контактного газа окислительного дегидрирования этана, основанная на абсорбционном методе извлечении этан-этиленовой фракции. Принципиальная схема получения этилена путем ОДЭ представлена на рис. 2.
Рис. 2. Технология получения этилена методом ОДЭ
Схема включает реакционный узел Р-1, узел водной отмывки К-1, стадию предварительного удаления СО2 путем аминовой хемосорбции К-2, компримирования М-1, осушку С-1, колонны абсорбции и десорбции ЭЭФ (соответственно К-3 и К-4), колонну выделения товарного этилена К-5.
Разработанная технология является достаточно гибкой, чтобы проводить окислительное дегидрирование как концентрированным кислородом, так и кислородом воздуха или какой-либо промежуточной смесью воздухкислород. Для любого случая в зависимости от применяемого окислителя в представленной технологии решена проблема образования взрывоопасных смесей кислород-углеводороды-монооксид углерода, что делает технологию простой и безопасной.
Кроме того, гибкость технологии позволяет использовать различные катализаторы окислительного дегидрирования этана, т.е. при появлении новых катализаторов, являющихся по тем или иным характеристикам лучше ныне существующих, их также можно применять в данной технологической схеме.
Благодаря разработанной технологии, а также применению абсорбционной технологии выделения ЭЭФ из контактного газа, исключающей использование хладагентов с температурой ниже минус 37 °С, удалось достичь приемлемых для промышленной установки показателей эксплуатационных параметров. При моделировании технологии были получены следующие результаты:
Расходный коэффициент по сырью, т этана/т этилена 1,29
Расход электроэнергии, МВт⋅ч/т этилена 0,60
Степень извлечения этилена, % 98,5
Моделирование технологии ОДЭ с применением концентрированного кислорода показало значительно более низкие эксплуатационные затраты по сравнению с пиролизом этана (в качестве примера: потребление электроэнергии составляет соответственно 0,6 и 1,0).
Кроме того, технология ОДЭ имеет значительно более простую схему выделения этилена: отсутствуют узлы каталитического удаления ацетилена, низкотемпературного (до минус 100 °С) удаления метана и водорода и другие. В связи с этим данный способ получения этилена претендует на получение высоких результатов при дальнейших более подробных оценках экономической целесообразности реализации данного проекта.
Дегидратация биоэтанола
Реакция дегидратации этанола производится по следующей формуле:
C2H5OH = C2H4 + H20 (2)
Последние опыты по окислительному дегидрированию этилена показали следующие результаты:
- выход этилена, близкий к теоретическому, потребление сырья 1,77…1,87 т этанола/т этилена;
- содержание этилена в контактном газе после конденсации основной части реакционной воды 96–97% мас.;
- состав контактного газа позволяет исключить из технологии выделения этилена из реакционных газов дегидратации биоэтанола стадию удаления «легких» компонентов – содержание в смеси реакционных газов метана, СО и водорода не превышает 0,04% мас., что дает возможность получить этилен полимеризационной чистоты без применения упомянутой стадии газоразделения.
Таким образом, была разработана технология выделения этилена из реакционных газов, принципиальная схема технологии представлена на рис. 3.
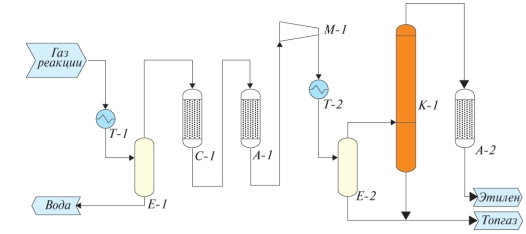
Схема включает узел конденсации реакционной воды Т-1, предварительную осушку С-1, узел удаления кислородсодержащих примесей А-1, компримирования М-1, колонну выделения товарного этилена К-1 и стадию доочистки этилена от остаточных примесей А-2.
Благодаря высокой селективности процесса, а также отсутствию стадии удаления «легких» компонентов, технология выделения этилена из реакционных газов дегидратации биоэтанола при моделировании показала весьма привлекательные коэффициенты эксплуатационных параметров. Например, потребление электроэнергии составило 0,35 МВт/т. этилена.
Учитывая простоту разделения газов дегидратации биоэтанола, низкий расходный коэффициент по сырью, а также низкие эксплуатационное параметры, можно сделать следующие выводы:
- процесс получения этилена из биоэтанола может быть конкурентоспособным способам получения этилена из нефтяного сырья;
- процесс имеет хорошие перспективы для реализации в странах, где нет прямого доступа к нефтяному сырью и имеется доступное сырье для производства биоэтанола (Украина, страны Южной Азии, страны Южной Америки и др.);
- процесс может быть альтернативой аналогичным, но более энергозатратным технологиям получения этилена из этанола, в странах, где рентабельность получения биоэтилена уже доказана, и подобные процессы реализуются в промышленном масштабе (Бразилия).
В РФ имеется большой потенциал для производства биоэтанола как для нужд нефтехимии, так и для использования в качестве присадок к жидкому топливу, однако из-за акцизной политики государства биоэтанол не может быть реализован как продукт, так как это повлечет за собой высокую себестоимость биоэтанола ввиду попадания под акциз (доля акциза достигает значений до 90 %).
Данный фактор затрудняет возможность использования биоэтанола в качестве сырья для получения этилена, так как требует реализацию такого процесса в рамках предприятия, также производящего биоэтанол, что влечет за собой дополнительные трудности, связанные с различной спецификой аграрных и нефтехимических производств.
Выводы
Разработанные технологии получения этилена позволяют достичь выгодных эксплуатационных параметров при достаточно простом конструктивном оформлении, являются гибкими и безопасными при эксплуатации. ООО «ВНИИОС-наука» может провести работы как по описанным в статье процессам, так и по другим альтернативным методам получения этилена: выделение этилена из сухого газа, окислительная димеризация метана. Проводится весь цикл работ по разработке и реализации технологии до этапа пуска установки.
Источник