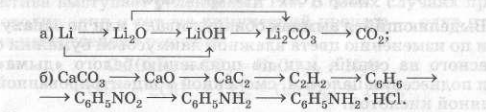- Дайте определение и классификацию оснований и оксидов. (По химий)
- Очень срочно дайте определение основаниям, предложите классификацию по двум признакам и способ образования названий
- Дайте определение основаниям предложите классификацию по 2 признакам способ образования названий
- Дайте определение понятия «основания».
Дайте определение и классификацию оснований и оксидов. (По химий)
Оксидами называются сложные вещества, состоящие из двух химических элементов, один из которых кислород.
Классификация оксидов. По химическим свойствам оксиды делятся на две группы:
1) безразличные – не образуют солей, например: NO, CO,
2) солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и II групп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO, MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д. И. Менделеева (CrO3, Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3, ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3, MnO2).
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-).
Классификация оснований по следующим признакам:
1. По кислотности (по числу групп ОН — в молекуле основания): однокислотные – NaOH, KOH, многокислотные – Ca(OH)2, Al(OH)3.
2. По растворимости: растворимые (щелочи) – LiOH, KOH, нерастворимые – Cu(OH)2, Al(OH)3.
3. По силе (по степени диссоциации):
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
1. По кислотности (по числу групп ОН — в молекуле основания): однокислотные – NaOH, KOH, многокислотные – Ca(OH)2, Al(OH)3.
2. По растворимости: растворимые (щелочи) – LiOH, KOH, нерастворимые – Cu(OH)2, Al(OH)3.
3. По силе (по степени диссоциации):
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
Источник
Очень срочно дайте определение основаниям, предложите классификацию по двум признакам и способ образования названий
Ответ:
основания — вещества, молекулы которых состоят из ионов металлов и одной (или нескольких) гидроксогруппы (гидроксида) -OH.
классификация на основные (металлы, проявляют основные свойства), кислотные (неметаллы, проявляют кислотные свойства) и амфотерные (металлы, проявляют основные и кислотные свойства)
Взаимодействие металла с водой
Взаимодействие оксида с водой
Разложение соли водой (гидролиз)
Взаимодействие соли и щелочи
3) 4Al+3O2=2Al2O3
Al2O3+6HCl=2AlCl3+3H2O
AlCl3+3NaOH=Al(OH)3+3NaCl
Al(OH)3+3HNO3=Al(NO3)3+3H2O
1) первое идет формула второе кислота третье соль
HAlO 2 Метаалюминиевая Метаалюминат, HBO 2 Метаборная Метаборат, H 3 BO 3 Ортоборная Ортоборат, HBr Бромоводородная Бромид, HCOOH Муравьиная Формиат , HCN Циановодородная Цианид, H 2 CO 3 Угольная Карбонат H 2 C 2 O 4 Щавелевая Оксолат, H 4 C 2 O 2
(CH 3 COOH) Уксусная Ацетат, HCl Хлороводородная Хлорид , HClO Хлорноватистая Гипохлорит, HClO 2 Хлористая Хлорит, HClO 3 Хлорноватая Хлорат, HClO 4 Хлорная Перхлорат, HCrO 2 Метахромистая Метахромит , HCrO 4 Хромовая Хромат, HCr 2 O 7 Двухромовая Дихромат, HI Иодоводородная Иодид, HMnO 4 Марганцевая Перманганат, H 2 MnO 4 Марганцовистая Манганат, H 2 MoO 4 Молибденовая Молибдат , HNO 2 Азотистая Нитрит, HNO 3 Азотная Нитрат , HPO 3 Метафосфорная Метафосфат, HPO 4 Ортофосфорная Ортофосфат, H 4 P 2 O 7 Двуфосфорная(Пирофосфорная) Дифосфат(Пирофосфат) , H 3 PO 3 Фосфористая Фосфит , H 3 PO 2 Фосфорноватистая Гипофосфит, H 2 S Сероводородная Сульфид, H 2 SO 3 Сернистая Сульфит, H 2 SO 4 Серная Сульфат, H 2 S 2 O 3 Тиосерная Тиосульфат ,H 2 Se Селеноводородная Селенид , H 2 SiO 3 Кремниевая Силикат, HVO 3 Ванадиевая Ванадат, H 2 WO 4 Вольфрамовая
2)Массовая доля вещества находится по формуле: w = m(в)/m(см), где w – массовая доля вещества, m(в) – масса вещества, m(см) – масса смеси. Если же вещество растворено, то формула выглядит так: w = m(в)/m(р-ра), где m(р-ра) – масса раствора. Массу раствора при необходимости тоже можно найти: m(р-ра) = m(в) + m(р-ля), где m(р-ля) – масса растворителя. При желании массовую долю можно умножить на 100%.
Источник
Дайте определение основаниям предложите классификацию по 2 признакам способ образования названий
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Дайте определение основаниям, предложите классификацию по двум признакам и способ образования названий.
Основания ― сложные вещества, состоящие из металла и одной или нескольких гидроксогрупп.
Классифицируются по растворимости в воде (растворимые (щелочи) и нерастворимые) и по кислотности (однокислотные, двухкислотные и трехкислотные) .
Название образуется со слова «гидроксид», добавляя при этом название металла в родительном падеже с указанием валентности, если она переменная.
Задание 2
Перечислите химические свойства щелочей, укажите условия протекания реакций.
1. Реагируют с кислотами (реакция нейтрализации) :
NaOH + HCl = NaCl + H2O
2. Реагируют с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
3. Реагируют с растворами солей, если образуется осадок или газ:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
4. Нерастворимые основания разлагаются при нагревании:
Cu(OH)2 ↓ = CuO + H2O
Задание 3
Сравните свойства щелочей и нерастворимых оснований.
Общее: реагируют с кислотами (реакция нейтрализации) с образованием соли и воды:
NaOH + HCl = NaCl + H2O
Cu(OH)2 + H2SO4 = CuSO4 + H2O
Различие.
Щелочи взаимодействуют:
― с кислотными оксидами:
KOH + CO2 = K2CO3 + H2O
― с растворами солей, если образуется осадок или газ:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
Нерастворимые основания термически разлагаются:
Cu(OH)2 ↓ = CuO + H2O
Задание 4
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Li ⟶ Li2O ⟶ LiOH ⟶ Li2CO3 ⟶ CO2
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + CO2 = Li2CO3 + H2O
Li2CO3 + 2HCl = 2LiCl + CO2 ↑ + H2O
Задание 5
К 120 мл воды добавили 48 г раствора гидроксида натрия с массовой долей щёлочи 25%. Найдите массовую долю щёлочи в полученном растворе.
Дано: V(H2O)=120 мл, m(р-ра)=48 г, ω(NaOH)=25%, ρ(H2O)=1 г/мл.
Найти: ωн(NaOH) -?
Решение
1 способ
1. Рассчитываем массу воды по формуле: m=ρ•V.
m(Н2О)=ρ(Н2О)•V(Н2О)=1 г/мл•120 мл=120 г. Для воды объём численно равен массе, поэтому данное действие не является обязательным.
2. Рассчитываем массу растворённого гидроксида натрия в растворе:
m( NaOH )=ω( NaOH )•m(р-ра):100%=25%•48 г:100%=12 г
3. Рассчитываем массу нового раствора:
mн(р-ра)=m(Н2О)+m(р-ра)=120 г+48 г=168 г
4. Вычисляем массовую долю гидроксида натрия в новом растворе:
ωн( NaOH )=m( NaOH ):mн(р-ра)•100%=12 г : 168 г•100%=7,1%
2 способ
1. Рассчитываем массу воды по формуле: m=ρ•V.
m(Н2О)=ρ(Н2О)•V(Н2О)=1 г/мл•120 мл=120 г. Для воды объём численно равен массе, поэтому данное действие не является обязательным.
2. Для вычисления массы гидроксида натрия в растворе, составляем пропорцию и решаем её:
в 100 г раствора содержится 25 г NaOH , а
в 48 г раствора — х г NaOH
х=m( NaOH )=25 г • 48 г : 100 г=12 г
3. Рассчитываем массу нового раствора:
mн(р-ра)=m(Н2О)+m(р-ра)=120 г+48 г=168 г
4. Для вычисления массовой доли гидроксида натрия в новом растворе, составляем пропорцию и решаем её:
в 168 г раствора содержится 12 г NaOH
в 100 г раствора — х г NaOH
х =12 г • 100 г : 168 г=7,1 г, то есть ωн( NaOH )=7,1%
Ответ: ωн( NaOH )=7,1%
Задание 6
Найдите массу осадка, выпавшего при добавлении к 160 г 2%-ного раствора сульфата меди (II) необходимого количества раствора гидроксида натрия. Какое количество вещества гидроксида натрия вступило в реакцию?
Дано: ω(CuSO4)=2%, m(раствора)=160 г
Найти: m(Cu(OH)2)-?, n(NaOH)-?
Решение
1 способ
1. Вычисляем массу сульфата меди (II) в растворе:
m( CuSO4 )=m(раствора)•ω( CuSO4 ):100%=160 г • 2% : 100%=3,2 г
2. Вычисляем количество вещества сульфата меди (II) массой 3,2 г по формуле: n=m/M, где M ― молярная масса.
Mr (CuSO4 )=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160, поэтому M( CuSO4 )=160 г/моль
n( CuSO4 )=m( CuSO4 )/M( CuSO4 )=3,2 г : 160 г/моль=0,02 моль
3. Запишем уравнению реакции:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
По уравнению реакции n(CuSO4):n(NaOH):n(Cu(OH)2)=1:2:1, поэтому
n(Cu(OH)2)=n(CuSO4)=0,02 моль
n(NaOH)=n( CuSO4 )•2=0,02 моль•2=0,04 моль
4. Вычисляем массу осадка количеством вещества 0,02 моль по формуле: m=n•M.
Mr(Cu(OH)2)=Ar(Cu)+2•Ar(O)+2•Ar(H)=64+2•16+2•1=98, поэтому M(Cu(OH)2)=98 г/моль
m( Cu(OH)2 )= n ( Cu(OH)2 )•M( Cu(OH)2 )=0,02 моль • 98 г/моль=1,96 г
2 способ
1. Вычисляем массу сульфата меди (II) в растворе:
m( CuSO4 )=m(раствора)•ω( CuSO4 ):100%=160 г • 2% : 100%=3,2 г
2. Составим химическое уравнение:
3,2 г х моль у г
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
160 г 2 моль 98 г
Над формулами соединений CuSO4, NaOH и Cu(OH) 2 записываем вычисленную массу соли (3,2 г), неизвестное количество вещества гидроксида натрия и неизвестную массу гидроксида (х моль и у г соответственно), а под формулами соединений ― количество вещества и массу соответствующего количества вещества согласно коэффициентам в химическом уравнении.
Mr (CuSO4)=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160, поэтому M(CuSO4)=160 г/моль , масса 1 моль=160 г
Mr(Cu(OH)2)=Ar(Cu)+2•Ar(O)+2•Ar(H)=64+2•16+2•1=98, поэтому M(Cu(OH)2)=98 г/моль , масса 1 моль=98 г
х=n( NaOH )=3,2 г • 2 моль : 160 г=0,04 моль
у= m ( Cu(OH)2 )=3,2 г • 98 г : 160 г=1,96 г
Ответ: m( NaOH )=1,96 г, n( Cu(OH)2 )=0,04 моль
Задание 7
Подготовьте сообщение о получении, свойствах и применении одной из едких щелочей.
Гидроксид натрия NaOH образуется в результате реакций взаимодействия натрия и оксида натрия с водой:
Na2O + H2O = 2NaOH
2Na + 2H2O = 2NaOH + H2 ↑
Гидроксид натрия NaOH едкая щелочь: разъедает кожу, ткань, бумагу и другие материалы.
Гидроксид натрия NaOH взаимодействует с кислотами (реакция нейтрализации) :
NaOH + HCl = NaCl + H2O
Взаимодействует с кислотными оксидами и солями (если образуется газ или осадок):
2NaOH + CO2 = Na2CO3 + H2O
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 ↓
NH4Cl + NaOH = NaCl + NH3 ↑ + H2O
Гидроксид натрия применяется при производстве мыла, бумаги, картона, искусственных волокон.
Источник
Дайте определение понятия «основания».
Вопросы:
1) Дайте определение понятия «основания», исходя из их состава.
2) Дайте определение понятия «основания» с точки зрения теории электролитической диссоциации.
3) На какие группы делят основания по изученным вами признакам классификации этих веществ?
4) Исходя из изученных признаков классификации оснований, дайте полную характеристику гидроксида бария Ва(ОН)2 и анилина C6H5NH2.
5) Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
6) В 200 мл воды растворили 48 г гидроксида натрия, содержащего 5% примесей. Найдите массовую долю щелочи в полученном растворе.
7) При взаимодействии 585 г 20%-го раствора хлорида аммония с необходимым количеством гидроксида кальция было получено 33,6 л аммиака (н. у.). Сколько это составляет процентов от теоретически возможного?
8) Вычислите массу анилина, который можно получить реакцией Зинина из 930 кг нитробензола, если выход анилина составляет 85% от теоретически возможного.
9) В любой домашней и автомобильной аптечке обязательно содержится пузырек или ампула с нашатырным спиртом — 10%-м раствором аммиака в воде. Сколько миллилитров газообразного аммиака (н. у.) и граммов воды содержится в одной ампуле, масса раствора нашатырного спирта в которой равна 2 г?
Источник