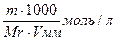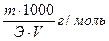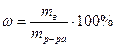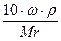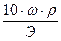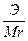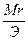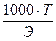Способы приготовления титрованных растворов.
Существуют три способа приготовления титрованных или стандартизированных растворов.
1. Растворением точно взвешенного количества вещества и разбавлением его до известного объёма. Для этого на аналитических весах берут точную навеску вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (Т) и объем полученного раствора (V), нетрудно вычислить его титр:
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром или первичными стандартами.
Первичные стандарты применяют в титриметрии для количественного определения тех или иных веществ и для установления концентрации стандартного (рабочего) раствора.
Однако такой метод приготовления растворов пригоден лишь тогда, когда вещество отвечает ряду требований.
Требования к первичным стандартам:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть хорошо растворимым в воде;
4) вещество должно быть устойчивым при хранении и в твердом виде или растворе;
5) оно не должно содержать гидратную воду: гигроскопическое или склонное к выветриванию вещество трудно высушить и взвесить;
6) желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Поскольку при увеличении массы относительная ошибка взвешивания уменьшается, высокая эквивалентная масса способствует уменьшению ошибок взвешивания;
7) вещество должно быстро и до конца реагировать с другими веществами. Пользуясь первичными стандартными растворами, устанавливают титр остальных веществ. К первичным стандартам
относятся, например, NaСl, Nа2СОз, Na2B407•10Н2О, K2Cr207, Н2С2О4•2Н2О, КВгОз и другие.
2. Титрованием раствора, содержащего взвешенное количество соединения, раствором реагента точной концентрации. Если
вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят раствор первичного стандарта.
Далее один из растворов оттитровывают другим и, зная концентрацию стандарта, вычисляют точную концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются вторичными стандартными растворами или
растворами с установленным титром; иногда их называют «рабочими» растворами. Процесс определения концентрации стандартного раствора титрованием первичным стандартом называется стандартизацией.
3. Для получения титрованных р-ров на практике часто пользуются «фиксаналами» или стандарт-титрами.
Методы приготовления титрованных растворов:
1) растворы с приготовленным титрантом: навеска на аналитических весах в мерной колбе,
2) с установленным титром: готовят раствор с приблизительной концентрацией, а точно устанавливают титрованием,
3) из фиксаналов: титр рабочего раствора устанавливают через каждые 1-3 недели.
Титр рабочих растворов нужно устанавливать в таких же условиях, как и проводить титрование.
5. Расчёты в титриметрическом анализе.
Методы расчёта в количественном анализе основаны на законе эквивалентов:
Все вещества реагируют между собой в эквивалентных соотношениях.
Молярная концентрация(молярность раствора) — это содержание моль вещества в одном литре раствора.
См=
См= 
0,1 м 0,1 — децимолярная
См=0,1 М 0,001 — сантимолярная
Сн (нормальность) — N =
Эсоли= 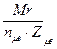
Титр — Т — количество грамм вещества в одном мл раствора:
Т = 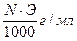
Тх/у= 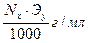
ТНСl=
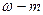
См=
N=
Cм= N
N=Cм
Т= 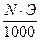
Источник
2.1.14.1. Приготовление титрованных растворов
Титриметрический анализ основан на точном измерении объема стандартного раствора реагента (титранта), израсходованного на реакцию с определяемым веществом.
Раствор титранта должен быть стандартизирован. Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, обычно не превышающей 0,1 %.
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах.
Существуют методы прямого, обратного (титрования по остатку) титрования и титрования по замещению.
При прямом титровании определяемое вещество реагирует с титрантом, и для проведения анализа этим методом достаточно одного стандартного раствора.
В методах обратного титрования используют два стандартных раствора – основной и вспомогательный. Широко известно обратное титрование хлорид-иона в кислых растворах. К анализируемому раствору хлорида сначала добавляют заведомый избыток титрованного раствора нитрата серебра (основного стандартного раствора). При этом происходит реакция образования малорастворимого хлорида серебра. Не вступившее в реакцию избыточное количество нитрата серебра оттитровывают раствором тиоцианата аммония – вспомогательного стандартного раствора. Количество хлорида легко рассчитать, так как известны количества нитрата серебра, введенного в раствор и не вступившего в реакцию с хлоридом.
В методе титрования по замещению к определяемому веществу добавляют избыток специального реагента, вступающего в реакцию с определяемым веществом. Один из продуктов взаимодействия, количество которого эквивалентно количеству определяемого вещества, оттитровывают затем стандартным раствором.
В титриметрическом (объемном) анализе основным методом является титрование. Титрованием называется процесс добавления из бюретки каплями раствора известной концентрации к раствору определяемой концентрации до достижения точки эквивалентности, которую устанавливают при помощи индикатора или прибора. Титрованные (стандартизированные) растворы – это растворы точно известной концентрации, выраженной в титрах. Титр раствора – это количество вещества в граммах, содержащееся в 1 см 3 раствора.
В зависимости от способа приготовления различают титрованные растворы приготовленные и установленные.
Приготовленные растворы. Соединения, состав которых строго соответствует химической формуле, химически чистые, устойчивые при хранении (как в твердом виде, так и в растворе) обладают большой молярной массой эквивалента. Их называют стандартными исходными веществами (первичными стандартами) для установки титра других рабочих растворов. Нужная навеска стандартного вещества (G, г) в соответствии с заданной нормальностью и объемом раствора равна
где V – объем раствора, см 3 ; N – нормальность раствора; Э – грамм-эквивалент вещества.
Навеску отвешивают на аналитических весах в весовом стаканчике (бюксе) с точностью до 0,0002 г, переносят в мерную колбу определенной вместимости, смывая навеску со стенок стаканчика и воронки небольшим количеством растворителя, растворяют (количество растворителя до 1/3 вместимости колбы), выдерживают 0,5 ч в термостате при 20 °С, а затем объем раствора доводят до метки и тщательно перемешивают. В этом случае титр раствора (Т, г/см 3 ) равен навеске (G, г), деленной на объем раствора (V, см 3 ): Т = G / V.
Чтобы перейти к нормальности N, достаточно титр раствора умножить на 1000 и разделить на грамм-эквивалент растворенного вещества (Э)
Пример. Если навеску карбоната натрия Na2СО3 массой 1,0621 г растворили в мерной колбе вместимостью 100 см 3 , то титр раствора Т = 1,0621/100 = 0,010621 г/см 3 , а нормальность раствора N = (0,010621 • 1000)/53 = 0,2004.
Титрованные растворы, полученные из точной навески вещества, называют приготовленными.
Стандартными веществами для установления титра растворов кислот служат тетраборат (Nа2В4О7 • 10Н2О) и карбонат натрия (Nа2СО3), щелочей – щавелевая (Н2С2О4 • 2Н2О) и янтарная [СО2Н(СН2)2СО2Н)] кислоты.
Растворением навески исходного вещества получают стандартный раствор для установки титра рабочих растворов.
Приготовляя титрованный раствор из навески, не стремятся получить строго определенную нормальность (или титр), а вычисляют поправку к нормальности раствора.
Пример. При приготовлении 100 см 3 0,1 н раствора, взяли навеску карбоната натрия (Na2СО3) 0,5308 г. Теоретически рассчитанная навеска в этом случае должна быть равна 0,5300 г. Тогда поправочный коэффициент будет иметь следующую величину:
к = взятая навеска / рассчитанная навеска = 0,5308 / 0,5300 – 1,00151.
Следовательно, приготовленный раствор в 1,00151 раза концентрированнее строго децинормального.
Поправочный коэффициент иначе называют фактором нормальности или просто поправкой к нормальности раствора.
Установленные растворы (вторичные стандарты). В качестве рабочих титрованных растворов чаще всего используют минеральные кислоты, щелочи, перманганат калия, тиосульфат натрия (гипосульфит). Все эти вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам (их точные растворы нельзя готовить из навески). Поэтому приблизительные количества таких веществ (навеска взвешивается на технических весах или отмеряется мерным цилиндром) растворяют в необходимом объеме воды и титруют раствором подходящего стандартного вещества (первичного стандарта). По затраченным объемам и известной концентрации исходного раствора вычисляют нормальность и титр устанавливаемого раствора. Так, нормальность раствора едкого натра устанавливают по стандартному раствору щавелевой кислоты, а нормальность соляной кислоты – по исходному раствору тетрабората натрия.
Растворы, титр которых находят не по точной навеске, а устанавливают по тому или иному стандартному веществу, называют установленными или стандартизированными.
Этот метод очень удобен, так как при нем не требуется устанавливать титр каждого рабочего раствора по исходному веществу. Любой стандартный раствор дает возможность последовательно установить титры всех необходимых рабочих растворов, однако он менее точен, так как при этом суммируются погрешности, допускаемые в процессе установки отдельных титров, и поэтому приготовление исходного титрованного раствора всегда требует особой тщательности. Чтобы уменьшить погрешности, титр рабочего титрованного раствора устанавливают, по возможности, в таких же условиях, какие будут при выполнении анализа. Для установки титра и выполнения анализа следует пользоваться одной и той же мерной посудой (предварительно прокалиброванной).
Если титрованный раствор используют при разной температуре, то следует вводить температурную поправку. Изменение температуры на 10 ºС изменяет k на 0,02.
При стандартизации растворов используют методы отдельных навесок и пипетирования.
Метод отдельных навесок. Рассчитывают навеску стандартного вещества исходя из того, что на ее титрование будет израсходовано 18. 20 см 3 титранта. На аналитических весах «методом отсыпания» отмеряют три навески. Для этого взвешивают чистый сухой бюкс с такой массой анализируемого вещества, которая достаточна для трех навесок, и записывают его массу. Затем снимают бюкс с весов и легким постукиванием указательного пальца правой руки отсыпают примерно третью часть содержимого в коническую колбу. Бюкс при этом располагают над центром горлышка колбы. После этого возвращают его в вертикальное положение и вновь взвешивают. Если навеска меньше требуемой, повторным отсыпанием добиваются, чтобы она была в указанных пределах. Навеску выше рассчитанной отбрасывают, колбу моют и навеску берут заново.
В каждую колбу приливают приблизительно по 20 см 3 дистиллированной воды, перемешивают до полного растворения стандартного вещества, вводят 1. 2 капли индикатора и титруют. По бюретке делают отсчет объема стандартизируемого раствора и записывают в журнал. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами (в %). Если расхождение не превышает 0,2. 0,3 %, то берут среднее значение из трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют ее, находят четвертый результат и снова проверяют сходимость значений молярной концентрации.
Метод пипетирования. Рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта концентрации (как правило, близкой к молярной концентрации титранта). Взвешенную на аналитических весах навеску количественно переносят в мерную колбу через воронку, смывая навеску из стаканчика струей воды из промывалки. По окончании растворения объем раствора доводят до метки и перемешивают. Аликвоту (определенную часть 1/5, 1/10 и т. д.) полученного раствора отбирают пипеткой, предварительно ополоснутой этим раствором. При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2. 0,3 %, то берут среднее значение и рассчитывают молярную концентрацию титранта. В случае большого расхождения проводят повторное титрование.
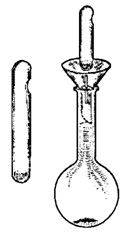
В практике технического анализа титрованные растворы приготовляют из фиксаналов или стандарт-титров. Фиксанал – это количество вещества в запаянной стеклянной ампуле, необходимое для приготовления 1 дм 3 точно 0,1 н или 0,01 н раствора. Промышленно выпускаются фиксаналы с различными рабочими веществами как в виде растворов (серная и соляная кислота, едкий натр и едкое кали), так и сухие (перманганат калия, карбонат или оксалат натрия и др.). В каждой коробочке с фиксаналами имеется стеклянный боек и стеклянная палочка.
Содержимое ампулы количественно переносят в мерную колбу вместимостью 1 дм 3 (или 0,5 дм 3 , если это указано специально) и доводят водой до метки. Для этого в горлышко колбы вставляют воронку и вкладывают стеклянный боек, о который и разбивается дно ампулы. Затем стеклянной палочкой пробивают отверстие в верхней части ампулы и дают содержимому ее полностью вытечь или высыпаться (рис. 2.12) в колбу. Через образовавшееся отверстие ампулу и воронку тщательно ополаскивают водой и доводят объем раствора в колбе до метки.
Рис. 2.12. Приготовление рабочего раствора из фиксанала
При правильном хранении рабочие титрованные растворы служат несколько месяцев, не изменяя своей концентрации. Особенно тщательной защиты от диоксида углерода воздуха требуют растворы щелочей.
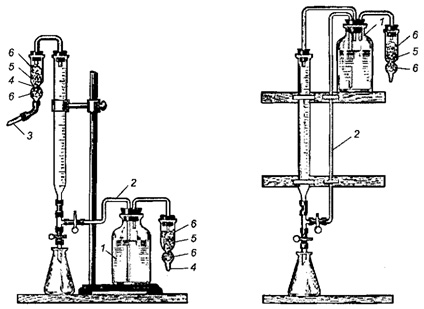
Склянки, в которых хранятся рабочие растворы, обычно соединяют с бюреткой посредством сифона (рис. 2.13). Это позволяет наполнять бюретку, не загрязняя раствор.
Рис. 2.13. Два способа соединения бюретки со склянкой, содержащей запасной раствор:
1 – склянка с запасным раствором; 2 – сифон для переливания раствора в бюретку; 3 – трубка для засасывания раствора;
4 – трубка для натронной извести; 5 – натронная известь; 6 – вата
Для определения концентрации установленных растворов приготовляют определенный объем раствора с приблизительной нормальностью, а затем по результатам титрования устанавливают точную нормальность.
Пример. Необходимо приготовить 300 см 3 приблизительно 0,2 н раствора Н2SО4 из кислоты плотностью 1,84 г/см 3 при 20 ºС и установить точную нормальность по рабочему раствору NaОН.
При полной нейтрализации серной кислоты грамм-эквивалент ее равен 98,08 : 2 = 49,04 г. Поэтому количество чистой Н2SО4 необходимое для приготовления 0,3 дм 3 приблизительно 0,2 н раствора будет 49,04 • 0,2 • 0,3 = 2,9424 г.
Серная кислота плотностью 1,84 г/см 3 имеет концентрацию 96,0 %. Легко вычислить, в каком количестве этой кислоты содержатся 2,9424 г чистой Н2SО4.
100 г 96%-ной кислоты содержат 96 г Н2SО4
х г 96 %-ной кислоты 2,9424 Н2SО4
х = (100 • 2,9424) / 96 = 3,065,
что соответствует объему кислоты 3,065/1,84 = 1,67 см 3 .
Таким образом, для приготовления 300 см 3 приблизительно 0,2 н раствора серной кислоты нужно взять 1,67 см 3 концентрированной серной кислоты (плотность 1,84 г/см 3 ).
Действительную нормальность этого раствора устанавливают по исходному веществу (Na2СО3, Na2В4О7 • 10Н2О) или по точному раствору едкого натра путем титрования. Используя уравнение N1V1 = N2V2, вычисляют нормальность растворов по результатам титрования.
Допустим, что нормальность серной кислоты устанавливали по титрованному раствору щелочи. При этом на 10 см 3 0,112 н. раствора NaОН израсходовали в среднем 10,08 см 3 кислоты. Тогда
Точность титриметрических определений. Операции титриметрического анализа выполняются с некоторыми, хотя и сравнительно небольшими, ошибками. Считают, что всякое титриметрическое определение включает в себя возможную ошибку титра рабочего раствора и возможную ошибку титрования анализируемого вещества. Первая зависит от точности взвешивания стандартного вещества и правильности измерения объема раствора. Вторая определяется точностью титрования, то есть правильностью установления точки эквивалентности с помощью индикатора: если капля рабочего раствора, прибавляемая к исследуемой жидкости, имеет слишком большой объем, то этим создается вероятность добавки не строго эквивалентного, а большего количества вещества.
Выполняя титриметрические определения, стремятся к тому, чтобы точность их достигала 0,1 %. Естественно, что для этого каждая отдельная операция анализа должна быть выполнена с не меньшей точностью.
Ошибки титриметрического анализа подразделяют на систематические и случайные. Обычно систематические ошибки очень невелики.
Пример. Пусть вблизи точки эквивалентности оставалось недотитрованным такое количество вещества, на которое необходимо израсходовать только 0,01 см 3 рабочего раствора. Но объем прибавляемой из бюретки капли равен 0,06 см 3 , и добавление ее вызвало избыток рабочего раствора на 0,06 – 0,01 = 0,05 см 3 . Если при этом на все титрование было израсходовано 25,00 см 3 рабочего раствора, то избыток в 0,05 см 3 составляет 0,2 %. Очевидно, что в рассматриваемом случае точность окончательного результата анализа уже не может стать выше 0,2%. Поэтому при выполнении титриметрических определений стремятся, чтобы объем вытекающих капель был возможно меньшим.
Когда исследуемое вещество титруют в тех же условиях, в каких устанавливался титр рабочего раствора, ошибки, допущенные при этих операциях, могут оказаться приблизительно одинаковыми, но противоположными по знаку. В таком случае систематические ошибки взаимно компенсируют друг друга.
На результат анализа могут оказать влияние и случайные ошибки. Чтобы устранить их, титриметрическое определение повторяют несколько раз и берут среднее из них. Однако, вычисляя средний результат, допускают отклонение не более 0,3 %. Результаты определений, отличающиеся на большую величину, отбрасывают при вычислении среднего арифметического.
Пример. Если в четырех определениях нормальности раствора едкого натра были получены величины 0,1134; 0,1132; 0,1142; 0,1136, то число 0,1142 отбрасывают; оно отличается от наименьшего числа 0,1134 на 0,7%. Из остальных величин берут среднее арифметическое.
Нельзя удовлетворяться недостаточно близкими результатами титрования и не следует добиваться недостижимой сходимости результатов титрования.
Титрованные растворы должны быть свежими. Титр после хранения следует проверять. Титрованные растворы, на которые действует свет (например, раствор серебра), следует хранить в темных бутылях. Титр растворов марганцевокислого калия, а также веществ, способных изменяться при контакте с воздухом или стеклом, следует устанавливать не ранее, чем через 3. 4 дня после приготовления. Титрованные растворы щелочей лучше хранить в бутылях, покрытых изнутри парафином и защищать их от действия диоксида углерода воздуха хлоркальциевой трубкой с натронной известью. Все бутыли с титрованными растворами должны иметь надпись с указанием вещества, нормальности, поправки, даты приготовления раствора и проверки титра.
Водные растворы следует готовить только на дистиллированной воде. Нельзя наливать сразу все нужное количество воды в колбу. Точный объем жидкости можно получить только при температуре, при которой была калибрована колба. Перед использованием раствора следует установить его концентрацию или поправку. Все растворы следует готовить только в хорошо вымытой посуде. Нельзя путать пробки от посуды, содержащей растворы разных веществ. Растворы щелочей следует готовить очень концентрированными, отстаивать, фильтровать, а затем разбавлять. Растворы, за исключением точных, после приготовления фильтруют.
Источник