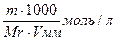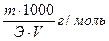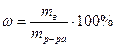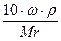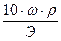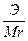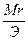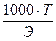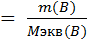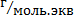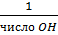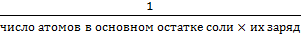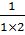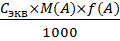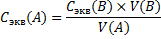Способы приготовления титрованных растворов.
Существуют три способа приготовления титрованных или стандартизированных растворов.
1. Растворением точно взвешенного количества вещества и разбавлением его до известного объёма. Для этого на аналитических весах берут точную навеску вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (Т) и объем полученного раствора (V), нетрудно вычислить его титр:
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром или первичными стандартами.
Первичные стандарты применяют в титриметрии для количественного определения тех или иных веществ и для установления концентрации стандартного (рабочего) раствора.
Однако такой метод приготовления растворов пригоден лишь тогда, когда вещество отвечает ряду требований.
Требования к первичным стандартам:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть хорошо растворимым в воде;
4) вещество должно быть устойчивым при хранении и в твердом виде или растворе;
5) оно не должно содержать гидратную воду: гигроскопическое или склонное к выветриванию вещество трудно высушить и взвесить;
6) желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Поскольку при увеличении массы относительная ошибка взвешивания уменьшается, высокая эквивалентная масса способствует уменьшению ошибок взвешивания;
7) вещество должно быстро и до конца реагировать с другими веществами. Пользуясь первичными стандартными растворами, устанавливают титр остальных веществ. К первичным стандартам
относятся, например, NaСl, Nа2СОз, Na2B407•10Н2О, K2Cr207, Н2С2О4•2Н2О, КВгОз и другие.
2. Титрованием раствора, содержащего взвешенное количество соединения, раствором реагента точной концентрации. Если
вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят раствор первичного стандарта.
Далее один из растворов оттитровывают другим и, зная концентрацию стандарта, вычисляют точную концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются вторичными стандартными растворами или
растворами с установленным титром; иногда их называют «рабочими» растворами. Процесс определения концентрации стандартного раствора титрованием первичным стандартом называется стандартизацией.
3. Для получения титрованных р-ров на практике часто пользуются «фиксаналами» или стандарт-титрами.
Методы приготовления титрованных растворов:
1) растворы с приготовленным титрантом: навеска на аналитических весах в мерной колбе,
2) с установленным титром: готовят раствор с приблизительной концентрацией, а точно устанавливают титрованием,
3) из фиксаналов: титр рабочего раствора устанавливают через каждые 1-3 недели.
Титр рабочих растворов нужно устанавливать в таких же условиях, как и проводить титрование.
5. Расчёты в титриметрическом анализе.
Методы расчёта в количественном анализе основаны на законе эквивалентов:
Все вещества реагируют между собой в эквивалентных соотношениях.
Молярная концентрация(молярность раствора) — это содержание моль вещества в одном литре раствора.
См=
См= 
0,1 м 0,1 — децимолярная
См=0,1 М 0,001 — сантимолярная
Сн (нормальность) — N =
Эсоли= 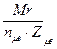
Титр — Т — количество грамм вещества в одном мл раствора:
Т = 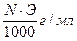
Тх/у= 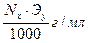
ТНСl=
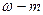
См=
N=
Cм= N
N=Cм
Т= 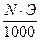
Источник
Способы приготовления растворов титрантов
Приготовление стандартных растворов:
1. Готовят из точной навески исходного, химически чистого вещества, растворяя ее в воде и разбавляя полученный раствор о требуемого в мерной колбе.
Требования, предъявляемые к установочным веществам:
— вещество должно отвечать определенной химической формуле
— химический состав вещества должен соответствовать его формуле
— вещество не должно содержать примесей, не должно поглощать углекислый газ и влагу из воздуха
— вещество должно хорошо растворяться в воде
— растворы титрантов не должны менять свою концентрацию при хранении
2. Приготовление из фиксанала. Таким способом можно приготовить стандартные растворы из любых веществ.
Фиксанал – это стеклянная, запаянная ампула, содержащая кристаллическое или жидкое вещество, изготовленное в заводских условиях. На клейме фиксанала указана точная концентрация стандартного раствора, который получится, если разбив ампулу, содержимое ее перенести количественно в мерную колбу определенного объема и довести объем полученного раствора до метки дистиллированной водой.
Приготовление стандартизованных растворов:
Их готовят из веществ, не соответствующих требованиям, предъявляемым установочным веществам:
Не точную навеску вещества растворяют в неточном объеме воды. Точную концентрацию полученного раствора устанавливают, отбирая его аликвоту мерной пипеткой и титруя ее стандартным раствором.
Способы выражения концентрации титрантов:
1. Молярная концентрация C (B) – молярность раствора – показывает, сколько молей растворенного вещества содержится в 1 дм 3 = 1л раствора.
2. Молярная концентрация эквивалентов растворенного вещества – нормальность раствора – показывает, сколько эквивалентов растворенного вещества содержится в 1 дм 3 =1л раствора.



Где 

Mэкв – молярная масса элементов,
· f(кислоты)=
· f(основания) =
· f(соли) =
f(NaCl)=1; f(Na2O7×10H2O) =
3. Титр растворенного вещества T(B) – показывает, сколько граммов растворенного вещества содержится в 1 см 3 =1мл раствора.
4. Титр титранта B по определяемому веществу А T ( 

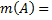

Где V(B) – объем раствора титранта в мл, пошедший на титрование
T ( 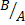
Расчет результатов объемного анализа
1. Расчет молярной концентрации эквивалентов аналита А ( Сэкв (А)) по известной молярной концентрации эквивалентов титранта Сэкв (В) и объему титранта, пошедшему на титрование V(B).
Проводят по правилу пропорциональности: Сэкв (А) × V(A) = Сэкв (В) × V(B)
Где V (A) — это объем раствора анализируемой пробы, взятой для проведения анализа
2. Расчет массы и массовой доли аналита А (m(A) и ω(A)) по известной молярной концентрации эквивалента титранта Сэкв(В) и объему титранта V(B), пошедшему на титрование в способах прямого и косвенного титрования.
Расчет основан на законе эквивалентности: «Вещества вступаю друг с другом в химические реакции в массовых соотношениях, пропорциональных их количествам эквивалентов».
Т.е. в точке эквивалентности количество эквивалентов определяемого вещества A:
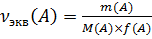

Где V(B) – объем раствора титранта, дм 3


Массовая доля ω(A):
ω(A) = 
Где a – это навеска анализируемой пробы, взятой для проведения анализа
12.10.2011
Расчет массы и массовой доли аналита в способе обратного титрования по известным молярным концентрациям эквивалентов основного титранта Сэкв (В’) и вспомогательного титранта Сэкв (В”) и их объемам, израсходованным на проведение титрования V (В’) V (В”)
В способе обратного титрования используют 2 титранта:
Первоначально к раствору анализируемой пробы одномоментно добавляют основной титрант в заведомом избытке. Он вступает в реакцию с определяемым веществом, Непрореагировавший избыток этого титранта затем медленно оттитровывают вспомогательным титрантом В”, т.е. применительно к этому способу титрования правило эквивалентов выглядит следующим образом:
Источник