- НИТРИЛЫ
- Что такое нитрильный способ
- Нитрил
- СОДЕРЖАНИЕ
- Структура и основные свойства [ править ]
- История [ править ]
- Синтез [ править ]
- Аммоксидирование [ править ]
- Гидроцианирование [ править ]
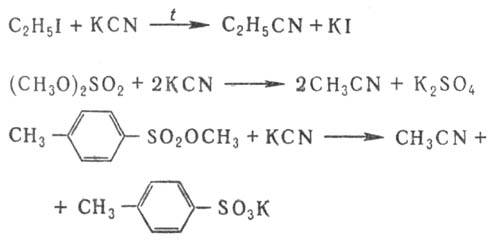
- Из органических галогенидов и цианидных солей [ править ]
- Цианогидрины [ править ]
- Дегидратация амидов и оксимов [ править ]
- Реакция Сандмейера [ править ]
- Другие методы [ править ]
- Реакции [ править ]
- Гидролиз [ править ]
- Сокращение [ править ]
- Алкилирование [ править ]
- Нуклеофилы [ править ]
- Разные методы и соединения [ править ]
- Комплексообразование [ править ]
НИТРИЛЫ
НИТРИЛЫ, орг. соед., содержащие одну или неск. циано-групп —C = N, связанных с орг. радикалом. Изомерны изонитрилам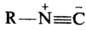
Атомы С и N в цианогруппе имеют sp-гибридизацию; длины связей, напр. для CH 3 CN, 0,1468 нм (С—С) и 0,116 нм (C = N); средняя энергия связи C = N 672 кДж/моль. Обладает отрицат. индукционным и мезо-мерным эффектами (индукц. константа Тафта s* 3,6; константы Гаммета s м 0,56; s n 0,66; s n — 1,00; s + 0,659).
Названия нитрилов обычно производят от назв. соответствующей карбоновой к-ты, напр. СН 3 СК-ацетонитрил (нитрил уксусной к-ты), КС(СН 2 ) 4 СН-адиподинитрил. Часто нитрилы рассматривают как производные синильной к-ты — цианиды (напр., СН 2 =СНСН 2 СМ-аллилцианид) или цианозамещен-ные углеводороды (напр., НС(СN) 3 -трицианометан).
Физические свойства. Нитрилы-бесцв. жидкости или твердые в-ва. Физ. свойства нек-рых важнейших нитрилов приведены в таблице.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НИТРИЛОВ
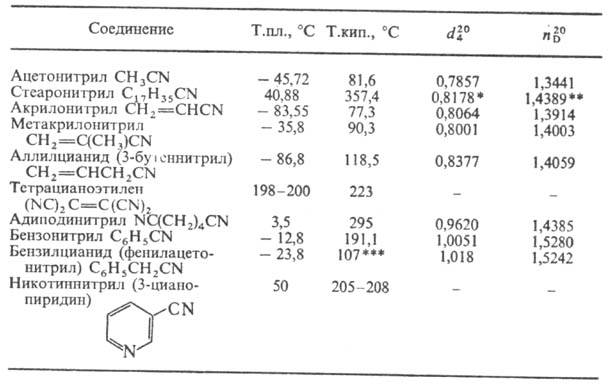
* При 41 °С. ** При 45 °С. *** При 12 мм рт.ст.
Н итрилы плохо раств. в воде (за исключением низших алифатических нитрилов), хорошо раств. во многих орг. р-рителях.
В ИК спектрах нитрилов и спектрах комбинац. рассеяния присутствует характеристич. полоса при 2220-2270 см -1 .
Химические свойства. Электронное строение нитрилов может быть представлено с помощью резонансных структур:
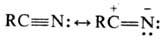
В соответствии с этим нитрилы вступают в р-ции с электрофилами (по атому N) и нуклеофилами (по атому С). Они также образуют комплексы с солями металлов (напр., CuCl, NiCl 2 , SbCl 5 и др.) с участием неподеленной пары электронов атома N. Благодаря ненасыщенности и легкой поляризу емости цианогруппа активирует связанный с ней орг. радикал, напр. облегчает диссоциацию связи С—Н у a-углерод-ного атома, а благодаря незначит. стерич. эффекту обеспечивает легкость р-ций присоединения по связи C = N.
В апротонной среде при низкой т-ре нитрилы реагируют с галогеноводородами, образуя нитрилиевые соли (ф-ла I) и соли имидоилгалогенидов(II):
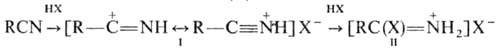
Через образование нитрилиевых солей проходит гидратация нитрилов в кислой среде до амидов и далее гидролиз до карбоновых к-т:
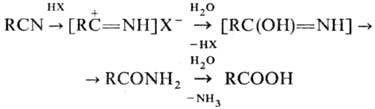
Амиды образуются также при гидратации нитрилов в щелочной среде (послед. гидролиз амидов приводит к солям соответствующих карбоновых к-т) и при действии на нитрилы Н 2 О 2 (Рад-зишевского реакция):
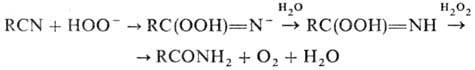
Р-ции нитрилов со спиртами в присут. кислого катализатора -метод синтеза гидрогалогенидов имидоэфиров (см. Пиннера реакции); гидролиз последних приводит к сложным эфирам:
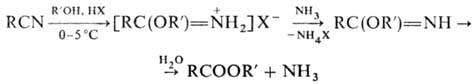
При замене спирта на тиол R’SH образуются соли тио-имидатов 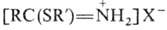
Обработка нитрилов H 2 S позволяет получать с хорошим выходом тиоамиды RC(S)NH 2 .
При нагревании нитрилов с карбоновыми к-тами R’COOH образуются имиды RCONHCOR’. Иногда имеет место миграция цианогруппы (перенитрилирование):
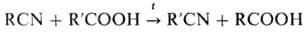
При действии галогеноводородов (НСl или НВr) на смесь нитрилов с карбоновыми к-тами получают гидрогалогениды амидов, а также ангидриды или галогенангидриды карбоновых к-т:
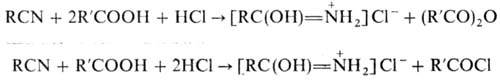
Р-ция нитрилов с аммиаком, первичными или вторичными аминами приводит к амидинам RC(NHR’)=NH, с гидроксил-амином-к амидоксимам RC(NH 2 )=NOH, с гидразоном-к амидразонам RC(NH 2 )=NNH 2 .
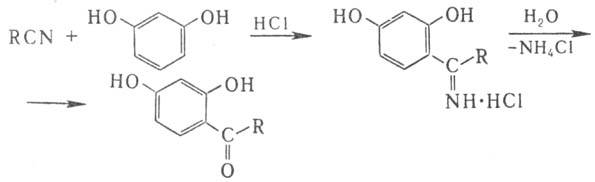
При взаимодействии нитрилов с фенолами и НСl образуются соли кетиминов, при гидролизе превращающиеся в соответствующие гидроксикетоны (Хеша реакция):
Взаимодействие нитрилов с магнийорг. соед. приводит к N-маг-нийзамещенным кетиминам, при кислотном гидролизе к-рых образуются кетоны. Если орг. радикал в молекуле нитрила обладает электроноакцепторными св-вами или пространственно затрудняет присоединение R’MgX по связи C = N, имеет место р-ция обмена:
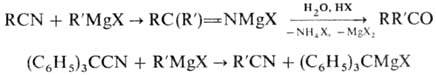
Присоединением к нитрилам РСl 5 получают фосфазосоединения (иминофосфораны). Аналогично присоединяются к нитрилам че-тырехфтористая сера, тетрафторгидразин и фторид хлора, напр.: .
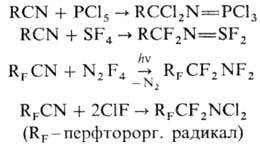
Н итрилы реагируют с олефинами и их функцией, производными (ненасыщ. к-ты, их эфиры и др.) в присут. кислотного катализатора, образуя замещенные амиды (Риттера реакция); вступают в р-цию Дильса — Альдера, напр.:
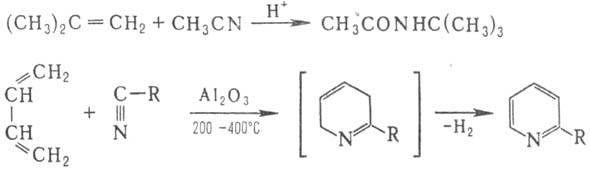
При использовании в качестве диенофила перфторалкил-цианидов R F CN или дициана р-ция циклоприсоединения идет без катализатора с количеств. выходом.
При действии на нитрилы азотистоводородной к-ты образуются тетразолы:
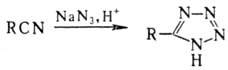
Ароматические нитрилы, а также нитрилы, содержащие в орг. радикале электроноакцепторные группы, в присут. кислотных катализаторов превращ. в сим-триазины, напр.:
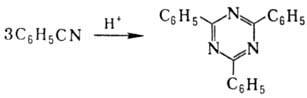
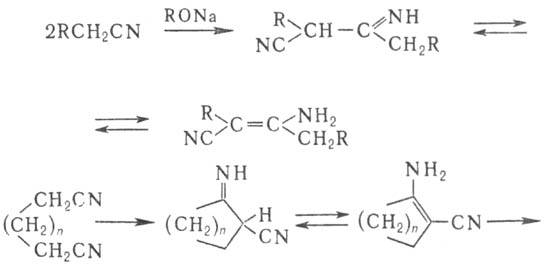
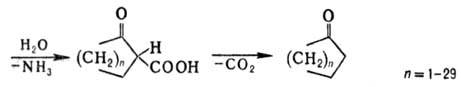
В присут. оснований нитрилы димеризуются с образованием иминонитрилов (или енаминонитрилов) (Торпа-Циглера реакция). Из динитрилов с помощью этой р-ции получают циклич. кетоны:
Одна из важнейших р-ций нитрилов-восстановление, протекающее ступенчато через промежут. образование альдиминов:
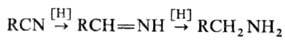
Для восстановления нитрилов до аминов наиб. часто применяют каталитич. гидрирование на Pt или Pd при давлении 0,1-0,3 МПа и 20-50 °С или на Ni или Со при 10-25 МПа и 100-200 °С. Для подавления образования вторичных и третичных аминов добавляют NH 3 . В качестве восстановителей используют также металлич. Na в этаноле, комплексные гидриды металлов и бора, напр. LiAlH 4 , NaBH 4 и др. При восстановлении нитрилов SnCl 2 в присут. НСl образуются соли альдиминов, гидролиз к-рых приводит к альдегидам (Сте-фена реакция):
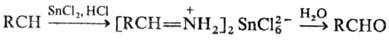
При использовании диалкилалюминийгидридов Alk 2 AlH, а также при каталитич. восстановлении нитрилов на Ni-Ренея в присут. гипофосфита натрия в водной СН 3 СООН или в смеси СН 3 СООН с пиридином можно остановить восстановление нитрилов на стадии образования альдимина. Напротив, в жестких условиях, напр. при 250-300 °С на смеси оксидов Сu и Ni, протекает гидрогенолиз нитрилов:
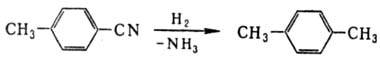
Электролитич. восстановление нитрилов на катодах с высоким перенапряжением водорода или на Ni-Ренея, удерживаемом в магн. поле, обеспечивает высокую селективность восстановления до первичных аминов с выходом более 80%.
К важнейшим р-циям нитрилов по орг. радикалу относят: взаимод. с карбонильными соед. с образованием цианооле-финов (см. Кнёвенагеля реакция), присоединение разл. нуклеофилов к а,р-ненасыщенным нитрилам, напр. к акрилонит-рилу, и полимеризацию (см. Полиакрилонитрил):
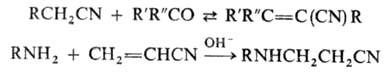
Основные методы получения. 1) Дегидратация амидов RCONH 2 , аммониевых солей карбоновых к-т RCOONH 4 или альдоксимов RCH=NOH (см. Бекмана перегруппировка)при нагр. с Р 2 О 5 , РСl 5 , РОСl 3 или SOCl 2 . В пром-сти р-цию обычно проводят в присут. катализаторов дегидратации (Н 3 РО 4 и ее соли) в атмосфере NH 3 , напр.:
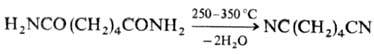
При алкилировании алкил- и аралкилгалогенидами широко применяют межфазный катализ, напр. при пром. получении бензилцианида.
Ароматические нитрилы получают взаимод. арилгалогенидов с CuCN или сплавлением солей сульфокислот с NaCN, напр.:
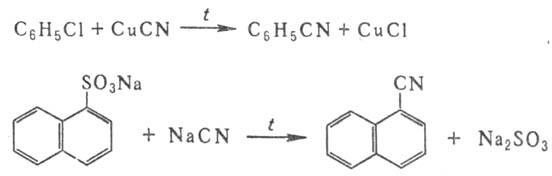
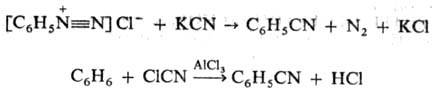
Используют также р-цию солей диазония с цианидами К или Си (см. Зандмейера реакция), взаимод. ароматич. углеводородов с хлорцианом или трихлорацетонитрилом в присут. АlСl 3 :
3) Присоединение HCN по кратным связям (используют для получения промышленно важных нитрилов), напр.:
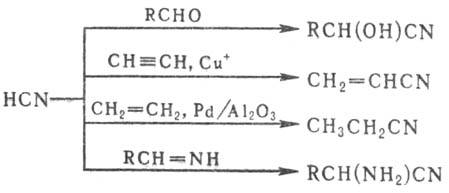
Циангидрины получают присоединением HCN к карбонильным соед. или эпоксидам в присут. оснований (см. Оксинитрилы).
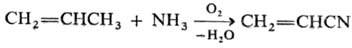
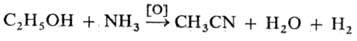
Н итрилы образуются также при действии окислителей на амины:
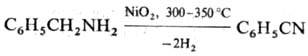
5) Теломеризация олефинов с галогеноцианидами или р-ция последних с магнийорг. соед.:
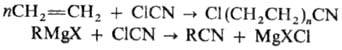
Анализ и применение. Для анализа нитрилов используют физ.-хим. методы, восстановление нитрилов на капельном ртутном электроде позволяющее определять их в концентрации до 10 -3 -10 -5 %, а также хим. методы, напр. щелочной гидролиз нитрилов с послед. количеств. определением NH 3 .
Применяют нитрилы в качестве р-рителей, инициаторов радикально-цепной полимеризации и теломеризации, сырья в произ-ве волокнообразующих полимеров и смол (см. По-лиакрилонитрильные волокна, Полиамидные волокна), пластификаторов, лек. в-в и пестицидов.
Н итрилы ядовиты и при работе требуют мер предосторожности (ср-ва индивидуальной защиты, приточно-вытяжная вентиляция). Нитрилы или их отходы уничтожают щелочным гидролизом или при действии окислителей (р-ры Н 2 О 2 или КМnО 4 ). Механизм токсич. действия нитрилов связан с их способностью нарушать ф-цию фермента цитохромоксидазы, подавляя процесс переноса кислорода из крови к клеткам организма. Отравление может произойти при вдыхании паров нитрилов, при попадании их в желудочно-кишечный тракт или через кожу. Противоядия-амилнитрит, Na 2 S 2 O 3 , глюкоза (см. Синильная кислота).
Объем произ-ва важнейших нитрилов приближается к 5 млн. т/год. См. также Акрилонитрил, Адиподинитрил, Ацетонит-рил, Бензонитрил и др.
Источник
Что такое нитрильный способ
Алифатические нитрилы получают обработкой алкилгалогенидов цианистым натрием в растворителе, способном растворять оба эти реагента; в диметилсульфоксиде при комнатной температуре реакция происходит быстро и экзотермично. Образующийся нитрил гидролизуют до кислоты кипячением с водным раствором щелочи или кислоты.
Реакция алкилгалогенидов с цианид-ионом протекает как нуклеофильное замещение (разд. 14.6). Поскольку HCN — очень слабая кислота, цианид-ион является сильным основанием; как и следовало ожидать, этот сильно основный ион может отрывать ион водорода, вызывая таким образом элиминирование наряду с замещением. Действительно, для третичных галогенидов элиминирование — главная реакция; даже в случае вторичных галогенидов выход продуктов замещения не высок. В этом случае мы также встречаемся с тем фактом, что реакция нуклеофильного замещения синтетически важна только при использовании первичных галогенидов.
Как уже отмечалось, ароматические нитрилы получают не из малореакционноспособных арилгалогенидов, а из солей диазония (разд. 24.6).
Хотя нитрилы иногда называют цианидами или цианпроизводными, их названия обычно производят от названия кислот, в которые они превращаются при гидролизе. Названия образуются путем замены окончания -овая
кислота в тривиальном названии кислоты на нитрил. Согласно номенклатуре IUPAC, название нитрилов производят от названия исходного углеводорода путем прибавления окончания нитрил, например:
Источник
Нитрил
Нитрила любое органическое соединение , которое имеет — C ≡ N функциональную группу . [1] Приставка циано — в промышленной литературе используется взаимозаменяемо с термином «нитрил». Нитрилы содержатся во многих полезных соединениях, включая метилцианоакрилат , используемый в суперклее , и нитрильный каучук , нитрилсодержащий полимер, используемый в безлатексных лабораториях и медицинских перчатках.. Нитриловый каучук также широко используется в качестве автомобильных и других уплотнений, поскольку он устойчив к воздействию топлива и масел. Органические соединения, содержащие несколько нитрильных групп, известны как цианоуглероды .
Неорганические соединения, содержащие группу -C≡N, называют не нитрилами, а цианидами . [2] Хотя и нитрилы, и цианиды могут быть производными цианидных солей, большинство нитрилов не так токсичны.
СОДЕРЖАНИЕ
Структура и основные свойства [ править ]
Геометрия N-C-C линейна в нитрилах, что отражает sp-гибридизацию трехсвязанного углерода. Расстояние C-N короткое и составляет 1,16 Å , что соответствует тройной связи. [3] Нитрилы полярны, на что указывают высокие дипольные моменты. Как жидкости, они имеют высокие относительные диэлектрические проницаемости , часто в пределах 30-х годов.
История [ править ]
Первое соединение ряда гомологов нитрилов, нитрил муравьиной кислоты , цианистый водород был впервые синтезирован К. В. Шееле в 1782 году. [4] [5] В 1811 году Дж. Л. Гей-Люссак смог получить очень токсичную и летучую чистую кислоту. . [6] Около 1832 г. бензонитрил , нитрил бензойной кислоты , был получен Фридрихом Велером и Юстусом фон Либихом , но из-за минимального выхода синтеза не были определены ни физические, ни химические свойства, ни предложенная структура. В 1834 году Теофиль-Жюль Пелуз синтезировал пропионитрил., предполагая, что это эфир пропионового спирта и синильной кислоты. [7] Синтез бензонитрила Германом Фелингом в 1844 году путем нагревания бензоата аммония был первым методом, позволившим получить достаточно вещества для химических исследований. Фелинг определил структуру, сравнивая свои результаты с уже известным синтезом цианистого водорода путем нагревания формиата аммония . Он придумал название «нитрил» для вновь обнаруженного вещества, которое и стало названием этой группы соединений. [8]
Синтез [ править ]
В промышленности основными методами производства нитрилов являются аммоксидирование и гидроцианирование . Оба пути имеют зеленый цвет в том смысле, что они не генерируют стехиометрические количества солей.
Аммоксидирование [ править ]
В аммокисления , А углеводородный частично окисляется в присутствии аммиака . Это преобразование широко практикуется для акрилонитрила : [9]
При производстве акрилонитрила побочным продуктом является ацетонитрил . В промышленном масштабе несколько производных бензонитрила , фталонитрила , а также изобутиронитрила получают аммоксидированием. Процесс катализируется оксидами металлов и, как предполагается, протекает через имин.
Гидроцианирование [ править ]
Гидроцианирование — это промышленный метод получения нитрилов из цианистого водорода и алкенов. Для этого процесса требуются гомогенные катализаторы . Примером гидроцианирования является производство адипонитрила , предшественника нейлона-6,6 из 1,3-бутадиена :
CH 2 = CH − CH = CH 2 + 2 HCN → NC (CH 2 ) 4 CN
Из органических галогенидов и цианидных солей [ править ]
Цианогидрины [ править ]
В циангидринах представляют собой особый класс нитрилов. Обычно они возникают в результате присоединения цианидов щелочных металлов к альдегидам в реакции циангидрина . Из-за полярности органического карбонила эта реакция не требует катализатора, в отличие от гидроцианирования алкенов. О-силилциангидрины образуются путем присоединения триметилсилилцианида в присутствии катализатора (силилцианирование). Цианогидрины также получают реакциями трансциангидрина, начиная, например, с ацетонциангидрином в качестве источника HCN. [10]
Дегидратация амидов и оксимов [ править ]
Нитрилы можно получить дегидратацией первичных амидов . В присутствии этилового dichlorophosphate и DBU , бензамид обращенных к бензонитрил : [11] Другие реагенты , которые являются общими используются для этой цели , включают Р 4 O 10 , и SOCl 2 .

При соответствующей дегидратации вторичные амиды дают нитрилы в результате разложения амида фон Брауна . В этом случае разрывается одна связь CN. Дегидратация альдоксимов (RCH = NOH) также дает нитрилы. Типичными реагентами для этого превращения являются триэтиламин / диоксид серы , цеолиты или сульфурилхлорид . Использование этого подхода — это однореакторный синтез нитрилов из альдегида с гидроксиламином в присутствии сульфата натрия . [12]
Реакция Сандмейера [ править ]
Ароматические нитрилы часто получают в лаборатории из анилина через диазониевые соединения . Это реакция Сандмейера . Требуются цианиды переходных металлов. [13]
ArN +
2 + CuCN → ArCN + N 2 + Cu +
Другие методы [ править ]
- Коммерческим источником цианидной группы является цианид диэтилалюминия Et 2 AlCN, который может быть получен из триэтилалюминия и HCN. [14] Он использовался в нуклеофильном добавлении к кетонам . [15] Для примера его использования см .: Kuwajima Taxol total Synthesis.
- цианид-ионы облегчают связывание дибромидов. Реакция α, α′-дибромадипиновой кислоты с цианидом натрия в этаноле дает цианоциклобутан : [16]

- Ароматические нитрилы могут быть получены путем основного гидролиза трихлорметиларилкетиминов (RC (CCl 3 ) = NH) в синтезе Губена-Фишера [18]
- Нитрилы можно получить из первичныхаминов путем окисления . Общие методы включают в себя использование персульфата калия , [19]трихлоризоциануровой кислоту , [20] или анодныйэлектросинтез . [21]
- α — Аминокислоты образуют нитрилы и диоксид углерода посредством различных способов окислительного декарбоксилирования . [22][23]Генри Дрисдейл Дакин открыл это окисление в 1916 году. [24]
Реакции [ править ]
Нитрильные группы в органических соединениях могут вступать в различные реакции в зависимости от реагентов или условий. Нитрильная группа может быть гидролизована, восстановлена или выброшена из молекулы в виде цианид-иона.
Гидролиз [ править ]
Гидролиз нитрилов RCN протекает в различном стадии под кислотой или основание лечения сначала дать карбоксамиды RC (= O) NH 2 , а затем карбоновые кислоты RCOOH. Гидролиз нитрилов до карбоновых кислот эффективен. Для кислоты или основания сбалансированные уравнения выглядят следующим образом:
RCN + 2H 2 O + HCl → RCO 2 H + NH 4 Cl RCN + H 2 O + NaOH → RCO 2 Na + NH 3
Обратите внимание, что, строго говоря, эти реакции опосредуются (в отличие от катализируемых ) кислотой или основанием, поскольку один эквивалент кислоты или основания расходуется на образование аммониевой или карбоксилатной соли соответственно.
Кинетические исследования показывают, что константа скорости второго порядка для гидролиза ацетонитрила до ацетамида, катализируемого гидроксид-ионами, составляет 1,6 × 10 -6 М -1 с -1 , что медленнее, чем гидролиз амида до карбоксилата (7,4 × 10 — 5 M −1 с −1 ). Таким образом, основной путь гидролиза даст карбоксилат (или амид, загрязненный карбоксилатом). С другой стороны, реакции, катализируемые кислотой, требуют тщательного контроля температуры и соотношения реагентов, чтобы избежать образования полимеров, чему способствует экзотермический характер гидролиза. [25] Классическая процедура превращения нитрила в соответствующий первичный амид требует добавления нитрила к холодной концентрированной серной кислоте. [26] Дальнейшему превращению в карбоновую кислоту не способствует низкая температура и низкая концентрация воды.
RCN + H 2 O → RC (O) NH 2 (H 2 SO 4 является катализатором)
Два семейства ферментов катализируют гидролиз нитрилов. Нитрилазы гидролизуют нитрилы до карбоновых кислот:
Нитрилгидратазы — это металлоферменты, которые гидролизуют нитрилы до амидов.
Эти ферменты используются в коммерческих целях для производства акриламида.
Сокращение [ править ]
Нитрилы подвержены гидрированию на различных металлических катализаторах. Реакция может дать либо первичный амин (RCH 2 NH 2 ), либо третичный амин ((RCH 2 ) 3 N), в зависимости от условий. [27] При обычном органическом восстановлении нитрил восстанавливают обработкой алюмогидридом лития до амина. Восстановление до имина с последующим гидролизом до альдегида происходит в синтезе альдегида Стивена , в котором хлорид олова используется в кислоте.
Алкилирование [ править ]
Алкилнитрилы достаточно кислые, чтобы образовывать нитрильные анионы , которые алкилируют широкий спектр электрофилов. [28] Ключом к исключительной нуклеофильности является небольшая стерическая потребность единицы CN в сочетании с ее индуктивной стабилизацией. Эти особенности делают нитрилы идеальными для создания новых углерод-углеродных связей в стерически сложных средах для использования в синтезе медицинской химии. Недавние разработки показали, что природа противоиона металла вызывает различную координацию либо с нитрильным азотом, либо с соседним нуклеофильным углеродом, часто с глубокими различиями в реакционной способности и стереохимии. [29]
Нуклеофилы [ править ]
Углеродный центр нитрила электрофильный , следовательно, он подвержен реакциям нуклеофильного присоединения :
- с цинкорганическим соединением в реакции Блейза
- со спиртами в реакции Пиннера .
- с аминами, например , реакцию аминасаркозина с цианамида урожайности креатина[30]
- Нитрилы реагируют в ацилировании Фриделя – Крафтса в реакции Губена – Хёша до кетонов
Разные методы и соединения [ править ]
- При восстановительной децианировании нитрильная группа заменяется протоном. [31] Децианирование может быть достигнуто путем растворения восстановленных металлов (например, HMPA и металлический калий в трет- бутаноле ) или плавлением нитрила в КОН . [32] Аналогичным образом α-аминонитрилы можно децианировать с помощью других восстановителей, таких как алюмогидрид лития . [31]
- Нитрилы само реагируют в присутствии основания в реакции Торпа при нуклеофильном присоединении
- В металлоорганической химии нитрилы, как известно, присоединяются к алкинам при карбоцианировании: [33]
Комплексообразование [ править ]
Нитрилы являются предшественниками нитрильных комплексов переходных металлов , которые являются реагентами и катализаторами. Примеры включают [Cu (MeCN) 4 ] + и PdCl 2 (PhCN) 2 ) . [34]
Источник









