- КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС
- Полезное
- Смотреть что такое «КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС» в других словарях:
- Квазистатический процесс
- Значение квазистатических процессов
- Виды квазистатических процессов
- Литература
- Полезное
- Смотреть что такое «Квазистатический процесс» в других словарях:
- Что такое квазистатический способ
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС
Физический энциклопедический словарь. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1983 .
в термодинамике — бесконечно медленный переход термодинамич. системы из одного равновесного состояния в другое, при к-ром термодинамич. состояние в любой момент времени бесконечно мало отличается от равновесного и его можно рассматривать как состояние равновесия термодинамического.Внутр. равновесие в системе при К. п. устанавливается значительно быстрее, чем происходит изменение внеш. физ. параметров.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Полезное
Смотреть что такое «КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС» в других словарях:
Квазистатический процесс — в термодинамике идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия. Значение квазистатических процессов Основное значение квазистатических процессов состоит в том, что данная модель значительно… … Википедия
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — в термодинамике процесс, происходящий столь медленно, что термодинамическая система в течение всего процесса остается близкой к состоянию равновесия. Термодинамика рассматривает квазистатический процесс как равновесный процесс … Большой Энциклопедический словарь
квазистатический процесс — в термодинамике, процесс, происходящий столь медленно, что термодинамическая система в течение всего процесса остаётся близкой к состоянию равновесия. Термодинамика рассматривает квазистатический процесс как равновесный процесс. * * *… … Энциклопедический словарь
квазистатический процесс — pusiausvirasis procesas statusas T sritis Energetika apibrėžtis Sistemos parametrų pokyčių vyksmas per laiko tarpus, daug ilgesnius nei sistemos relaksacijos trukmė šių parametrų atžvilgiu. atitikmenys: angl. quasi equilibrium process vok.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
квазистатический процесс — kvazistatinis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Vyksmas, kurio metu sistema nenutrūkstamai pereina per keletą pusiausvirųjų būsenų. atitikmenys: angl. quasi static process vok. quasistatischer Prozess, m rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
квазистатический процесс — kvazistatinis procesas statusas T sritis chemija apibrėžtis Procesas, kurio metu sistema nenutrūkstamai pereina per keletą pusiausvirųjų būsenų. atitikmenys: angl. quasi static process rus. квазистатический процесс … Chemijos terminų aiškinamasis žodynas
квазистатический процесс — kvazistatinis vyksmas statusas T sritis fizika atitikmenys: angl. quasi static process vok. quasistatischer Prozeß, m rus. квазистатический процесс, m pranc. processus quasi statique, m … Fizikos terminų žodynas
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — (от лат. quasi как бы, наподобие и греч. statikos останавливающий, относящийся к равновесию, status неподвижный), равновесный процесс, термодинамический процесс, при к ром система проходит через непрерывный ряд равновесных состояний (см.… … Большой энциклопедический политехнический словарь
Квазистатический процесс — равновесный процесс, бесконечно медленный переход термодинамической системы из одного равновесного состояния в другое, при котором в любой момент физическое состояние системы бесконечно мало отличается от равновесного. Равновесие в… … Большая советская энциклопедия
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — в термодинамике, процесс, происходящий столь медленно, что термодинамич. система в течение всего процесса остаётся близкой к состоянию равновесия. Термодинамика рассматривает К. п. как равновесный процесс … Естествознание. Энциклопедический словарь
Источник
Квазистатический процесс
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.
Значение квазистатических процессов
Основное значение квазистатических процессов состоит в том, что данная модель значительно упрощает исследования в области термодинамики. Такая легкость объясняется тем, что при мгновенном описании состояния системы, совершающей квазистатический процесс, требуется одинаковое количество параметров, как и для макроскопического описания равновесного состояния. Квазистатические процессы не реализуются в природе, но являются хорошей моделью для приближения процессов, протекающих достаточно медленно (для квазистатического процесса скорость изменения макроскопического параметра 




Виды квазистатических процессов
В термодинамике часто встречаются следующие квазистатические процессы:
- Изохорный процесс — процесс, происходящий при постоянном объеме;
- Изобарный процесс — процесс, происходящий при постоянном давлении;
- Изотермический процесс — процесс, в котором температура остается постоянной;
- Адиабатический процесс — процесс, который совершается без подвода или отвода тепла;
Как и все квазистатические процессы, указанные изменения можно графически изобразить непрерывными линиями, названия которых практически соответствуют названиям самих описываемых процессов — изобарой, изохорой, изотермой и адиабатой .
Литература
- Сивухин Д. В. Общий курс физики. — М .: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Квазистатический процесс» в других словарях:
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — в термодинамике процесс, происходящий столь медленно, что термодинамическая система в течение всего процесса остается близкой к состоянию равновесия. Термодинамика рассматривает квазистатический процесс как равновесный процесс … Большой Энциклопедический словарь
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — (равновесный процесс), в термодинамике бесконечно медленный переход термодинамич. системы из одного равновесного состояния в другое, при к ром в любой момент времени физ. состояние системы бесконечно мало отличается от равновесного (см.… … Физическая энциклопедия
квазистатический процесс — в термодинамике, процесс, происходящий столь медленно, что термодинамическая система в течение всего процесса остаётся близкой к состоянию равновесия. Термодинамика рассматривает квазистатический процесс как равновесный процесс. * * *… … Энциклопедический словарь
квазистатический процесс — pusiausvirasis procesas statusas T sritis Energetika apibrėžtis Sistemos parametrų pokyčių vyksmas per laiko tarpus, daug ilgesnius nei sistemos relaksacijos trukmė šių parametrų atžvilgiu. atitikmenys: angl. quasi equilibrium process vok.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
квазистатический процесс — kvazistatinis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Vyksmas, kurio metu sistema nenutrūkstamai pereina per keletą pusiausvirųjų būsenų. atitikmenys: angl. quasi static process vok. quasistatischer Prozess, m rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
квазистатический процесс — kvazistatinis procesas statusas T sritis chemija apibrėžtis Procesas, kurio metu sistema nenutrūkstamai pereina per keletą pusiausvirųjų būsenų. atitikmenys: angl. quasi static process rus. квазистатический процесс … Chemijos terminų aiškinamasis žodynas
квазистатический процесс — kvazistatinis vyksmas statusas T sritis fizika atitikmenys: angl. quasi static process vok. quasistatischer Prozeß, m rus. квазистатический процесс, m pranc. processus quasi statique, m … Fizikos terminų žodynas
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — (от лат. quasi как бы, наподобие и греч. statikos останавливающий, относящийся к равновесию, status неподвижный), равновесный процесс, термодинамический процесс, при к ром система проходит через непрерывный ряд равновесных состояний (см.… … Большой энциклопедический политехнический словарь
Квазистатический процесс — равновесный процесс, бесконечно медленный переход термодинамической системы из одного равновесного состояния в другое, при котором в любой момент физическое состояние системы бесконечно мало отличается от равновесного. Равновесие в… … Большая советская энциклопедия
КВАЗИСТАТИЧЕСКИЙ ПРОЦЕСС — в термодинамике, процесс, происходящий столь медленно, что термодинамич. система в течение всего процесса остаётся близкой к состоянию равновесия. Термодинамика рассматривает К. п. как равновесный процесс … Естествознание. Энциклопедический словарь
Источник
Что такое квазистатический способ
4.1. Квазистатические процессы
Всякое изменение в термодинамической системе, связанное с изменением хотя бы одного из её параметров состояния, называется термодинамическим процессом.
Пусть в сосуде с поршнем находится некоторая порция газа. Тогда примером термодинамического процесса может служить процесс, в котором при перемещении поршня происходит изменение объёма $$ V$$ газа в сосуде. При этом каждому значению объёма $$ V$$ в состоянии теплового равновесия будет соответствовать определённое значение давления газа $$ p$$. Следовательно, между объёмом газа и его давлением будет существовать некоторая зависимость $$ p\left(V\right)$$, которую можно представить графически, т. е. построить её график в координатах $$ p,V$$.
Каждое равновесное состояние газа изображается на таком графике соответствующей точкой, а сам график изображает изменение параметров газа, т. е. даёт графическое описание теплового процесса.
Но всякое изменение одного из параметров означает, что система вышла из состояния теплового равновесия и ей уже нельзя приписать в целом ни определённого давления, ни определённой температуры.
Например, при быстром опускании поршня (т. е. при сжатии газа) параметры состояния газа (например, давление, плотность и температура) вблизи поршня изменятся довольно существенно. В то же время вдали от поршня изменение состояния газа произойдёт несколько позже. Поэтому газ в целом имеет разные давления и температуры в различных точках, и такое состояние газа нельзя изобразить графически. Возникает естественный вопрос: каким же образом необходимо изменять параметры системы, чтобы можно было в процессе их изменения характеризовать газ тем же числом параметров и использовать уравнение состояния, справедливое, строго говоря, только для состояния теплового равновесия?
Как показывает опыт, любая система, выведенная из состояния равновесия и предоставленная самой себе, переходит по прошествии некоторого времени в состояние теплового равновесия. Процесс перехода к равновесному состоянию называется релаксацией , а время, необходимое для этого, временем релаксации. Это время и определяет скорость изменения параметров системы. Если время перехода из одного равновесного состояния в другое много больше времени релаксации, то все отклонения от равновесного состояния будут успевать исчезать и система будет проходить через ряд равновесных состояний, переходящих одно в другое. Такие процессы называются квазистатическими, потому что при этом в каждый данный момент состояние системы мало отличается от равновесного.
Таким образом, если в рассматриваемом нами примере процесс изменения объёма идёт достаточно медленно, то давление и температура газа во всем объёме успевают сравняться и принимают в каждый момент времени одинаковые по всему объёму значения. Это означает, что в таком процессе газ проходит через последовательность равновесных (почти равновесных) состояний. Так как в равновесном процессе давление $$ p$$, температура $$ T$$ и объём $$ V$$ в каждый момент времени имеют вполне определённые значения, то существуют зависимости между $$ p$$ и $$ T$$, $$ V$$ и $$ T$$, $$ p$$ и $$ V$$. Следовательно, квазистатические процессы можно изображать в виде графиков этих зависимостей, например, $$ p\left(V\right)$$ или $$ V\left(T\right)$$. Неравновесный процесс невозможно изобразить графически.
Ясно, что с помощью уравнения состояния можно изучать только квазистатические процессы. Времена релаксаций, определяющие степень медленности квазистатического процесса, для разных систем и различных тепловых процессов сильно отличаются друг от друга, и для их определения нужно проводить очень трудный и сложный дополнительный анализ. В дальнейшем рассматриваются только квазистатические процессы.
Процессы, протекающие при постоянной массе газа и неизменном значении одного из параметров состояния газа (давление, объём или температура), принято называть изопроцессами. Например, процесс, происходящий при постоянной температуре, называется изотермическим, при постоянном объёме – изохорическим (или изохорным), при постоянном давлении – изобарическим (или изобарным).
4.2. Изотермический процесс. Закон Бойля – Мариотта
В XVII веке независимо друг от друга английский физик Бойль и французский физик Мариотт экспериментально установили закон изменения объёма газа при изменении давления: для данной массы любого газа при постоянной температуре его объём обратно пропорционален давлению.
Закон носит название закона Бойля – Мариотта и обычно записывается в виде:
где значение константы определяется температурой, при которой происходит данный процесс.
График этого процесса (изотерма) в координатах $$ p$$ и $$ V$$ изобразится кривой, определяемой уравнением:
Эта кривая, как известно из математики, называется гиперболой. На рисунке $$ 1$$ изображены изотермы одной и той массы газа для двух разных температур $$
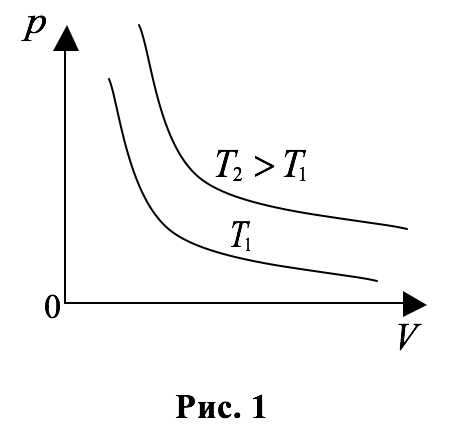 |
4.3. Изобарический процесс. Закон Гей-Люссака
Поместим газ в сосуд с вертикальными стенками и подвижным поршнем, имеющим массу $$
_<0>$$. Рассмотрим равновесное состояние газа, характеризуемое давлением $$ p$$. Величину этого давления найдём из условия механического равновесия для поршня.
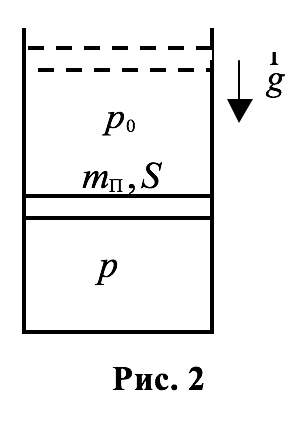 |
На поршень действуют две силы, направленные вертикально вниз (сила тяжести $$
_<0>S$$), и направленная вертикально вверх сила давления со стороны газа под поршнем, значение которой равно $$ pS$$. Условие равновесия поршня $$ -$$ равенство нулю равнодействующей этих сил. Отсюда для давления $$ p$$ газа находим:
Внешнее давление на газ также равно $$ p$$. Как показывает опыт, при квазистатическом (медленном) нагревании газа под поршнем при постоянном внешнем давлении, объём всех без исключения газов увеличивается, а при охлаждении уменьшается.
Исследуя на опыте тепловое расширение газов при постоянном давлении, французский учёный Гей-Люссак открыл, что объём $$ V$$ газа данной массы при изменении температуры $$ t\left(<>^<\circ >\mathrm
Здесь $$
4.4. Изохорический процесс. Закон Шарля
Рассмотрим теперь процесс нагревания газа при постоянном объёме, или, как говорят, процесс изохорического нагревания газа. Поместим для этого газ в герметический сосуд, например, в металлический котёл с плотно завинчивающейся крышкой. Будем нагревать газ в котле, измеряя его температуру и давление. Как показывает опыт, давление газа внутри котла увеличивается с ростом температуры.
Зависимость давления газа от температуры при неизменном объёме была экспериментально установлена французским физиком Шарлем. Согласно закону Шарля, давление $$ p$$ газа данной массы при изменении температуры $$ t\left(<>^<\circ >\mathrm
Здесь $$
_ <0>-$$ давление газа при температуре $$ 0<>^<\circ >\mathrm
4.5. Абсолютная шкала температур
Законы Гей-Люссака и Шарля выглядят гораздо проще, если вместо температурной шкалы Цельсия $$ t\left(<>^<\circ >\mathrm
Шкалу Кельвина называют абсолютной шкалой температур. На новой температурной шкале нулю градусов Цельсия соответствует температура $$
Законы Гей-Люссака и Шарля при этом примут вид:
где $$
_ <0>-$$ объём и давление газа при температуре $$
Как видно из уравнения для закона Гей-Люссака, график изобарического процесса (изобара) в координатах $$ V$$ и $$ T$$ представляет собой отрезок, лежащий на прямой линии, проходящей через начало координат. На рисунке 3 показаны две изобары при различных давлениях $$
_<1>$$ и $$
_ <2>(
_<2>>
_<1>)$$. Давление, при котором проходит процесс, можно изменять, используя поршни разной массы. Вторая изобара проходит ниже первой, так как при одной и той же температуре бóльшему давлению соответствует меньший объём.
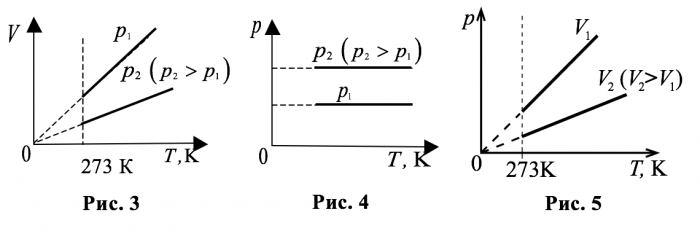 |
В координатах $$ p$$ и $$ T$$ графики изобарических процессов представляют собой прямые линии, параллельные оси $$ T$$ (рис. 4).
График изохорического процесса (изохора, закон Шарля) в координатах $$ p$$ и $$ T$$ представляет собой отрезок, лежащий на прямой линии, проходящей через начало координат. На рисунке 5 показаны две изохоры при различных объёмах $$
Источник




