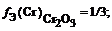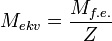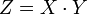Что такое эквивалент способы его вычисления
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н + или ОН – , в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию:
В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н + (кислота проявляет основность 2). Тогда по определению эквивалентом H 3 PO 4 будет являться условная частица 1/2 H 3 PO 4, т.к. если одна молекула H 3 PO 4 предоставляет два иона Н + , то один ион Н + дает половина молекулы H 3 PO 4.
С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН – , следовательно, один ион ОН – потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
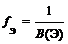
где В(Э) – валентность элемента
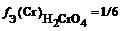
Простое вещество
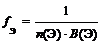
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
f Э (O3) = 1/(3 × 2) = 1/6
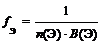
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
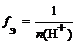
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
Основание
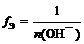
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
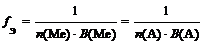
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
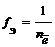
где 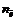
Fe 2+ + 2 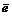
MnO4 – + 8H + + 5 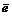
f Э ( MnO 4 – ) = 1/5
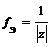
где z – заряд иона
f Э ( SO 4 2– ) = 1/2
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
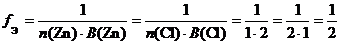
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
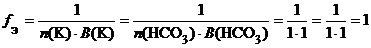
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
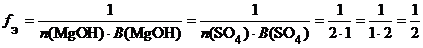
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М × f Э.
Молярная масса эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей , например:
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента ( 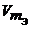
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
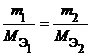
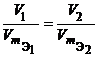
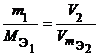
где m 1 и m 2 – массы реагентов и (или) продуктов реакции , г ;
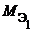
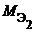
V 1, V 2 – объемы реагентов и (или) продуктов реакции , л ;
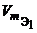
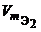
Источник
Эквивалент (химия)
Эквивалент (химия)
Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H + в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Содержание
Фактор эквивалентности
Эквивалентом является частица ½Zn(OH)2. Число ½ получило название фактора эквивалентности и может обозначаться, как «fэкв«. или «z».
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Молярная масса эквивалента вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Эквивалент — условная частица вещества, в целое число раз Z меньшее формульной единицы (Z — число эквивалентов; показывает, во сколько раз эквивалент меньше формульной единицы).
| вещество | реакция | |||
|---|---|---|---|---|
| простое ˆ | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| X | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
| Y | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
ˆ — для инертных газов Z = 1
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов: все вещества реагируют в эквивалентных отношениях. Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кисло-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Эквивалент (химия)» в других словарях:
Эквивалент(химия) — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент — – равнозначащий, равносильный продукт. Эквивалентность особенно важна при сравнении товаров и их обмене друг на друга. С этой целью применяются товарные эквиваленты, то есть товары, равноценные другим,… … Энциклопедия терминов, определений и пояснений строительных материалов
ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ — условная частица, в целое число раз меньшая (или равная) соответствующей ей формульной единицы атома, молекулы, иона, радикала и др. В одной формульной единице в ва В может содержаться z(B) Э. х. этого в ва. Число z(B) (эквивалентное число)… … Химическая энциклопедия
ХИМИЯ. РАСТВОРЫ И РАСТВОРИМОСТЬ — Благодаря неравномерному распределению электрического заряда в молекулах, т.е. наличию у них отрицательных и положительных полюсов (если говорить более строго дипольного момента), даже нейтральные в целом молекулы притягиваются друг к другу. Сила … Энциклопедия Кольера
Электрохимический эквивалент — масса вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества: где постоянная Фарадея … Википедия
химический эквивалент — – реальная или условная частица вещества x, которая эквивалентна одному иону водорода в данной кислотно основной реакции или одному электрону в данной окислительно восстановительной реакции. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Углеродный эквивалент — – условная величина содержания углерода, получаемая из набора основных химических элементов арматурной стали. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г. 110 стр.] … Энциклопедия терминов, определений и пояснений строительных материалов
Унитарная система — (У. теория, У. учение, хим.). Выражение это введено в науку Жераром, выпустившим в феврале 1848 г. книгу под заглавием: Introduction à l étude de la chimie par le système unitaire . В предисловии мы встречаем следующее пояснение выражения У.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Периодическая законность химических элементов — После открытий Лавуазье (см.) понятие о химических элементах и простых телах так укрепилось, что их изучение положено в основу всех химических представлений, а вследствие того взошло и во все естествознание. Пришлось признать, что все вещества,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЭКВИВАЛЕНТНАЯ МАССА — (химический эквивалент). Эквивалентная масса элемента это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических… … Энциклопедия Кольера
Источник