- Фиброин
- Свойства
- Структуры
- Структура белка
- Четвертичная структура белков кооперативное изменения конформации.
- Четвертичная структура белка
- Третичная и четвертичная структура белка
- Содержание
- Третичная структура белка [ править | править код ]
- Четвертичная структура белка [ править | править код ]
- Коллаген [ править | править код ]
- Биосинтез коллагена [ править | править код ]
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Фиброин может образовывать три типа структур, называемых шёлк I, II и III. Шёлк I – натуральная форма фиброина, который выделяется из шёлкоотделительных желез тутового шелкопряда и присутствует в шелке-сырце. Шёлк II — структура фиброиновых молекул в крученой шёлковой пряже, его прочность выше, и он часто используется коммерчески в различных областях. Шёлк III – недавно открытая структура фиброина, впервые замеченная профессором Региной Валуцци (Regina Valluzzi) с помощниками в Тафтском Уиниверситете. Шёлк III формируется преимущественно в растворах фиброинов на поверхности раздела (то есть границе между водой и воздухом, поверхность раздела вода-нефть и т.д.). Исследование шёлка III для лучшего понимания его физической структуры, качеств и состава продолжается.
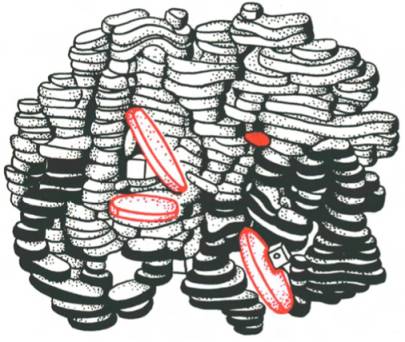
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы,ногти, рога носорогов, перья и рамфотека клюва птиц и др.
Согласно новой номенклатуре кератинов [1] , в это семейство входят также цитокератины, образующие наиболее прочные элементы внутриклеточного цитоскелета эпителиальных клеток.
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
- α-кератины имеют конформацию в виде плотных витков вокруг длинной оси молекулы (α-спираль); эти кератины являются основой волос (включая шерсть), рогов, когтей и копыт млекопитающих.
- β-кератины, более твёрдые и имеющие форму несколько зигзагообразных полипептидных цепей (т. н. β-листы); эти кератины обнаружены в когтях и чешуе рептилий, в их панцирях ( у черепах), в перьях, клювах и когтях птиц, в иглах дикобразов.
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Источник
Четвертичная структура белков кооперативное изменения конформации.
Четвертичная структура — это и количество, и способ укладки полипептидных цепей (протомеров) в пространстве. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой.Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждый протомер взаимодействует с другим во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение О2 к гемоглобину. В тканях отдача О2 также ускоряется в 300 раз. Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами (обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; аллостерические ферменты обладают свойством кооперативности: регуляция аллостерических ферментов обратима). Участвующие в аллостерической регуляции эффекторы — клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Связь между структурой белка и его функцией можно рассмотреть на примере двух родственных белков: миоглобина и гемоглобина:
Биологические функции белков. Способность к специфическим взаимодействием. Специфическая узнавания как основу биологических функций всех белков. Комплиментарный структура центра связывание белка и лиганда.
1. Пластическая, строительная функция: белки – строительный материал живого, основа любой клетки, мембраны, субклеточных частиц.
2. Регуляторная функция:
1. ферменты – биокатализаторы белковой природы, регулирующие скорость химических реакций организма;
2. гормоны белковой природы – регуляторы обмена веществ организма;
3. специфические белки регуляторы, например белки тропонинового комплекса – регуляторы мышечного сокращения.
3. Транспортная функция: белки плазмы крови транспортируют липиды крови, типичным примером белка транспортера является гемоглобин, ацилпереносящий белок и т.д.
4. Защитная функция: примерами являются иммуноглобулины, белки свертывающей системы крови, интерферон и т.д.
5. белки обеспечивают видовую и индивидуальную специфичность (например: белки групп крови)
7. Резервная (овальбулин яйца – запасной материал для развивающихся клеток)
8. энергетическая (неспецифическая функция: при распаде 1г. белка выделяется 17,1 кДж энергии)
Способность к специфическим взаимодействиям как основа биологической активности белков
В основе функционирования белка лежит его способность к взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе и другой белок. Лиганд присоединяется к определенному участку глобулярной молекулы — активному центру. Активный центр формируется в ходе образования третичной структуры белка, поэтому при денатурации белка (когда разрушается его третичная структура) белки теряют свою активность. Специфичность взаимодействия белка и лиганда объясняется комплиментарностью пространственной структуры активного центра и молекулы лиганда.
Источник
Четвертичная структура белка
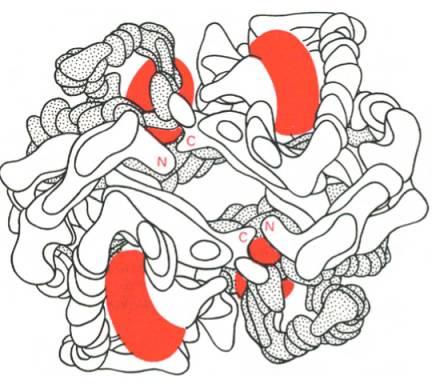
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигоме-ром (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. На рис. 1.23 представлена структура молекулы гемоглобина, а на рис. 1.24 хорошо видно, что молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет (см. главу 2).
Рис. 1.23. Олигомерная молекула гемоглобина (красные диски – группы гема).
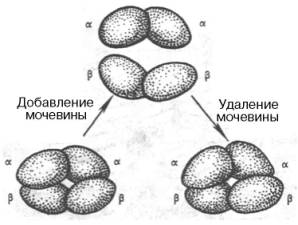
В определенных условиях (присутствие солей, 8М мочевины или резкие изменения рН) молекула гемоглобина обратимо диссоциирует на две α-и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления солей или мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина (рис. 1.25).
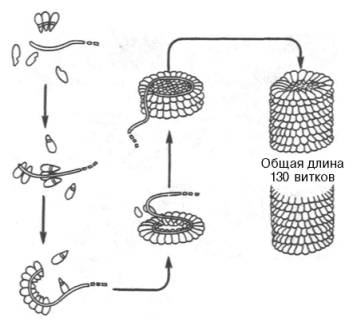
Классическим примером олигомерной молекулы, или надмолекулярной структуры, является вирус табачной мозаики, представляющий собой гигантскую молекулу с мол. м. около 40•10 6 . Он состоит из одной молекулы РНК (см. главу 3) и 2130 белковых субъединиц, масса каждой из которых составляет 17500. Длина вируса примерно 300 нм, ширина – около 17 нм. РНК вируса имеет спиралеобразную форму. Вокруг РНК нанизаны белковые частицы, образующие гигантскую надмолекулярную спиральную структуру, в которой насчитывается около 130 витков (рис. 1.26). Удивительной особенностью вируса является то, что после разъединения соответствующими приемами (добавление детергента) РНК и белковых субъединиц и последующего их смешивания (с предварительным удалением детергента) наблюдаются полная регенерация четвертичной структуры, восстановление всех физических параметров и биологических функций (инфектив-ная способность вируса). Подобная точность процесса спонтанной самосборки вируса обеспечивается, вероятнее всего, информацией, содержащейся в первичной структуре молекулы РНК и белковых субъединиц. Таким образом, последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организации белков.
Рис. 1.24. Модель гемоглобина (по Перутцу).
α-Цепи светлые; β-цепи темные; группы гема красные.
Многие ферменты также обладают четвертичной структурой, например фосфорилаза а, состоящая из двух идентичных субъединиц, в каждой из которых по две пептидные цепи. Вся молекула фосфорилазы а, таким образом, представляет собой тетрамер. Отдельные субъединицы чаще всего не обладают каталитической активностью; вообще регуляторные ферменты (см. главу 4) имеют четвертичную олигомерную структуру. Они наделены функцией обеспечения в клетке требуемых скоростей химических реакций.
Рис. 1.26. Самосборка вируса табачной мозаики.
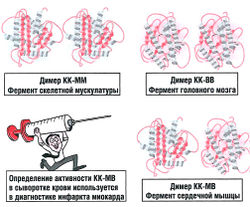
Наиболее изученным олигомерным ферментом является лактатдегидро-геназа (она катализирует обратимое превращение пировиноградной кислоты в молочную), содержащая два типа полипептидных цепей: Н – сердечный тип (от англ. heart – сердце) и М – мышечный тип (от англ. muscle – мышца) – и состоящая из 4 субъединиц. Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах. Такие ферменты получили название изоферментов, или, в соответствии с новой классификацией, множественных форм ферментов (см. главу 4).
К настоящему времени субъединичная структура обнаружена у нескольких сотен белков. Однако только для немногих белков, в том числе для молекулы гемоглобина, методом рентгеноструктурного анализа расшифрована четвертичная структура . Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности – универсальному принципу, свойственному живой природе. Структура белка после его синтеза в рибосоме может частично подвергаться модификации (посттрансляционный процессинг): например, при превращении предшественников ряда ферментов или гормонов (инсулин).
Таким образом, имеются все основания для подтверждения мнения о существовании 4 уровней структурной организации белков. Более того, каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций. Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем и соответственно сущности жизни. На этом пути научного поиска могут быть решены также многие проблемы наследственных заболеваний человека, в основе которых лежат дефекты структуры и биосинтеза белков.
Некоторые исследователи склонны рассматривать, и не без основания, существование пятого уровня структурной организации белков. Речь идет о полифункциональных макромолекулярных комплексах, или ассоциатах из разных ферментов, получивших название метаболических олигомеров, или метаболонов, и катализирующих весь путь превращений субстрата (синте-тазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Источник
Третичная и четвертичная структура белка
Содержание
Третичная структура белка [ править | править код ]
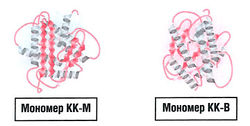
Третичная структура белка — это взаимное расположение в пространстве β-цепей, β-складчатых слоев и а-спиралей. Примеры различных способов укладки — мономеры креатинкиназы КК-М и КК-В (рис. 8.1).
Четвертичная структура белка [ править | править код ]
Многие белки состоят из нескольких полипептидных цепей, которые связаны нековалентными связями. Мономером называется один отдельный белок, состоящий из одной полипептидной цепи. Когда мы говорим о четвертичной структуре белка, это означает, что в его состав входят несколько мономеров: 2 мономера образуют димер (рис. 8.2), три — тример, четыре — тетрамер и т.д. Олигомеры состоят из большого числа мономеров.
Коллаген [ править | править код ]
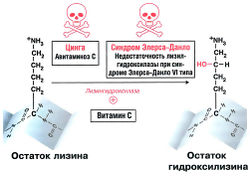
При кипячении соединительная ткань превращается в желатин, который можно использовать как клей. Отсюда и возникло название «коллаген» (по-гречески «kola» значит «клей»). На настоящий момент известно 19 разных типов коллагена. Коллагены — структурные белки соединительной ткани, самые многочисленные белки человеческого организма. Коллагены по-разному распределены в организме: так, коллаген I типа содержится главным образом в связках, сухожилиях и коже, а коллаген II типа — в хрящевой ткани. Структурные единицы коллагена — а-спирали, которые скручиваются в тройную спираль. В первичной последовательности коллагена повторяется мотив -Гли-X-Y-. В этой последовательности X обычно представлен пролином. На месте Y чаще всего находится остаток пролина, гидроксилированный в витамин С-зависимой реакции: таким образом, Y представляет собой остаток гидроксипролина. В других случаях Y может быть представлен остатком гидроксилизина (рис 8.3). Глицин — необходимый компонент коллагена. Это самая маленькая аминокислота: ее радикал R представлен лишь одним атомом водорода. Пространство в тройной спирали ограничено, и другие, более крупные, молекулы аминокислот просто не могли бы там поместиться.
Биосинтез коллагена [ править | править код ]
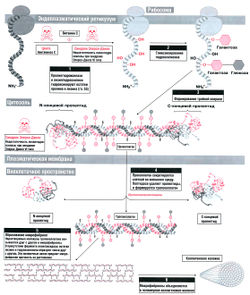
Коллаген — нерастворимый гликопротеин внеклеточного матрикса. Каким же образом фибробласты — клетки, синтезирующие коллаген, образуют нерастворимый внеклеточный белок? Все дело в том, что синтез коллагена осуществляется в 2 стадии: внутриклеточной и внеклеточной (рис. 8.4).
На внутриклеточной стадии происходит синтез проколлагена
Сначала внутриклеточный белковый аппарат синтезирует полипептидные а-спирали (длиной примерно в 1000 аминокислот). Некоторые из остатков пролина и лизина гидроксилируются в ходе реакций, для которых необходим витамин С. Некоторые остатки гидроксилизина гликозилируются. Потом а-спирали объединяются, сплетаясь друг с другом, и образуют тройную спираль проколлагена, который является растворимым белком.
На внеклеточной стадии формируются коллагеновые волокна
Проколлаген секретируется клеткой во внеклеточную жидкость. Фермент проколлагенпептидаза удаляет глобулярные пропептиды с N- и С-концевых участков молекул проколлагена, и образуется нерастворимый тропколлаген. Молекулы тропоколлагена объединяются в микрофибриллы, причем они располагаются в шахматном порядке так, что каждая молекула тропоколлагена перекрывается с соседними на четверть своей длины. Наконец, в присутствии лизиноксидазы остатки лизина и гидроксилизина реагируют друг с другом, формируя поперечные связи, что придает микрофибрилле прочность на растяжение, и микрофибриллы объединяются в одно полимерное коллагеновое волокно.
Источник