- Чем химическое явление отличается от физического
- Химический процесс или химическое явление?
- Физические процессы и явления
- В чём разница между химическими и физическими явлениями?
- Вывод
- ХИМИЧЕСКИЕ, ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- Вопрос №1 Сущность химических, физико — химических и физических методов качественного анализа. В чём отличия «сухого» метода анализа от «мокрого»?
- Характерные реакции
- Классификация анионов и групповые реагенты
Чем химическое явление отличается от физического
Не секрет, что вокруг нас постоянно происходит множество химических процессов и физических явлений, над которыми мы даже не задумываемся. Все в школе изучали физику, химию. Однако далеко не каждый может внятно ответить на вопрос: чем же отличается физическое и химическое явление? Где можно провести ту самую грань? Что в них общего? Что собой представляет пар горячего чайника, а что такое кефир? Эти вопросы мы попробуем разложить по полочкам.
Химический процесс или химическое явление?
Чтобы ответить на заглавный вопрос, нужно сначала понимать суть обоих явлений. Начнём с химических явлений.
Химические процессы представляют собой перемещение молекул и атомов, относительно одного объекта или вещества. Другими словами – разрушается первичная структура вещества объёкта или вещи, а после этого молекулы и атомы соединяются в другую структуру, образуя что-то новое. При этом образовавшееся вещество может обладать совершенно иными, отличными от первичного объекта свойствами.
Химическое явление – это совокупность химических процессов, приводящих к изменениям в атомной и молекулярной структуре вещество под воздействием разных факторов.
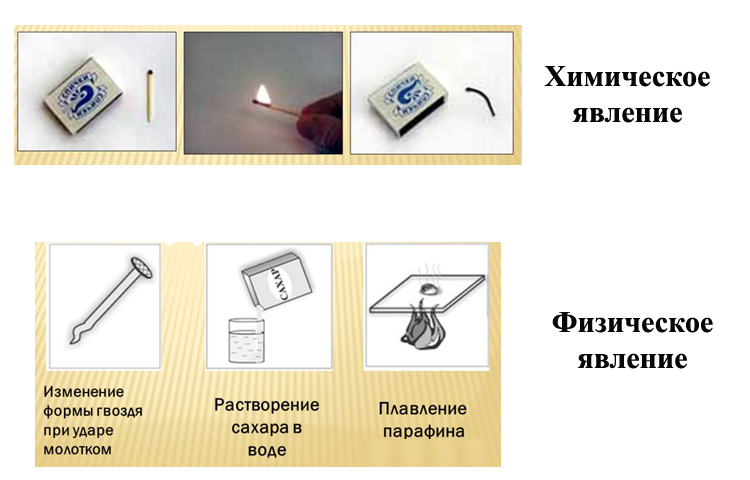
Химическое явление — горение спички
Хороший пример – скисшее молоко. Кефир обладает уже совсем иными свойствами (вкус, структура, набор микроэлементов и макроэлементов, разный состав витаминов и других веществ), притом, что получался из молока. Оно изменяет свою структуру при контакте с кислородом и повышенной температурой. Правда стоит отметить, что процесс занимает определённое время, ведь скисшее молоко сразу пить не рекомендуется – это довольно вредно для здоровья.
Физические процессы и явления
С физическими явлениями и процессами дело обстоит немного иначе. Здесь структура молекулярных соединений не меняет свою суть. Атомы находятся в тех же молекулах, что и были до действия нужных факторов. Может меняться состояние вещества (вода испарятся или замерзает), однако при восстановлении первичных условий вещество снова вернётся в своё начальное состояние с соответствующими свойствами. Нужно лишь восстановить первичные условия для вещества – лёд растопить, пар – охладить.
Изменения при физическом явлении касаются лишь агрегатного состояния вещества. Тесто приобретает во время лепки другую форму, с комка пластилина делают фигурки разных размеров: длинны, веса, объёма. Но структура пластилина, как вещества, остаётся прежней. Вот когда тесно в форме пирога помещают в духовку, то под действием высоких температур и прошествии определённого времени, оно приобретает другие свойства, становиться другим веществом со структурой, кардинально отличающейся от первичного состояния. Это уже химическое явление.
В чём разница между химическими и физическими явлениями?
Несмотря на вышесказанное, химические и физические процессы имеют также общие черты. Спорным вопросом и хорошим примером здесь есть вода. Ведь она меняет своё состояние от условий окружающей среды. Ведь при температуре выше нуля градусов по Цельсию она находится в жидком состоянии. При существенном повышении температуры – испаряется. Если температура ниже – замерзает. Однако каково состояния воды считать отправным? По сути, меняется структура молекулярных соединений, но атомы остаются на своих местах. То есть явление физическое, но с химическими признаками.
Немножко подытожим различия этих двух явлений, ответив на заглавный вопрос:
- Химические явления порождают новые вещества, физические – новые состояния.
- Химические процессы разрушают структуру молекул и заново соединяют атомы, физические процессы не меняют сути в молекулярной структуре вещества, даже преображаясь в другое состояние, молекула остаётся первичной.
- Физические явления для вещества более поверхностны, химические – более глубинны.
- Физические явления обратимы при определённых условиях, химические – в большинстве нет.
Вывод
Таким образом, мы выделили основные отличия физических явлений от химических. Следует помнить, что химические реакции протекают, связано с физическими процессами и влияниями. Поэтому эти два процесса также тесно связаны между собой. И при всех отличиях химические явления не могут происходить без физического воздействия.
Источник
ХИМИЧЕСКИЕ, ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА



ПРЕДМЕТ АНАЛИТИЧЕСКОЙ ХИМИИ
Любое вещество состоит из одного или нескольких химических элементов. Например, алмаз состоит из, углерода, вода и пероксид водорода – из водорода и кислорода, а аммиак и гидразин – из азота и водорода.
Установить состав вещества – значит определить, какие химические элементы образуют это вещество. Такая задача решается методами химического анализа. Однако эти методы дают возможность установить не только какие элементы входят в состав любого вещества, но и в каких количественных соотношениях.
Аналитическая химия – это наука о методах анализа вещества. Предметом этой науки является теория и практика анализа. Химический анализ – это получение опытным путем данных о химическом составе вещества методами, которые рекомендует аналитическая химия.
КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
В зависимости от задач и методов различают качественный и количественный анализ. Цель качественного анализа – определение; элементного или изотопного состава вещества. При анализе органических соединений находят непосредственно отдельные химические элементы, например углерод, серу, фосфор, азот или функциональные группы. При анализе неорганических соединений определяют, какие ионы, молекулы, группы атомов, химические элементы составляют анализируемое вещество.
Цель количественного анализа – установление количественного соотношения составных частей вещества. По результатам количественного анализа можно определить константы равновесия, произведения растворимости, молекулярные и атомные массы. Количественному анализу обычно предшествует качественный анализ.
ХИМИЧЕСКИЕ, ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
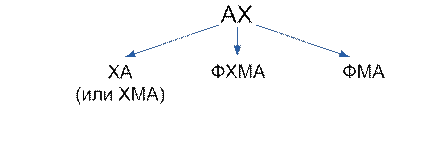
Анализ веществ проводят с помощью химических, физических или физико-химических методов. Химические методы основаны на химических реакциях. Для анализа используют только такие реакции, которые сопровождаются наглядным внешним эффектом, например изменением окраски раствора, выделением газов, выпадением или растворением осадков и т. п. Эти внешние эффекты и будут в данном случае аналитическими сигналами. Происходящие химические изменения называют аналитическими реакциями, а вещества, вызывающие эти реакции – химическими реагентами.
При анализе физическими методами не прибегают к химическим реакциям, а изучают физические свойства вещества с помощью приборов. К физическим методам относят спектральный анализ, люминесцентный, рентгеноструктурный и другие способы анализов.
С помощью физико-химических методов изучают физические явления, которые происходят при химических реакциях. Например, в колориметрическом методе измеряют интенсивность окраски в зависимости от концентрации вещества, в кондуктометрическом анализе измеряют изменение электрической проводимости растворов и т. д.
Источник
Вопрос №1 Сущность химических, физико — химических и физических методов качественного анализа. В чём отличия «сухого» метода анализа от «мокрого»?
Вопрос №1 Сущность химических, физико – химических и физических методов качественного анализа. В чём отличия «сухого» метода анализа от «мокрого»?
Методы качественного анализа делятся на химические, физико-химические и
Физические методы основаны на изучении физических свойств анализируемого
вещества. К этим методам относятся спектральный, рентгеноструктурный, масс-
спектрометрический анализы и др.
В физико-химических методах течение реакции фиксируется измерением
определенного физического свойства исследуемого раствора. К этим методам
относятся полярография, хроматография и др.
К химическим методам относятся методы, основанные на использовании
химических свойств исследуемых веществ.
В основе химических методов обнаружения и определения лежат химические реакции трех типов: кислотно-основные, окислительно-восстановительные и комплексообразования. Иногда они сопровождаются изменением агрегатного состояния компонентов. Наибольшее значение среди химических методов имеют гравиметрический и титриметрический. Эти аналитические методы называются классическими. Критериями пригодности химической реакции как основы аналитического метода в большинстве случаев являются полнота протекания и большая скорость.
Гравиметрический анализ заключается в выделении вещества в чистом виде и его взвешивании. Чаще всего такое выделение проводят осаждением. Реже определяемый компонент выделяют в виде летучего соединения (методы отгонки). В ряде случаев гравиметрия — лучший способ решения аналитической задачи. Это абсолютный (эталонный) метод. Недостатком гравиметрический методов является длительность определения, особенно при серийных анализах большого числа проб, а так же неселективность — реагенты-осадители за небольшим исключением редко бывают специфичны. Поэтому часто необходимы предварительные разделения. Аналитическим сигналов в гравиметрии является масса.
Титриметрическим методом количественного химического анализа называют метод, основанный на измерении количества реагента В, затраченного на реакцию с определяемым компонентом А. Практически удобнее всего прибавлять реагент в виде его раствора точно известной концентрации. В таком варианте титрованием называют процесс непрерывного добавления контролируемого количества раствора реагента точно известной концентрации (титрана) к раствору определяемого компонента.
В титриметрии используют три способа титрования: прямое, обратное и титрование заместителя.
Прямое титрование — это титрование раствора определяемого вещества А непосредственно раствором титрана В. Его применяют в том случае, если реакция между А и В протекает быстро.
Обратное титрование заключается в добавлении к определяемому веществу А избытка точно известного количества стандартного раствора В и после завершения реакции между ними, титровании оставшегося количества В раствором титрана В’. Этот способ применяют в тех случаях, когда реакция между А и В протекает недостаточно быстро, либо нет подходящего индикатора для фиксирования точки эквивалентности реакции.
Титрование по заместителю заключается в титровании титрантом В не определяемого количества вещества А, а эквивалентного ему количества заместителя А’, получающегося в результате предварительно проведенной реакции между определяемым веществом А и каким-либо реагентом. Такой способ титрования применяют обычно в тех случаях, когда невозможно провести прямое титрование.
Кинетические методы основаны на использовании зависимости скорости химической реакции от концентрации реагирующих веществ, а в случае каталитических реакций и от концентрации катализатора. Аналитическим сигналом в кинетических методах является скорость процесса или пропорциональная ей величина.
Реакция, положенная в основу кинетического метода, называется индикаторной. Вещество, по изменению концентрации которого судят о скорости индикаторного процесса, — индикаторным.
Среди современных методов химического анализа важное место занимают биохимические методы.
К биохимическим методам относят методы, основанные на использовании процессов, происходящих с участием биологических компонентов (ферментов, антител и т. п.).
Аналитическим сигналом при этом чаще всего являются либо начальная скорость процесса, либо конечная концентрация одного из продуктов реакции, определяемая любым инструментальным методом.
Ферментативные методы основаны на использовании реакций, катализируемых ферментами — биологическими катализаторами, отличающимися высокой активностью и избирательностью действия.
Иммунохимические методы анализа основаны на специфическом связывании определяемого соединения — антигена соответствующими антителами. Иммунохимическая реакция в растворе между антителами и антигенами — сложный процесс, протекающий в несколько стадий
Реакции, позволяющие получить внешний эффект с определяемым веществом, называют аналитическими, а добавляемое для этого вещество — реагентом. Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах — «мокрым путем».
К реакциям «сухим путем» относятся реакции, выполняемые путем растирания твердого исследуемого вещества с твердым реагентом, а также путем получения окрашенных стекол (перлов) при сплавлении некоторых элементов с бурой.
Значительно чаще анализ проводят «мокрым путем», для чего анализируемое вещество переводят в раствор. Реакции с растворами могут выполняться пробирочным, капельным и микрокристалли-ческим методами. При пробирочном полумикроанализе его выполняют в пробирках вместимостью 2-5см3. Для отделения осадков используют центрифугирование, а выпаривание ведут в фарфоровых чашечках или тиглях. Капельный анализ (, 1920 г.) осуществляют на фарфоровых пластинках или полосках фильтрованной бумаги, получая цветные реакции при добавлении к одной капле раствора вещества одной капли раствора реактива. Микрокристаллический анализ основан на обнаружении компонентов с помощью реакций, в результате которых образуются соединения с характерным цветом и формой кристаллов, наблюдаемых в микроскоп.
Вопрос №2 Амфотерные соединения. Приведите примеры амфотерных соединений. Составьте уравнение реакции, подтверждающие амфотерные свойства Zn(OH)2
Амфотемрность (от др.-греч. бмцЯт — «оба») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осномвные свойства. Например, вода образует при диссоциации ионы Н+ и ОН− (Н2О ⇄ Н+ + ОН−). Амфотерны гидроксиды: гидроксид алюминия Аl(ОН)3, гидроксид хрома(III) Сr(ОН)3, гидроксид цинка Zn(OH)2 и др. При растворении они диссоциируют в зависимости от условий, с образованием ионов Н+ или ОН−, например:
Сr(ОН)3 ⇄ Сr3+ + ЗОН− (проявление осномвных свойств)
Сr(ОН)3 ⇄ H+ + CrO2− + Н2О (проявление кислотных свойств).
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осномвные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II, III, IV.
Характерные реакции
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H2SO4 → ZnSO4 + H2O
Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например:
ZnO + 2NaOH → Na2ZnO2 + H2O Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве.
- При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше). При реакции с щёлочью в растворе образуется комплексная соль.
Al2O3 + 2NaOH → 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоаллюминат натрия)
Для каждого амфотерного металла есть свое координационное число. Для Be и Zn — это 4; Для и Al — это 4 или 6; Для и Cr — это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Амфотемрные гидроксимды — химические вещества, которые в кислой среде ведут себя как основания, а в щелочной — как кислоты.
В пределах каждого периода элементы со свойствами металлов сменяются элементами, которые проявляют свойства как металлов, так и неметаллов. Соединения этих элементов называются амфотерными. Элемент алюминий проявляет в соединениях свойства металла и неметалла. Подобные свойства имеют элементы А-групп — Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп — Cr, Mn, Fe, Zn, Cd и другие. Практически все они нерастворимы в воде, являются слабыми электролитами.
При нагревании соединения разлагаются. В большинстве случаев при взаимодействии гидроокиси металла 
Гидроксид цинка проявляет основные свойства, взаимодействуя с кислотами, например:
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O.
Кислотные свойства подтверждаются реакцией растворения гидроксида цинка в растворе щелочи, например:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4].
Вопрос №3 Классификация анионов. Действие групповых реактивов. Значение анионов в химико-технологическом контроле пищевых продуктов.
Классификация анионов и групповые реагенты
К ак известно из курса неорганической химии, к анионам относятся отрицательно заряженные частицы, состоящие из отдельных» атомов или групп атомов различных элементов. Эти частицы могут нести один или несколько отрицательных зарядов. В отличие от катионов, которые в большинстве своем состоят из одного атома, анионы могут иметь сложный состав, состоящий из нескольких атомов. Общепринятой классификации анионов не существует. Разными авторами предложены различные системы классификации их. В настоящем руководстве принята наиболее часто применяемая классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости их бариевых и серебряных селей. В данном случае групповыми реагентами являются растворимые соли бария и серебра (табл. 1).
Источник