CH3COONa + NaOH = ? уравнение реакции
Закончите уравнение реакции CH3COONa + NaOH = ? Расставьте стехиометрические коэффициенты. Запишите молекулярное уравнение реакции. Охарактеризуйте полученное соединение: приведите его основные физические и химические свойства. Укажите основные способы его получения.
В результате сплавления средней соли ацетата натрия с гидроксидом натрия (CH3COONa + NaOH = ?) происходит образование газа метана и карбоната натрия. Молекулярное уравнение реакции имеет вид:
Метан – простейший представитель класса предельных углеводородов. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Смесь его с воздухом крайне взрывоопасна (особенно в соотношении 1:10).
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Синтетические способы получения метана показывают взаимосвязь неорганических веществ с органическими. Можно выделить промышленные (1, 2) и лабораторные (3) способы его получения:
Источник
Способы получения алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
| Например, хлорметан реагирует с натрием с образованием этана:
Хлорэтан взаимодействует с натрием с образованием бутана: Реакция больше подходит для получения симметричных алканов. При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
|









 -связями.
-связями. 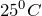 и атмосферном давлении) первые четыре члена гомологического ряда алканов (
и атмосферном давлении) первые четыре члена гомологического ряда алканов (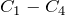 ) – газы. Нормальные алканы от пентана до гептадекана (
) – газы. Нормальные алканы от пентана до гептадекана (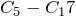 ) – жидкости, начиная с
) – жидкости, начиная с 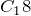 и выше – твердые вещества. По мере увеличения относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
и выше – твердые вещества. По мере увеличения относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. 


