- Получение бензола
- Способы получения бензола
- Химические свойства бензола
- Как определить бензол
- Физические свойства бензола
- Опасность бензола
- Бензол: рассказываем по полочкам
- Что такое бензол
- Физические свойства
- Получение бензола
- Химические свойства
- Реакции окисления
- Влияние бензола на организм человека
- Структура
- Бензол как наркотик
- Производство
- Экология
Получение бензола
Бензолом называется жидкость, не имеющая цвета с ярко выраженным сладковатым запахом. Бензол является органическим химическим соединением, а также простейшим ароматическим углеводородом. Автором знаменитой формулы бензольного кольца является нобелевский лауреат в области химии Лайнус Полинг. Идея изображать бензол в виде шестигранника, внутри которого расположена окружность, принадлежит именно ему. Благодаря данному изображению становится понятно отсутствие двойных связей и наличие единого электронного облака, которое охватывается все 6 атомов углерода. Формула бензола — С6Н6.
Еще в 1651 году в книге немецкого химика Иоганна Глаубера были описаны бензолсодержащие смеси, которые образуются в конечном результате процесса перегонки каменноугольной смолы. Данное описание можно считать в истории бензола первым. Однако, как самостоятельное вещество, бензол описал Майкл Фарадей, которому удалось выделить бензол из конденсата светильного газа, которые образуется путем коксования угля. Данное событие произошло в 1825 году. Спустя восемь лет бензол был получен в процессе сухой перегонки кальциевой соли бензойной кислоты. Получение бензола таким способом приписывается немецкому физико-химику Эйльгарду Мичерлиху. Именно его получение в результате дало веществу то название, которое всем известно сегодня, — вещество было названо бензолом.
Присутствует в бензине, нашел свое широкое использование во многих промышленных отраслях, а также медицине, при производстве разнообразных пластмасс, синтетической резины, красителей и многого другого. Несмотря на то, что бензол присутствует в составе сырой нефти, для его получения используются другие нефтяные компоненты.
Способы получения бензола
Для производства бензола могут использоваться как естественные, так и искусственные источники. К естественным источникам бензола относится всем известный и широко применяемый каменный уголь. Еще в начале ХІХ века Майкл Фарадей открыл процесс коксования каменного угля. Он занимался изучением светильного газа, которым в те далекие время активно пользовались для освещения улиц. Однако, он Майкл Фарадей также смог выделить и описать бензол. В настоящее время получение бензола из каменноугольной смолы, практически, ушло в прошлое и максимальное количество бензола, полученного таким способом, сегодня составляет всего 10%. Это связано с несколькими причинами, среди которых стоит отметить, что данный способ не является продуктивным, и ему на смену пришли более новые способы получения бензола. А, кроме этого, бензол из каменноугольной смолы имеет существенное количество тиофена в своем составе, в результате чего его невозможно использовать во многих технологичных процесса, он просто для них является не пригодным.
К искусственным источникам получения бензола можно отнести следующие:
- каталитический риформинг (аромаизинг) бензиновых фракций нефти. Стоит отметить, что данным способом получают порядка 40 – 60% от всего общего количества бензола, таким образом, он является главным источником производства данного вещества на территории США, а также Западной Европы, России и Японии. Однако, в результате описанного процесса, кроме бензола, также выделяются толуол и ксилолы. Первый образуется в достаточно больших количествах, существенно превышающих на него спрос, в связи с чем он также подвергается дальнейшей переработке, в результате чего из него получают бензол (путем гидродеалкилирования) и смесь бензола и ксилолов (путем диспропорционирования).
- пиролиз, которому подвергаются бензиновые и более тяжелые нефтяные фракции. Данный способ получения используется для производства практически 50% бензола во всем мире. В результате данного способа также наряду с бензолом образуются толуол и ксилолы. При некоторых обстоятельствах данная фракция подвергается деалкилированию, в результате чего толуол и ксилолы также становятся бензолом.
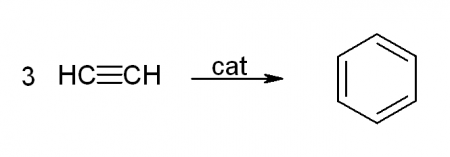
- тримеризация ацетилена. Для этого ацетилен при температуре, равной 400 0 С, пропускают над активированным углем, в результате чего получается бензол наряду с другими ароматическими углеводородами: 3С2Н2 = С6Н6. Производство бензола подобным образом связано с именем Марселена Бертло. Он начал свою работу еще в середине ХІХ века. Но в результате метода Бертло, который осуществлялся в условиях высокого температурного режима, на выходе происходило не только образование бензола, а получалась сложная смесь компонентов. И только спустя почти целое столетие, в 1948 году Реппе нашел необходимый катализатор, используемый для понижения температуры реакции, которым являлся никель.
Химические свойства бензола
Данное вещество характеризуется реакциями замещения. Следует перечислить то, с чем реагирует бензол. К таким веществам относятся алкены, хлоралкены, галогены, азотная кислота и серная кислота. Бензольное кольцо разрывается при реакции, протекающей в достаточно жестких условиях, учитывая температуру и давление.
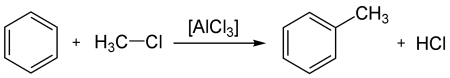
В результате алкилирования происходит образование гомологов бензола, например, этилбензол и кумол.При взаимодействии с хлором и бромом с присутствием катализатора образуется хлорбензол. Данная реакция является реакцией электрофильного замещения. Если катализаторы отсутствуют, но при этом происходит нагревание или освещение, то осуществляется радикальная реакция присоединения, в результате чего образуется смесь изомеров гексахлорциклогексана. Когда бензол взаимодействует с бромом в растворе олеума, то происходит образование гексабромбензола. При взаимодействии с галогенопроизводными алканов (реакция Фриделя – Крафтса), образуются алкилбензолы. Ароматические и жирноароматические кетоны образуются в результате реакции ацилирования по Фриделю – Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот.
Бензол взаимодействует со смесью СО и НСl осуществляется в условиях высокого давления с присутствием катализатора. В результате данной реакции образуется бензальдегид. Кроме этого, бензол восстанавливается водородом.
Бензол обладает своим специфическим строением, которое делает его достаточно устойчивым к окислению. Он не подвергается воздействию на него, например, раствора перманганата калия. Но окисление до малеинового ангидрида можно осуществить с помощью катализатора оксида ванадия. Предельным случаем окисления является горение бензола. Он легко воспламеняется и горит на воздухе сильно коптящим пламенем.
Как определить бензол
В настоящее время существует множество методов анализа бензола. Однако, для определения чистого бензола в техническому продукте, сначала определяют присутствующие примеси. Выделяют физические и химические методы анализа. Чистый бензол можно определить по температуре плавления образца. Поскольку чистый бензол имеет температуру плавления 5,5 0 С, то наличие примесей снижает данный показатель. Также бензол можно определить весовым способом. В основе данного метода лежит взаимодействие бензола с цианидом никеля в присутствии аммиака. В результате реакции образуется комплексное соединение состава, которое можно выделить и взвесить. Также осадок, образующийся в процессе реакции и имеющий светло-сиреневый окрас, также свидетельствует о наличие бензола. В основе фотометрического метода лежит способность бензола образовывать окраску в ацетоне при наличие щелочей.
Физические свойства бензола
Бензол не имеет цвета. Обладает ярко выраженным резким запахом. Плавится при температуре 5,5 0 С, закипает при 80,1 0 С. Обладает плотностью, равной 0,879 г/см 3 . Молярная масса бензола составляет 78,11 г/моль. Как и ненасыщенные водороды, горение бензола сопровождается пламенем, которое сильно коптит. В результате взаимодействия с воздухом образуются взрывоопасные смеси. Хорошо смешивается с эфиром, бензином, а также другими органическими растворителями, при взаимодействии с водой образуется азеотропная смесь, которая закипает при температуре, равной 69,25 0 С (91% бензола). Растворимость в воде 1,79 г/л в условии температуры 25 0 С.
Опасность бензола
Бензол – это наиболее распространенный ксенобиотик антропогенного происхождения. Является очень ядовитым веществом. По ГОСТу 12.1.005-88 бензол имеет второй класс опасности, к которому относятся высокоопасные вещества. Для летального исхода человеку достаточно принять перорально всего лишь 15 мл бензола. Однако, если вдыхать непродолжительное время пары бензола, то немедленное отравление не наступает. В связи с этим, очень долго не регламентировался порядок работ с бензолом. При длительном контакте с парами бензола возникает тошнота, головокружение, а при тяжелых отравлениях наступает смерть. Зачастую одним из первых признаков отравления бензолом выступает эйфория. Пары бензола способны также проникать через кожу. Жидкий бензол при попадании на кожу вызывает сильное раздражение. Также серьезные последствия для человеческого организма вызывает длительный контакт с малыми количествами бензола. Представляет собой сильный канцероген. В результате многократных исследований, было выяснено и доказано, что бензол способен вызывать следующие заболевания человека: апластическая анемия, острые лейкозы, хронический миелоидный лейкоз, миелодиспластический синдром, заболевания костного мозга.
Бензол имеет одурманивающий эффект, в результате чего может вызывать наркотическую зависимость.
При отравлении бензолом в больших количествах вызывает мгновенную потерю сознания, смерть наступает в течение нескольких минут. При этом у пострадавшего человека наблюдается синюшний окрас лица наряду с вишнево-красными слизистыми оболочками. При отравлении в более малых концентрациях наступает возбуждение, схожее с алкогольным, после чего потерпевший ощущает сонливость, слабость, может кружиться голова, присутствует тошнота, рвота, головная боль. Потеря сознания также не исключена. Зрачки расширяются и не реагируют на свет. Температура тела резко падает. Пульс становится частым, малого наполнения. Кровяное давление снижается.
В случае тяжелых отравлений, после которых пострадавшего удалось спасти, наблюдаются длительные расстройства здоровья, заключающиеся в плевритах, катаре верхних дыхательных путей, заболевании роговицы и сетчатки, поражении печени, сердечных расстройствах и т.д.
Также следует отметить, что существует так называемое хроническое отравление бензолом. При этом наблюдаются следующие симптомы: головная боль, сильная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, рвота, снижение аппетита, кровоточивость десен и других слизистых оболочек и т.д. Также может наблюдаться кровь в испражнениях, кровоизлияния в сетчатку. Именно наличие кровотечения наряду с лихорадкой приводят к госпитализации отравленных. Известны также случаи смертей в результате вторичных инфекций.
Также тяжелые отравления бензолом приводят к нервных расстройствам и заболеваниям, среди которых присутствуют повышенные сухожильные рефлексы, положительным симптом Бабинского, псевдотабетические расстройства с парестезиями, атаксией, параплегией, а также двигательными нарушениями.
Первая медицинская помощь при отравлении бензолом или его парами заключается в том, чтобы обеспечить пострадавшему доступ свежего воздуха (вынести на улицу из помещения, открыть окна, освободить грудную клетку от тесной одежды), в случае отсутствия дыхания необходимо произвести искусственную вентиляцию легких, для стимуляции дыхания используют кислород и лобелин. Адреналин при отравлении бензолом категорически запрещено применять. Если у пострадавшего рвота, то вводится внутривенно 40% раствор глюкозы. В случае употребления бензола внутрь, следует осуществить промывание желудка, применяя растительное масло, который хорошо абсорбирует бензол. Однако, следует данную процедуру проводить с осторожностью, так как существует риск аспирации.
Источник
Бензол: рассказываем по полочкам
Без существования органических веществ не стал бы возможен скоростной режим современной жизни. Бензин, пластмассы, красители, лекарства, синтетическая резина — это составные части нашей действительности. Многие из них содержат бензол — бесцветную летучую жидкость, которая обладает токсичным, канцерогенным действием.
Давайте подробно узнаем, что такое бензол, какие у него физические и химические свойства, где применяется, как действует на организм человека. А также о симптомах острого и хронического отравления этим веществом, оказанию первой помощи, проводимом лечении при интоксикации, возможных её последствиях и о мерах профилактики.
Что такое бензол
Это органическое вещество, прозрачная жидкость со сладковатым запахом. По химической структуре относится к простейшим ароматическим углеводородам.
Основные естественные источники бензола в природе — каменный уголь и нефть. В лабораторных условиях возможна его полимеризация (образование) из ацетилена. Промышленные способы получения бензола — коксование из каменного угля, а также каталитический риформинг и пиролиз бензиновых фракций нефти.
Химическая формула бензола — C6H6. Это циклическая структура из шести атомов углерода была открыта в 1865 году немецким химиком Фридрихом Августом Кекуле. А впервые в чистом виде бензол был обнаружен ещё раньше — в 1825 г. английский физик Фарадей выделил его светильного газа.
Физические свойства бензола включают плохую растворимость в воде, смешиваемость с органическими растворителями, высокую степень воспламеняемости, горючесть, взрывоопасность. Его расплавление происходит при температуре 5,5–6,0 °C, испарение при 79,6–80,5 °C, кипение — 80,1 °C. Он легче воды, так как имеет низкую относительную плотность (0,88 г/см3). Является легкорастворимым в эфире и спирте веществом.
Химические свойства бензола обусловлены его принадлежностью к группе ненасыщенных углеводородов с циклической структурой. Поэтому ему типичны реакции окисления и замещения. Методика промышленной разработки была предложена немецким учёным Гофманом, выделившим вещество из каменноугольной смолы.
Бензол сильно ядовит. Токсическое действие происходит:
- ингаляционно — при вдыхании паров;
- трансдермально — при непосредственном контакте с кожей или слизистыми оболочками;
- перорально — при ошибочном употреблении жидкости внутрь.
Многие интересные факты о бензоле, связанные с изучением его структуры и свойств, сохранились и дошли до наших дней. Так, немецкий учёный Гофман, читая лекции студентам о физических свойствах углеводородов, всегда цитировал слова знакомой ему дамы, что запах бензола такой же, как у стираных перчаток. А идея кольцевой структуры бензола якобы пришла к химику Кекуле во сне — змея, состоящая из шести атомов углерода, свернулась в кольцо и укусила себя за хвост.
Что такое бензол — видеоурок
Физические свойства
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Получение бензола
К основным способам получения бензола относятся:
— дегидроциклизация гексана (катализаторы – Pt, Cr3O2)
CH3 –(CH2)4-CH3 → C6H6 + 4H2 (toC, p, kat = Cr2O3);
C6H12 → C6H6 + 3H2 (toC, kat = Pt, Ni);
— тримеризация ацетилена (реакция протекает при нагревании до 600oС, катализатор – активированный уголь)
3HC≡CH → C6H6 (t = 600oC, kat = Сactiv).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
C6H6 + H2C = CH2 →AlCl3∗HCl C6H5CH2CH3C6H6 + CH2 = CH − CH3 →AlCl3 ∗ HCl C6H5CH(CH3)2
- Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
C6H6 + Cl2 →FeCl3 C6H5Cl + HCl
- В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
C6H6 + 3Cl2 →T,hν C6H6Cl6
- При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
C6H6 + 6Br2 →H2SO4 ∗ SO3 C6Br6 + 6HBr
- Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
- Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
C6H6 + (CH3CO)2O →AlCl3 C6H5COCH3 + CH3COOH 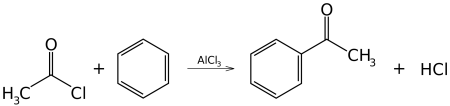
C6H6 + C6H5COCl →AlCl3 C6H5COC6H5 + HCl
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С. В третьей реакции образуется бензофенон (дифенилкетон).
- Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
C6H6 + CO + HCl →AlCl3 C6H5COH + HCl
- Реакции сульфирования и нитрования (электрофильное замещение):
C6H6 + HNO3 →H2SO4 C6H5NO2 + H2OC6H6 + H2SO4 → C6H5SO3H + H2O
- Восстановление бензола водородом (каталитическое гидрирование):
C6H6 + 3H2 →Ni/Pd,Pt;t C6H12
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:

- Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
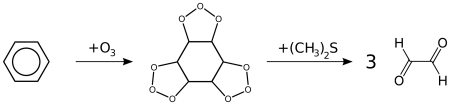
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
- Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем:
2C6H6 + 15O2 → 12CO2 + 6H2O
Влияние бензола на организм человека
Ароматические углеводороды — это неестественные для живого организма соединения, нарушающие его биологические процессы. Как типичный представитель этой группы бензол является токсичным веществом.
Основные органы-мишени углеводорода — нервная система и костный мозг. Нейротоксическое действие ярко проявляется при острых отравлениях, а гемотоксическое — при хронических. Однако влияние бензола на организм человека этим не ограничивается. Опосредованно он может действовать на печень, почки, сердце.
Предельно допустимая концентрация (ПДК) содержания бензола в атмосферном воздухе населённых мест не должна превышать 0,1–0,3 мг/м3.
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Бензол как наркотик

Тем не менее при вдыхании паров бензола у человека может возникать острое токсическое опьянение, сопровождающееся зрительными и слуховыми галлюцинациями, эйфорией. В наркологии это состояние носит название токсикомании, обусловленной вдыханием испарений летучих органических жидкостей. Как и при других видах наркомании, в этом случае существует опасность передозировки с возможностью летального исхода, а также возникновение физической и психической зависимости.
Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3C2H2 → C6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло, работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.
Экология
Бензол экологически небезопасное вещество, токсикант антропогенного происхождения. Основными источниками бензола, поступающего в окружающую среду со сточными водами или выбросами в атмосферу, являются нефтехимические и коксохимические промышленные предприятия, производство топлива и транспорт. Из водоёмов бензол легко улетучивается, cпособен к трансформации из почв в растения, что несёт серьёзную угрозу экосистемам.
Бензол обладает свойством кумуляции, вследствие своей липофильности он способен депонироваться в клетках жировой ткани животных, тем самым отравляя их.
Источник