- Хлорид бария: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Хлорид бария
- Содержание
- Описание
- Получение
- Химические свойства
- Применение
- Карбонат бария: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Сульфат бария: способы получения и химические свойства
- Способ получения
- Химические свойства
- Аналитическая химия
- Лабораторная работа № 4. Реакции и ход анализа анионов
- Общая характеристика анионов
- Оглавление
- 1. Общая характеристика анионов
- 2. Общая характеристика анионов I аналитической группы
- 2.1 Реакции сульфат-иона S04 2-
- 2.2 Реакции сульфит-иона S03 2-
- 2.3 Реакции карбонат-иона С03 2-
- 2.4 Реакции тиосульфат-иона S2O3 2-
- 2.5 Реакции оксалат – иона С2О4 2-
- 2.6 Реакции силикат-иона Si03 2-
- 2.7 Реакции фторид – ионов F —
- 2.8 Реакции фосфат-иона Р04 3-
- 3. Общая характеристика анионов II и III аналитических групп
- 3.1 Реакции хлорид-иона Сl —
- 3.3 Реакции йодид-иона I —
- 3.4 Реакции сульфид-иона S 2-
- 3.5 Реакции нитрат-иона N03 —
- 3.6 Реакции нитрит-иона N02 —
- 3.7 Реакции ацетат-иона CH3COO −
Хлорид бария: способы получения и химические свойства
Хлорид бария BaCl2 — соль щелочноземельного металла бария и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 208,23; относительная плотность для тв. и ж. состояния d = 3,856; tпл = 961º C;
Способ получения
1. Хлорид бария можно получить путем взаимодействия бария и хлора :
2. В результате взаимодействия карбоната бария и разбавленной соляной кислоты образуется хлорид бария, углекислый газ и вода:
3. Гидроксид бария вступает в реакцию с соляной кислотой с образованием хлорида бария и воды:
Качественная реакция
Качественная реакция на хлорид бария — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид бария образует нитрат бария и осадок хлорид серебра:
Химические свойства
1. Хлорид бария вступает в реакцию со многими сложными веществами :
1.1. Хлорид бария реагирует с кислотами:
1.1.1. Твердый хлорид бария реагирует с концентрированной серной кислотой при кипении , образуя сульфат бария и газ хлороводород :
1.2. Хлорид бария вступает в взаимодействие с солями:
1.2.1. В результате реакции между хлоридом бария и концентрированным раствором карбоната натрия образуется карбонат бария и хлорид натрия:
1.2.2. Хлорид бария может реагировать с сульфатом натрия при 800º С с образованием сульфата бария и хлорида натрия:
2. В результате электролиза раствора хлорида бария образуется водород и хлор:
Источник
Хлорид бария
| Хлорид бария | |
|---|---|
 | |
| Систематическое наименование | Хлорид бария |
| Традиционные названия | Хлористый барий |
| Хим. формула | BaCl2 |
| Рац. формула | BaCl2 |
| Состояние | твёрдое |
| Молярная масса | 208,246 г/моль |
| Плотность | 3,92 (20 °C) |
| Температура | |
| • плавления | 962 °C |
| • кипения | 1560 °C |
| Энтальпия | |
| • образования | -860,1 кДж/моль |
| Растворимость | |
| • в воде | 36,2 (20 °C) |
| ГОСТ | ГОСТ 4108-72 ГОСТ 742-78 |
| Рег. номер CAS | 10361-37-2 |
| PubChem | 25204 |
| Рег. номер EINECS | 233-788-1 |
| SMILES | |
| RTECS | CQ8750000 |
| ChEBI | 63317 |
| Номер ООН | 1564 |
| ChemSpider | 23540 |
| ЛД50 | 50-78 мг/кг (крысы, орально) |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид бария (хлористый барий) — бинарное неорганическое вещество, относящееся к классу солей. Химическая формула — BaCl2.
Содержание
Описание
Хлорид бария при стандартных условиях представляет собой бесцветные ромбические кристаллы. Малорастворим в спирте, не растворим в диэтиловом эфире. Из водных растворов кристаллизуется дигидрат хлорида бария BaCl2 ⋅ 2H2O — бесцветные кристаллы с моноклинной решёткой. Токсичен, ПДК 0,5 мг/м³
ГОСТ 4108-72 Реактивы. Барий хлорид 2-водный. Технические условия
Получение
1. Взаимодействие металлического бария с хлором:
2. Взаимодействие оксида бария с соляной кислотой:
3. Взаимодействие гидроксида бария с соляной кислотой (реакция нейтрализации):
4. Взаимодействие сульфида бария с хлоридом кальция:
5. Взаимодействие карбоната бария с соляной кислотой:
Химические свойства
1. Взаимодействие с растворами солей (реакция идёт, если образуется нерастворимое вещество):
2. Взаимодействие с некоторыми кислотами (реакция идёт, если образуется нерастворимое вещество):
Применение
Хлорид бария применяют в производстве пигментов (например, баритового жёлтого BaCrO4 , касселевой зелени BaMnO4 и других соединений), в качестве добавки в электролиты при получении магния, для закалки быстрорежущей стали (в виде расплавов смеси хлорида бария с хлоридами щелочных и щёлочноземельных металлов), как компонент керамики, реактив на SO4 2− (сульфат-ион), для утяжеления и осветления кожи в кожевенной промышленности, как зооцид.
Источник
Карбонат бария: способы получения и химические свойства
Карбонат бария BaCO3 — соль бария и угольной кислоты. Белый, при нагревании на воздухе разлагается, плавится под избыточным давлением CO2. Не растворяется в воде.
Относительная молекулярная масса Mr = 197,34; относительная плотность для тв. и ж. состояния d= 4,43; tпл = 1555º C при избыточном давлении.
Способ получения
1 . Гидроксид бария вступает в взаимодействие с углекислым газом и образует карбонат бария и воду:
2. Оксид бария вступает в взаимодействие с углекислым газом при комнатной температуре с образованием карбоната бария:
3. Хлорид бария вступает в реакцию с концентрированным раствором карбоната натрия и образует карбонат бария и хлорид натрия:
Качественная реакция
Качественная реакция на карбонат бария — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат бария образует хлорид бария, углекислый газ и воду:
Химические свойства
1. Карбонат бария разлагается при температуре выше 1000 — 1450º С, с образованием оксида бария и углекислого газа:
2. Карбонат бария вступает в реакцию со сложными веществами :
2.1. Карбонат бария реагирует с кислотами :
2.1.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат бария образует хлорид бария, углекислый газ и воду:
2.1.2. Карбонат бария реагирует с плавиковой кислотой при 900 — 1100º С. Взаимодействие карбоната бария с плавиковой кислотой приводит к образованию фторида бария, воды и углекислого газа:
2.1.3. Карбонат бария взаимодействует с сероводородной кислотой при 1000º С и образует сульфид бария, воду и углекислый газ:
3. Карбонат бария реагирует с простыми веществами:
3.1. Карбонат бария при температуре выше 1000º С вступает в реакцию с углеродом (коксом) образуя оксид бария и угарный газ:
BaCO3 + C = BaO + 2CO
Источник
Сульфат бария: способы получения и химические свойства
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Источник
Аналитическая химия
Лабораторная работа № 4. Реакции и ход анализа анионов
Общая характеристика анионов
Оглавление
1. Общая характеристика анионов
Анионами называются отрицательно заряженные ионы, существующие в кристаллах с ионной решеткой, в соляных расплавах и возникающие в водных растворах солей, кислот и оснований при электролитической диссоциации.
Анионы бывают простые, например Сl — , Br — , I — и сложные, например, S04 2- , Р04 3- , N03 — и др.
Существует очень много анионов, так как каждый элемент, находясь в различной степени окисления, может образовывать несколько анионов, например, Сl — , СlO — , С103 — , С104 — , а иногда может образовывать различные комплексные ионы, например, Сr04 2- и Сr207 2- .
Известно несколько классификаций анионов, основанных на различных свойствах анионов: окислительно-восстановительных, различном отношении к кислотам, различной растворимости солей.
В данном курсе предусмотрено изучение следующих анионов: S04 2- , С03 2- , В407 2- , РО4 2- , Si03 2- , Cl — , Br — , NO3 — .
Все указанные анионы можно разделить на три группы на основании различной растворимости их бариевых и серебряных солей.
Анионы, образующие группу
Соли бария не растворимы в воде, серебряные соли растворимы в кислотах
ВаСl2 в нейтральном или щелочном растворе
Соли серебра малорастворимы в воде и в разбавленной HN03
Сl — , Вr — , I — , S 2- , SCN — , [Fe(CN)6] 4- , [Fe(CN)6] 3- , CN — , BrO3 — , IO3 — , ClO —
AgN03 в присутствии 2 н. НN03
Cоли бария и серебра растворимы в воде
Группового реагента нет
Анионы в большинстве случаев не мешают обнаружению друг друга. Поэтому к реакциям отделения приходится прибегать в сравнительно редких случаях. Чаще обнаружение анионов ведут дробным методом, т.е. в отдельных порциях исследуемого раствора. В соответствии с этим при анализе анионов групповые реагенты применяют обычно не для разделения групп, а в основном, для того чтобы установить их наличие или отсутствие. Понятно, если отсутствие данной группы, то нет смысла проводить реакции на отдельные входящие в нее анионы. Таким образом, проведение групповых реакций значительно облегчает работу.
2. Общая характеристика анионов I аналитической группы
К первой группе анионов относятся ионы: SO4 2- (сульфат-ион), CO3 2- (карбонат-ион), Si03 2- (силикат-ион), Р04 3- (фосфат-ион), В02 — (борат-ион), или В407 2- (тетраборат-ион), SO3 2- (сульфит-ион), S2O3 2- (тиосульфат-ион), AsO4 3- (арсенат-ион), AsO3 3- (арсенит-ион), CrO4 2- (хромат-ион), Cr2O7 2- (бихромат-ион), F — (фторид-ион), C2O4 2- (оксалат-ион).
Действие групповых реагентов:
Перечисленные анионы образуют с Ba 2+ малорастворимые в воде соли, которые (за исключением BaSO4) растворимы в разбавленных минеральных кислотах. Поэтому анионы первой группы, кроме SO4 2- , не осаждаются из кислых растворов в виде солей бария.
В соответствии со сказанным групповым реагентом I группы анионов является BaCl2 в нейтральном или слабощелочном (рН 7-9) растворе.
AgN03 в нейтральной среде образует осадки со всеми анионами первой группы: Ag2S04 (выпадает из концентрированных растворов), Ag2CO3, AgB02, Ag2Si03 — белого цвета и Ag3PO4 — желтого цвета.
Соли слабых кислот: Na2SiO3, Na2B407 (NaB02), Na2CO3 могут вследствие гидролиза также образовывать бурый осадок Ag20:
Соли, образуемые анионами I группы с Ag + , в отличие от солей, образуемых анионами II группы, растворимы в разбавленных кислотах, в аммиаке и даже в воде (Ag2SO4, AgF).
2.1 Реакции сульфат-иона S04 2-
BaCl2 образует с сульфат-ионами осадок сульфата бария, не растворимого в кислотах.
Выполнение реакции:
К 3-5 каплям раствора, подкисленного НСl, прибавляют несколько капель раствора ВаС12. Выпадает белый кристаллический осадок, не растворимый в кислотах,
На будущее! Если нужно растворить BaSO4, то поступают так. К осадку BaSO4 прибавляют насыщенный раствор Na2CO3, перемешивают, ставят в нагретую водяную баню на 1-2 мин. Центрифугируют, раствор сливают. К осадку прибавляют свежую порцию раствора Na2CO3, и далее поступают, как указано выше. После 3-5-кратной обработки свежими порциями Na2CO3 осадок BaSO4 практически полностью превратится в BaCO3
который можно растворить в HCl или в CH3COOH.
2. Соли стронция (Sr 2+ ) образуют белый осадок SrSO4, почти нерастворимый в кислотах.
3. Соли свинца (Pb 2+ ) дают белый осадок PbSO4, растворимый в едких щелочах и в ацетате аммония.
4. Нитрат серебра AgNO3 с разбавленными растворами сульфатов осадка не выделяют, т.к. Ag2SO4 довольно хорошо растворим в воде. Однако в концентрированных растворах сульфатов осадок Ag2SO4 (белого цвета) может образоваться.
2.2 Реакции сульфит-иона S03 2-
1. Хлорид бария BaCl2 образует с SO3 2- белый осадок BaSO3 (растворимый в кислотах):
2. Нитрат серебра AgNO3 дает с растворами сульфитов белый осадок Ag2SO3, растворимый в HNO3 и в избытке SO3 2- ионов.
3. Соли стронция (Sr 2+ ) образуют с растворами сульфитов белый осадок SrSO3 (отличие от S2O3 2- ), также растворимый в кислотах.
4. Минеральные кислоты разлагают все сульфиты, растворимые и нерастворимые в воде, с выделением сернистого ангидрида SO2, который легко распознать по запаху горящей серы:
Для обнаружения SO2 используют его способность обесцвечивать растворы йода или KMnO4, например:
Перманганат калия КМn04 окисляет SO2 частично до серной, а частично до дитионовой кислоты H2S206:
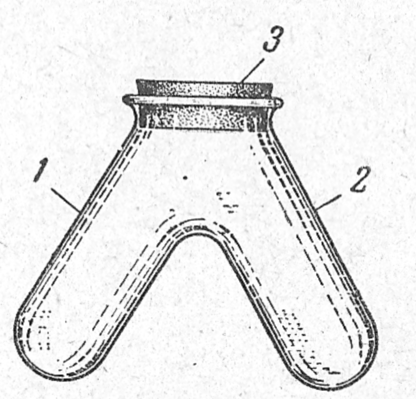
Реакцию проводят в одном из приборов для обнаружения газов (рис.1):
Рис. 1. Прибор для обнаружения газов: 1- колено для реагента; 2 — колено для исследуемого раствора; 3 — пробка.
Помещают несколько капель очень разбавленного раствора йода, окрашенного раствором крахмала в синий цвет, в одно колено прибора, в другое колено его вносят несколько капель исследуемого раствора сульфита и прибавляют к нему раствор НС1 или Н2S04. Отверстие прибора сейчас же закрывают резиновой пробкой и наблюдают обесцвечивание раствора йода под влиянием выделяющегося S02. Для ускорения реакции колено прибора с сульфитом подогревают. Можно пользоваться и другими приборами для обнаружения газов.
Раствор йода в описанном опыте можно заменить очень разбавленным раствором КМn04.
Кроме сульфитов при подкислении выделяют S02 и тиосульфаты. Сульфиды при действии кислот выделяют H2S, тоже обесцвечивающий растворы йода и КМn04. Таким образом, в присутствии S2O3 2- и S 2- указанная проба неприменима.
Йод восстанавливается не только газообразным S02, но и растворами сульфитов:
При этом раствор приобретает кислую реакцию, что является дополнительным признаком наличия S03 2- . Ионы S2O3 2- и S 2- при восстановлении йода кислоты не образуют.
Перманганат также восстанавливается сульфитами, причем реакцию можно проводить и в кислой, и в щелочной среде. Например, если к раствору Na2S03, подкисленному серной кислотой, прибавлять по каплям раствор КМn04, последний обесцвечивается (восстановление до Mn 2+ )
При восстановлении в щелочной среде реакция протекает иначе. Сначала малиновая окраска MnO4 — переходит в зеленую вследствие образования аниона марганцовистой кислоты MnO4 2- , отвечающего марганцу в степени окисления 6+. Если полученный зеленый раствор нагреть, он буреет и выделяет бурый осадок марганцоватистой кислоты МnО(ОН)2:
Подобным же образом перманганат в щелочной среде восстанавливается до МnО(ОН)2 и многими другими анионами-восстановителями, например S 2- , S2O3 2- , AsO3 3- , SCN — , [Fe(CN)6] 4- и I — .
2.3 Реакции карбонат-иона С03 2-
растворимого в разбавленных минеральных кислотах и даже в СН3СООН с выделением С02. При действии серной кислоты одновременно с растворением ВаС03 образуется малорастворимый сульфат бария.
2. Нитрат серебра AgNO3 дает с растворами карбонатов белый осадок Ag2СO3, растворимый в кислотах. При действии HCl образуется AgCl. При кипячении Ag2CO3 разлагается на Ag2O и CO2.
Кислоты вытесняют из карбонатов слабую угольную кислоту, которая быстро разлагается на С02 и Н20
Реакция сопровождается бурным выделением газа.
Выделяющийся газ можно обнаружить по реакции с Са(ОН)2 или Ва(ОН)2
Выполнение реакции:
К исследуемому раствору в пробирке добавляют несколько капель H2S04 или НС1, наблюдают выделение газа. Если во время выделения газа внести в пробирку согнутую проволочку, в ушке которой находится капля прозрачного раствора Ва(ОН)2 или Са(ОН)2, то можно заметить помутнение раствора. Реакцию можно выполнять и в приборе, показанном на рисунке 9.
Присутствие SO3 2- или S2O3 2 мешает обнаружению С03 2- , так как SO2, выделяющийся при действии кислот на сульфиты и тиосульфаты при поглощении раствором Са(ОН)2, может дать белый осадок СаS03. Обнаружив данные анионы, необходимо их окислить. Для этого перед прибавлением H2SO4 к раствору прибавляют избыток (4-6 капель) раствора Н2О2. Затем опыт ведут, как описано выше (п.3). Перекись водорода можно заменить и другими окислителями, например KMnO4, K2Cr2O7 и т.п.
2.4 Реакции тиосульфат-иона S2O3 2-
1. Хлорид бария ВаС12, прибавленный в избытке, образует с анионом S2O3 2- белый осадок BaS203. Тиосульфат бария способен к образованию пересыщенных растворов, поэтому при выполнении реакции следует потирать стенки пробирки стеклянной палочкой.
2. Нитрат серебра AgNО3, прибавленный в избытке, выделяет белый осадок Ag2S203, который быстро желтеет, затем буреет и в конце концов становится черным вследствие превращения в сульфид серебра:
Это одна из наиболее характерных реакций S203 2- . Выполняя ее, следует иметь в виду, что осадок Ag2S203 растворяется в избытке тиосульфата с образованием комплексных ионов [AgS203] — и [Ag(S203)3] 5- . Поэтому осадок выпадает только при избытке Ag + .
3. Кислоты выделяют из растворов тиосульфатов свободную Н2S203, которая разлагается на Н20, S02 и S:
Образующаяся при реакции сера вызывает помутнение раствора, которое наступает тем скорее, чем больше концентрация тиосульфат-иона и выше температура раствора. Так как сульфаты в аналогичных условиях выделяют S02, но муть серы не образуется, реакция позволяет обнаруживать S203 2- в присутствии SO3 2- и является одной из важнейших реакций тиосульфат-иона.
4. Раствор йода обесцвечивается растворами тиосульфатов с образованием тетратионатов (т. е. солей тетратионовой кислоты H2S4O6), например:
Реакция йода с тиосульфатом широко применяется в количественном анализе.
5. Перманганат калия KMnO4 восстанавливается тиосульфатами в кислой среде до Mn 2+ , а в щелочной – до MnO(OH)2, выпадающего в виде бурого осадка.При этом образуются сульфаты и тетратионаты.
6. Хлорид железа (III) дает с растворами тиосульфатов быстро исчезающее темно-фиолетовое окрашивание, обусловленное образование комплексного соединения Na[Fe(S2O3)2]. Окраска исчезает вследствие восстановления железа (III) до железа (II):
2.5 Реакции оксалат – иона С2О4 2-
Оксалат-ион С204 2- является анионом щавелевой кислоты Н2С204.
Свободная щавелевая кислота — вещество белого цвета, кристаллизующееся с двумя молекулами кристаллизационной воды. Она хорошо растворима в воде и является двухосновной кислотой средней силы. При умеренном нагревании легко возгоняется. Сильное прокаливание вызывает разложение ее на Н20, С02 и СО. Из солей Н2С204 (оксалатов) растворимы лишь соли щелочных металлов и магния. Остальные оксалаты малорастворимы в воде, но растворяются в минеральных кислотах.
Для щавелевой кислоты характерна ее способность образовывать комплексные анионы с Cr 3+ , Fe 3+ , Ni 2+ и некоторыми другими, например [Сr(С204)3] 3- , [Fe(C204)3] 3- , [Ni(C2O4)3] 4- и т. д.
1. Хлорид бария ВаС12 дает с С204 2- белый осадок ВаС204, растворимый в минеральных кислотах и (при кипячении) в уксусной кислоте.
3. Соли кальция (Са 2+ ) осаждают С204 2- в виде белого осадка СаС204, растворимого в минеральных кислотах, но нерастворимого в уксусной кислоте. Отношение к уксусной кислоте отличает СаС204 от солей кальция всех других изучаемых анионов, за исключением CaF2 (и CaS04, который может образоваться в случае больший концентрации ионов S04 2- в растворе).
Выполнение реакции:
Реакцию ведут при нагревании раствора до 70—80°С. Течение реакции легко заметить по обесцвечиванию перманганата, прибавляемого по каплям к нагретому кислому исследуемому раствору. Обесцвечивание обычно начинается не сразу. Прибавление 1-2 капель раствора MnS04 каталитически ускоряет реакцию. Так как обесцвечивать (т. е. восстанавливать) КМn04 способны и другие восстановители, например сульфиды, сульфиты, тиосульфаты, нитриты, то, обнаруживая этой реакцией С204 2- , его отделяют от восстановителей осаждением СаС12 в присутствии СН3СООН.
Дли этого, взяв в пробирку несколько капель исследуемого раствора, слегка подщелачивают его NaOH. Устранив таким образом возможно присутствующие в растворе сильные кислоты, которые помешали бы осаждению СаС204, подкисляют раствор уксусной кислотой до рН 4-5. К уксуснокислому раствору прибавляют избыток раствора СаС12 и несколько минут нагревают. Отцентрифугировав осадок солей кальция, тщательно промывают его горячей водой (для удаления остатков раствора, возможно содержащего отделяемые восстановители) и обрабатывают при нагревании 2 н. H2SO4. Отделив осадок, к полученному раствору добавляют 1 каплю MnSO4 и, нагрев на водяной бане, прибавляют по каплям 0,01 н. раствор перманганата. Обесцвечивание его указывает на присутствие С204 2- . В щелочной среде окисление С204 2- перманганатом хотя и происходит, но протекает весьма медленно, так что по отрицательному результату реакции нельзя судить, об отсутствии С204 2- .
5. Концентрированная серная кислота при нагревании отнимает от щавелевой кислоты воду, причем выделяются равные объемы СО2 и окиси углерода СО. Окись углерода при зажигании горит синим пламенем:
6. Резорцин С6Н4(ОН)2, растворенный в 100-кратном по массе количестве концентрированной H2S04, при нагревании с сухими оксалатами до появления «дыма» S03 дает характерное синее окрашивание
7. Прокаливание вызывает разложение оксалатов с незначительным обугливанием. Оксалаты щелочных металлов и бария образуют при этом соответствующие карбонаты и окись углерода, например:
Оксалаты железа, никеля, кобальта, меди и благородных металлов образуют при прокаливании свободные металлы, а остальные оксалаты — окиси металлов.
2.6 Реакции силикат-иона Si03 2-
В природных условиях существуют и могут быть получены искусственно весьма разнообразные соединения кремния, называемые силикатами. Они представляют собой соли различных кремневых кислот, состав которых может быть выражен общей формулой mSi02*nH20.
В большинстве случаев кремневые кислоты не удается выделить в чистом виде, и о существовании их приходится заключать лишь на основании наличия соответствующих солей. Из них растворимы в воде лишь соли щелочных металлов метакремневой кислоты Na2Si03 и K2Si03, называемые «растворимыми стеклами». Водные 0,1 н. растворы их вследствие гидролиза имеют сильнощелочную реакцию (рН > 12). Некоторые нерастворимые в воде силикаты разлагаются минеральными кислотами с образованием свободных кремневых кислот; другие, наоборот, таким путем не разлагаются. Нерастворимые в воде и неразлагаемые кислотами силикаты могут быть переведены в раствор сплавлением со смесью Na2C03 и К2С03, причем образуются растворимые силикаты щелочных металлов.
Растворы силикатов бесцветны.
1. Хлорид бария ВаС12 дает с Si03 2- белый осадок BaSi03. Кислоты разлагают его с образованием студенистого осадка, являющеюся смесью различных кремневых кислот.
2. Нитрат серебра AgN03 выделяет из растворов силикатов, желтый осадок Ag2Si03, растворимый в HN03:
3. Разбавленные кислоты при медленном прибавлении к не очень разбавленным растворам силикатов выделяют белый студенистый осадок (гель) кремневых кислот. Иногда все содержимое пробирки превращается в студень. При быстром прибавлении избытка кислоты, особенно к разбавленным растворам силиката, осадок выпадает не сразу, либо не выпадает в течение очень долгого времени. При этом кремневые кислоты остаются в растворе в виде коллоида (золя). Частично коллоидный раствор получается и при образовании студня. Поэтому осаждение кремневых кислот при действии кислот не может быть полным.
Для полного выделения кремневых кислот раствор несколько раз выпаривают досуха с концентрированной НС1. При этом кремневые кислоты обезвоживаются и переходят в практически нерастворимое состояние и после обработки остатка подкисленной водой могут быть отделены центрифугированием.
4. Соли аммония выделяют из растворов силикатов кремневую кислоту полнее, чем кислоты. Течение этой реакции является следствием нарушения равновесия гидролиза силиката и коагуляции кремневой кислоты NH4 + -ионами соли аммония:
20H — + 2NH4 + → 2NH4OH______________
Если на холоду осадок не выпадает, раствор нагревают несколько минут на водяной бане.
Следует иметь в виду, что алюминаты при нагревании с NH4C1 дают осадок А1(ОН)3, по виду очень похожий на осадок кремневых кислот. Точно так же соединения олова и сурьмы при действии NH4C1 выделяют аналогичные осадки гидроокисей. Поэтому во избежание ошибки рекомендуется делать поверочную реакцию на SiO3 2- . Для этого часть исследуемого раствора досуха выпаривают, сухой остаток переносят на фильтр и обрабатывают 0,5%-ным уксуснокислым раствором красителя метиленового голубого. После промывания холодной водой остается студенистый осадок кремневой кислоты, окрашенный метиленовым голубым в синий цвет.
5. Микрокристаллоскопическая реакция.
Выполнение реакции:
Крупинку исследуемого вещества растворяют во фтористоводородной кислоте (или обрабатывают раствором NH4F в НС1) на предметном стекле, покрытом слоем парафина (или на фотопленке, с которой удален светочувствительный слой). В полученный раствор вносят крупинку NaCl. В присутствии кремния образуются кристаллы Na2[SiF6]. Предельное разбавление 1:20 000.
2.7 Реакции фторид – ионов F —
Ион F — является анионом фтористоводородной кислоты HF, представляющей собой летучую жидкость, кипящую при 19,4°С. Пары ее обладают резким запахом и сильно ядовиты. В отличие от остальных галогеноводородных кислот, HF кислота средней силы. Особенность ее заключается в неспособности F — окисляться под действием химических реагентов, до свободного F2, так как фтор является наиболее сильным из всех известных окислителей. Другое отличие от этих кислот состоит в том, что фторид серебра AgF хорошо растворим в воде, в то время как AgCl, AgBr п AgI в ней практически нерастворимы.
Характерной особенностью HF является ее способность взаимодействовать с Si02 и силикатами с выделением газообразного фторида кремния SiF4, например:
Фториды щелочных металлов и аммония, а также серебра, алюминия, олова и ртути в воде растворимы. Фториды щелочноземельных металлов, свинца, меди и цинка практически нерастворимы. Реакция растворов фторидов близка к нейтральной. Ион F — бесцветен.
1. Хлорид бария ВаС12 дает с F — объемистый белый осадок BaF2, растворимый в избытке минеральной кислоты и в солях аммония.
2. Хлорид кальция СаС12 образует белый осадок осадок CaF2 малорастворимый в минеральных кислотах и нерастворимый в уксусной кислоте.
Выполнение реакции:
В сухую пробирку прибора для обнаружения газов, образующихся при реакции (рис.2), помещают небольшое количество (объемом с рисовое зерно) сухого фторида (например, CaF2) и обрабатывают его несколькими каплями концентрированной H2SO4. Затем внося в пробирку в ушке проволочки каплю воды и выдерживают. Вода мутнеет вследствие образования осадка кремневой кислоты.
Рис. 2. Прибор для обнаружения газов, образующихся при реакции.
Фторид реагирует сначала с H2SO4:
Получающийся фтористый водород действует на силикаты стекла пробирки, образуя соли кремнефтористоводородной кислоты H2SiF6 и газообразный фторид кремния SiF4. Состав обыкновенного стекла приблизительно отвечает формуле Na2SiO3*CaSi03*4Si02, поэтому происходящую реакцию можно представить уравнением:
Более полное уравнение этой реакции таково:
Образовавшийся SiF4, реагируя с находящейся в ушке проволочки водой, гидролизуется и дает гель ортокремневой кислоты:
Образование ортокремневой кислоты является причиной помутнения капли. Это наиболее характерная реакция F — .
При обнаружении F — таким способом раствор следует предварительно выпарить досуха. Вместо этого можно сначала осадить F — действием СаС12 в присутствии СНзСООН, осадок CaF2 отделяют центрифугированием, тщательно высушивают и исследуют на F — , как описано выше.
4. Ализарин и нитрат циркония (IV).
Если каплю раствора ализарина смешать с каплей раствора соли циркония (IV), образуется осадок циркон — ализаринового лака, окрашенный в фиолетовый цвет. Если затем к полученной смеси прибавить немного фторида, то ионы циркония (IV) будут связаны в более устойчивый комплекс [ZrF6] 2- . Вследствие этого фиолетовая окраска циркон-ализаринового лака исчезает и появляется зеленовато-желтая окраска ализарина. Схематически реакцию можно представить следующим образом:
Zr-ализарин + 6F — → [ZrF6] 2- + ализарин
(лак фиолетового (зеленовато-жел-
цвета) того цвета)
Фосфаты и оксалаты мешают реакции.
5. Микрокристаллоскопическая реакция.
Выполнение реакции:
К капле исследуемого раствора, подкисленного соляной кислотой, прибавляют немного твердой кремневой кислоты и затем крупинку NaCl. Образуются кристаллы Na2[SiF6], окрашенные в бледно-розовый цвет. Предельное разбавление 1:2500.
2.8 Реакции фосфат-иона Р04 3-
1. Хлорид бария BaCl2 образует с раствором Na2HPO4 белый осадок BaHPO4 (растворимый в кислотах):
Если вести реакцию в присутствии щелочей или NH4OH, ион HPO4 2- превращается PO4 3- и в осадок выпадает Ba3(PO4)2:
Осадок относится к кислотам так же, как и BaHPO4.
2. Нитрат серебра AgNO3 образует желтый осадок Ag3РO4, растворимый в HNO3 и в NH4OH. Напомним, что очень сходный с PO4 3- ион AsO4 3- образует с Ag + шоколадно-бурый осадок Ag3AsO4.
3. Действие молибденовой жидкости.
Раствор молибдата аммония (NH4)2Mo04 в HN03 образует с ионом Р04 3- желтый кристаллический осадок, представляющий аммонийную соль фосфорно-молибденовой кислоты.
Выполнение реакции:
15-20 капель реактива (NH4)2Mo04 + HN03 нагревают до кипения, вносят одну каплю испытуемого раствора и вновь нагревают.
Реактив добавляют в большом избытке, так как осадок фосфоромолибдата аммония растворяется в избытке фосфата.
Чувствительность реакции повышается при добавлении твердого NH4NO3 (влияние одноименных ионов NH4 + , понижающих растворимость осадка).
Реакции мешают ионы восстановителей.
Магнезиальная смесь образует с Р04 3- — ионом белый кристаллический осадок MgNH4P04
Выполнение реакции:
3-4 капли исследуемого раствора подкисляют 2-3 каплями 2 н. НС1 и затем добавляют по каплям 2 н. раствор NH4OH до запаха аммиака. Наблюдают выпадение белого осадка. Желательно потирание палочкой.
Подобный же осадок в этих условиях образует и ион AsO4 3- . Ион AsO3 3- не дает осадка с магнезиальной смесью, если концентрация его не слишком велика.
3. Общая характеристика анионов II и III аналитических групп
Во вторую аналитическую группу входят анионы: Cl — (хлорид-ион), Br — (бромид-ион), I — (иодид-ион), S 2- (сульфид — ион), SCN — (роданид-ион), [Fe(CN)6] 4- (гексацианоферрат (II), или ферроцианид-ион), [Fe(CN)6] 3- (гексацианоферрат (III), или феррицианид-ион), CN — (цианид-ион), BrO3 — (бромат-ион), IO3 — (иодат-ион), ClO — (гипохлорит-ион) и др.
Действие групповых реактивов:
Эти анионы осаждаются Ag + в слабо азотнокислом растворе, так как образуемые ими соли серебра нерастворимы в разбавленной (2 н.) HNO3.
В отличие от анионов II группы, соли серебра, образованные анионами III группы, а также SO4 2- и F — , растворимы в воде, образованные же остальными анионами I группы – растворимы в разбавленной HNO3.
Следовательно, групповым реагентом II группы анионов является AgNO3 в присутствии разбавленной HNO3. AgN03 образует осадки, не растворимые в кислотах: AgCl — белый; AgBr — слегка желтоватый, AgJ — светло-желтый; AgBr частично растворим в NH40H.
Соли бария анионов II группы растворимы в воде. Поэтому, в отличие от анионов I группы, анионы II группы не осаждаются BaCl2.
В водных растворах анионы II группы бесцветны, за исключением [Fe(CN)6] 4- и [Fe(CN)6] 3- .
К третьей группе относятся NO3 — (нитрат-ион), NO2 — (нитрит-ион), CH3COO — (ацетат-ион), ClO3 — (хлорат-ион), MnO4 — (перманганат-ион).
Характерной особенностью этой группы анионов является растворимость соответствующих солей бария и серебра, вследствие чего ни AgNO3, ни BaCl2 не осаждают анионов III группы. Из солей серебра менее других растворимы AgNO2 (ПР = 1,6 * 10 -4 ), CH3COOAg (ПР = 4 * 10 -3 ) и AgClO3 (ПР = 5*10 -2 ), которые поэтому могут выпадать в осадок из достаточно концентрированных растворов. Но при разбавлении водой и нагревании они легко растворяются. Группового реагента на третью группу нет.
Анионы NO3 — , NO2 — , CH3COO — , ClO3 — бесцветны, ион MnO4 — малиново-фиолетового цвета.
Основным отличительным свойством перманганат-иона является его высокая окислительная способность. По ходу анализа перманганат-ион восстанавливают каким-либо подходящим восстановителем до Mn 2+ и обнаруживают в V аналитической группе катионов. Поэтому здесь реакции перманганат-иона не рассматриваются.
3.1 Реакции хлорид-иона Сl —
К нескольким каплям испытуемого раствора добавляют HN03 до кислой реакции (проба на лакмус) и несколько капель AgNO3.
В присутствии ионов Cl — выпадает белый творожистый осадок AgCl. Осадок центрифугируют, промывают 1-2 раза дистиллированной водой и растворяют в NH4OH.
К полученному прозрачному раствору добавляют HN03 до кислой реакции:
Наблюдают выпадение белого осадка.
Осадок AgCl как и AgI и AgBr, нерастворим в HNO3, но в отличие от них, легко растворяется в NH3 и (NH4)2CO3.
3.2 Реакции бромид-иона Вr — .
1. Нитрат серебра AgN03 дает с растворами бромидов бледно- желтый осадок AgBr, нерастворимый в HN03. Осадок плохо растворим в NH4OH и практически нерастворим в (NH4)2C03 и аммиачном растворе AgN03.
Бромид серебра легко разлагается при действии цинковой пыли в присутствии воды или 2 н. раствора H2SO4:
2AgBr↓ + Zn↓ → Zn 2+ + 2Br — + 2Ag↓
Образующееся серебро выпадает в виде черного осадка, а ионы Br — переходят в раствор, где и могут быть обнаружены.
2. Действие окислителей.
Бромид-ионы легко окисляются хромом и другими окислителями, потенциал которых больше Е°Вг2/Вг-. При этом выделяется свободный бром желтого цвета, который легко экстрагируется органическими растворителями:
Выполнение реакции:
К 1-2 каплям раствора бромида добавляют 2-3 капли 2 н. H2S04 и по каплям хлорную воду до появления желтой окраски. Затем приливают 8-10 капель бензола, встряхивают, бензольное кольцо окрашивается в характерный желто-бурый цвет. Не следует приливать избытка хлорной воды, так как хлор переводит Вr в ВrС1 —слабо-желтого цвета.
3.3 Реакции йодид-иона I —
2. Действие окислителей (хлора и др.)
Окислители окисляют йодид-ион до свободного йода темно-бурого цвета. За протеканием реакции можно наблюдать по появлению бурой окраски раствора, но лучше добавить раствор крахмала. В присутствии I2 крахмал посинеет.
Йод хорошо извлекается органическими растворителями (бензол, хлороформ и др.), окрашивая их в фиолетово-розовый цвет.
Выполнение реакции:
Внесите в пробирку 2-3 капли раствора KI , 2 капли 1 M H2SO4, 1-2 капли хлорной воды (насыщенный водный раствор Cl2) и 1 каплю раствора крахмала. Появится синяя окраска.
КNO2 в присутствии кислоты окисляет ионы I — до свободного йода, окрашивая раствор в бурый цвет (в отличие от Вг — ). Йод обнаруживают раствором крахмала. Раствор окрашивается в синий цвет. Образуется адсорбционное соединение йода с крахмалом.
Выделяющийся I2 можно проэкстрагировать бензолом C6H6, слой которого окрасится в фиолетово-красный цвет.
Выполнение реакции:
а) – в пробирку внесите 2-3 капли раствора KI, 1-2 капли 2 M H2SO4, 2-3 капли раствора KNO2 и 3-5 капель бензола. Осторожно встряхните. В бензольном слое появится фиолетово-красная окраска.
б) – на кусочек фильтровальной бумаги нанесите последовательно 1 каплю раствора крахмала, 1 каплю 2 н. H2SO4, 1 каплю раствора KI и 1 каплю раствора KNO2. Появится синее пятно.
3.4 Реакции сульфид-иона S 2-
1. Нитрат серебра AgNO3 дает с S 2- черный осадок Ag2S. Осадок нерастворим в NН4OH, но растворяется при нагревании в разбавленной HNO3.
2. Кислоты, например разбавленные H2S04 и НС1, разлагают многие сульфиды с образованием газообразного H2S:
Выделение сероводорода можно обнаружить по запаху тухлых яиц, а также по почернению бумаги, смоченной раствором Pb(CH3COO)2 или Na2PbO2:
Реакцию удобнее всего проводить в газовой камере, поместив на нижнее ее стекло исследуемый сульфид и несколько капель 2 н. раствора H2SO4 или HCl, а к верхнему стеклу прикрепив бумагу, смоченную раствором соли свинца.
Не разлагаемые кислотами сульфиды можно разложить, смешав их с цинковой пылью и действуя НCI. При этом вместе с водородом выделяется сероводород, который может быть обнаружен, как указано выше.
3. Нитропруссид натрия Na2[Fe(CN)5NO] дает с S 2- (но не с HS — ) характерную красно-фиолетовую окраску, вследствие образования комплексного соединения Na4[Fe(CN)5NOS]. Сероводородная кислота, образующая почти исключительно ионы HS — не дает окраски. Наоборот, при добавлении щелочи окраска появляется, так как образуется достаточно ионов S 2- :
4. Соли кадмия (Cd 2+ ) дают с S 2- характерный ярко-желтый осадок CdS. Если его (после отделения от раствора) обработать 1—2 каплями раствора CuS04, то осадок почернеет вследствие образования CuS:
CdS↓ + Cu 2+ → Cd 2+ + CuS↓
Образование CdS используется для отделения S 2- от других анионов, содержащих серу. Но так как в случае применения растворимых солей кадмия в осадок вместе с CdS выпал бы и CdS03, в качестве реактива следует применять твердый карбонат кадмия CdC03. Карбонат кадмия — малорастворимая в воде соль, и поэтому создает в растворе очень малую, концентрацию Cd 2+ -ионов. Однако эта концентрация оказывается вполне достаточной для превышения произведения растворимости менее растворимого, чем карбонат кадмия, сульфида кадмия, который поэтому полностью осаждается:
Наоборот, произведение растворимости CdS03 оказывается недостигнутым, и SO3 2- остается в растворе.
3.5 Реакции нитрат-иона N03 —
Нитрат-ион является анионом азотной кислоты HN03, принадлежащей к числу самых сильных минеральных кислот. В то же время азотная кислота — довольно сильный окислитель, способный окислять большое число различных восстановителей. Вследствие этого HN03 применяется в анализе для растворения многих металлов и сплавов, нерастворимых в НС1 и H2SO4, для растворения некоторых сульфидов и т. д. Продуктами восстановления ее чаще всего являются двуокись азота N02 или окись азота N0. Первая образуется при окислении различных веществ концентрированной HN03, вторая — разбавленной. В отдельных случаях восстановление азотной кислоты может протекать дальше, причем образуется либо азот N2, либо даже аммиак NH3.
Все нитраты, за исключением основных солей висмута и ртути, а также солей некоторых органических оснований, растворимы в воде. Растворы нитратов, образованных сильными основаниями, имеют нейтральную реакцию, растворы нитратов, образованных слабыми основаниями, — кислую реакцию. Вследствие растворимости нитратов для обнаружения NO3 — применяются почти исключительно вызываемые им реакции окисления.
1. Реакция с дифениламином.
Дифениламин (C6H5)2NH окисляется ионом N03 — с образованием продукта окисления интенсивно-фиолетового цвета.
Выполнение реакции:
На тщательно вымытое и досуха вытертое часовое стекло помещают 4—5 капель раствора дифениламина в концентрированной [1] H2S04. Вносят туда же на кончике чистой стеклянной палочки очень немного испытуемого раствора нитрата и перемешивают. В присутствии N03 — появляется интенсивно синяя, окраска вследствие окисления дифениламина образующейся азотной кислотой.
Эту же реакцию дают NO2 — , Cr04 2- , MnO4 — , Fe 3+ , [Fe(CN)6] 3- и другие окислители, имеющие достаточно высокий стандартный потенциал.
Если присутствуют I — -ионы, серная кислота окисляет их до I2, а это иногда может маскировать окраску, вызываемую NO3 — .
Выполнение реакции:
На предметное или часовое стекло помещают каплю исследуемого раствора, вносят маленький кристаллик FeS04 и прибавляют каплю концентрированной H2SO4. В присутствии иона N03 — вокруг кристалла проявляется бурое кольцо, вследствие образования комплексного соединения [Fe(NO)SO4] по уравнению:
Иодиды и бромиды мешают реакции, так как в их присутствии выделяются I2 и Вг2, дающие сходные по окраске кольца. Ионы CrO4 2- , MnO4 — , [Fe(CN)6] 3- , [Fe(CN)6] 4- , SCN — , S2O3 2- и SO3 2- должны отсутствовать.
Ион N02 — также дает эту реакцию, причем она идет с разбавленной Н2S04 и даже с CH3COOН.
3. Восстановление до аммиака.
Выполнение реакции:
В пробирку к 3—4 каплям исследуемого раствора нитрата прибавляют несколько капель 2 н. раствора NаОН и вносят 1—2 кусочка металлического алюминия (алюминий можно заменить цинком, но тогда реакция идет медленнее). Пробирку закрывают (не слишком плотно) ватным тампоном толщиной около 1 см для задержания брызг щелочи, уносимых выделяющимися газами. Поверх тампона помещают кусочек влажной лакмусовой или фенолфталеиновой бумаги и оставляют на несколько минут. Для ускорения реакции содержимое пробирки нужно слегка нагреть, но как только начнется бурное выделение водорода, нагревание следует немедленно прекратить.
В данных условиях NO3 — восстанавливается до NH3, который вызывает посинение лакмусовой или покраснение фенолфталеиновом бумаги:
Обнаружению NO3 — этой реакцией мешает NH4 + , который должен быть предварительно удален из раствора кипячением со щелочью. Мешают реакции и все другие анионы, содержащие азот, т. е. NO2 — , SCN — , [Fe(CN)6] 4- и [Fe(CN)6] 3- , также восстанавливающиеся алюминием до NH3.
При действии цинка в присутствии СН3СООН нитраты восстанавливаются до нитритов:
Образование NO2 — может быть обнаружено его характерными реакциями.
[1] Если наблюдается посинение раствора, стекло было недостаточно чистым.
3.6 Реакции нитрит-иона N02 —
Нитрит-ион N02— является анионом азотистой кислоты HN02, которая существует лишь в холодных разбавленных водных растворах: она очень легко разлагается на ангидрид и воду:
Азотистый ангидрид устойчив только при низких температурах.
При комнатной температуре он сразу же разлагается:
Нитриты значительно устойчивее HN02. Все они хорошо растворимы в воде. Менее других растворим нитрит серебра AgN02, однако он легко растворяется при нагревании. Малорастворимы некоторые комплексные соли, содержащие N02 — , например K3[Co(NO2)6], (NH4)3[Co(N02)6] и др.
Азотистая кислота в отличие от азотной является сравнительно слабой кислотой (К = 5,1*10 -4 ).
1. Кислоты разлагают все нитриты с образованием бурого газа N02:
2. Иодид калия KI в присутствии разбавленной минеральной кислоты или СН3СООН окисляется нитритами до I2. Напомним, что в присутствии минеральных кислот так же действуют на I — и другие окислители с достаточно высоким стандартным потенциалом, например Mn04 — , Cr04 2- , [Fe(CN)6] 3- , As04 3- (в сильнокислой среде) и некоторые другие.
Поскольку в HN02 степень окисления азота (3+) имеет промежуточное значение, она может не только понижаться, но и повышаться. Другими словами, N02 может не только окислять (как в рассмотренной выше реакции), но и окисляться. Это наблюдается при действии на нагретый раствор нитрита, подкисленный серной кислотой, раствором перманганата калия:
Реакция сопровождается обесцвечиванием раствора КМn04. Напомним, что КМn04 обесцвечивается и многими другими восстановителями, имеющими достаточно низкий стандартный потенциал (например, S 2- , SO3 2- , S2O3 2- , С204 2- , SCN — , As03 3- , [Fe(CN)6] 4- , I — , Вг — ). Перманганат в щелочной среде NO2 — -ионами не восстанавливается.
4. Сульфаниловая кислота и а-нафтиламин.
Эта очень чувствительная реакция на NO2 — основана на образовании ярко окрашенного азокрасителя.
Выполнение реакции:
К капле нейтрального или уксуснокислого раствора на капельной пластинке (или на часовом стекле) прибавляют по одной капле раствора сульфаниловой кислоты и а-нафтиламина [1] . В присутствии NO2 — появляется тотчас или спустя некоторое время (в зависимости от количества NO2 — ) характерная красная окраска.
В отсутствие NO2 — эта реакция может быть с успехом применена для обнаружения NO3 — после восстановления его цинковой пылью в присутствии СН3СООН.
Подобно солям аммония действует мочевина CO(NH2)2 в кислой среде:
Выполнение реакции:
В 4 каплях раствора нитрита растворяют около 0,1 г мочевины: полученный раствор по каплям прибавляют к 2—4 каплям 2 н. растворa H2SO4. Каждую следующую каплю прибавляют только после того, как закончится бурная реакция с предыдущей каплей. Когда весь раствор будет прибавлен, жидкости дают некоторое время постоять, после чего отдельную порцию ее испытывают на NO2 — реакцией с KI в присутствии крахмала. Следует заметить, что при отделении NO2 — , особенно действием солей аммония, небольшое количество его обычно успевает окисляться до NO3 — .
Обнаружить NO3 — в присутствии NO2 — можно только после удаления NO2 — из раствора описанными выше методами.
Следует, однако, иметь в виду, что нитриты легко окисляются, и если в растворе присутствуют значительные количества их, то почти всегда будут присутствовать и ионы NO3 — . Поэтому специфичная реакция на NO3 — едва ли существует.
С достаточной достоверностью можно обнаруживать только большие количества NO3 — в присутствии малых количеств NO2 — . Это обнаружение проводится сравнительно мало чувствительной реакцией на NO3 — , после предварительного удаления NO2 — действием CO(NH2)2 или соли аммония. Но с достаточной уверенностью судить о наличии NO3 — в исследуемом растворе можно, только если реакция удается очень отчетливо.
[1] Формула сульфаниловой кислоты H2NC6H4SO3H, а а-нафтиламина — CioH7NH2; формула продукта реакции: H2N—С10Н6—N = N—С6Н4—S03H.
3.7 Реакции ацетат-иона CH3COO −
Ацетат-ион СН3СОО — является анионом уксусной кислоты СН3COOH, сравнительно слабой и одноосновной (К = 1,74*10 -5 ). Соли ее — ацетаты — почти все хорошо растворимы в воде. Менее других растворим ацетат серебра, малорастворимы некоторые основные соли, например [Fез(СНзСOO)6O]OН.
1. Гидросульфат калия (натрия), KHSO4, реагирует с твердым CH3COONa при растирании
с образованием более слабой, чем H2SO4, и летучей CH3COOH, чей знакомый запах уловить очень легко.
Выполнение реакции:
в маленькую ступочку внесите шпателем немного твердого CH3COONa и другим шпателем немного твердого NaHSO4. Осторожно разотрите смесь пестиком. Появится запах “уксуса”.
2. Серная кислота H2S04 при действии на ацетаты вытесняет из них свободную СН3СООН, которая, улетучиваясь при нагревании, может быть обнаружена по характерному запаху.
3. Образование этилацетата и амилацетата.
К нескольким каплям раствора ацетата, а лучше — к нескольким кристалликам соли прибавляют по 3-4 капли концентрированной H2S04 и этилового спирта; смесь нагревают 1-2 мин на водяной бане, после чего выливают содержимое пробирки в стакан с холодной водой.
Образуется этилацетат, обладающий характерным приятным запахом:
При замене этилового спирта амиловым спиртом С5Н11ОН образуется амилацетат СН3СООС5Н11, называемый грушевой эссенцией; он также имеет приятный запах.
К раствору CH3COONa прибавляют немного FeCl3, появляется красно-бурая окраска вследствие образования комплекса. При разбавлении раствора водой и нагревании выпадает осадок основной соли [Fе3(СН3СОО)6О]ОН.
Раствор должен быть нейтральным и не должен содержать анионов, осаждающих железо(III): С03 2- , S03 2- , Р04 3- , [Fe(CN)6] 4- и т. д. Должны также отсутствовать ионы SCN — и I — ; иодид -ион, окисляясь Fe 3+ до I2, придает раствору красно-бурую окраску. Все указанные ионы можно удалить, прибавляя к нейтральному раствору AgN03 или Ag2S04. Однако это связано со значительным расходом солей серебра, и без особой необходимости рассматриваемой реакцией пользоваться не следует.
Выполнение реакции:
На капельную пластинку помещают по капле исследуемого раствора, 5%-ного раствора La(N03)3 и 0,01 н. раствора йода. Через 1 мин действуют каплей 1 н. раствора NH4OH и оставляют на несколько минут (раствор не перемешивать). В присутствии СН3СОО — вокруг капли аммиака появляется синее или синевато — бурое кольцо. Реакции мешают S04 2- и РО4 3- , дающие с лантаном малорастворимые соли. Поэтому S04 2- и РО4 3- необходимо предварительно осадить действием Ba(N03)2 или ВаСl2.
Источник