- Окислительно-восстановительная двойственность HNО2.
- Использование HNО2 в органическом синтезе.
- Соли азотистой кислоты — нитриты Me(NО2)n
- Способы получения.
- Химические свойства.
- Азотная кислота: получение и химические свойства
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Азотистая кислота: получение и свойства
- Получение азотистой кислоты
- Химические свойства
- Азотистая кислота
- Характеристики и физические свойства азотистой кислоты
- Получение азотистой кислоты
- Химические свойства азотистой кислоты
- Применение азотистой кислоты
- Примеры решения задач
Окислительно-восстановительная двойственность HNО2.
Наряду с общими свойствами слабых кислот, HNО2 проявляет также окислительно-восстановительную активность. Наиболее характерны для нее окислительные свойства, причем восстанавливается она в большинстве случаев до NO; например:
С другой стороны, действием сильных окислителей HNО2 может быть окислена до HNО3:
Использование HNО2 в органическом синтезе.
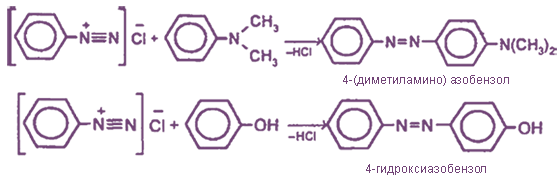
При взаимодействии HNО2 с первичными ароматическими аминами в кислой среде образуются диазониевые соли (реакции диазотирования
С ароматическими аминами и фенолами диазониевые соли вступают в реакцию азосочетания, в результате которой образуются азокрасители (производные азобензола C6H5-N=N-C6H5):
При взаимодействии HNО2 с алифатическими первичными аминами образующиеся диазониевые соли настолько нестабильны, что мгновенно разлагаются с образованием спиртов и выделением азота:
Соли азотистой кислоты — нитриты Me(NО2)n
В отличие от самой азотистой кислоты, ее соли — нитриты — устойчивы. Представляют собой кристаллические вещества, хорошо растворимые в воде (труднее других — AgNО2). Наибольшее практическое значение имеют нитриты щелочных металлов — NaNО2 и KNО2. Нитриты токсичны.
Способы получения.
1) Пропускание эквимолярной смеси оксидов азота (II) и (IV) в раствор щелочи:
2) Обменные реакции между NaNО2 и солями металлов:
3) Разложение нитратов щелочных и щелочноземельных Me:
Химические свойства.
1) Как и HNО2, нитриты обладают окислительно-восстановительной двойственностью:
2) Нитрит аммония разлагается при нагревании: NH4NО2 = N2↑ + 2Н2O
Источник
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Источник
Азотистая кислота: получение и свойства
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например , соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства
1. Азотистая кислота HNO 2 существует только в разбавленных растворах, при нагревании она разлагается :
без нагревания азотистая кислота также разлагается :
2. Азотистая кислота взаимодействует с сильными основаниями .
Например , с гидроксидом натрия:
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства . Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например , HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
Азотистая кислота окисляет соединения железа (II):
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства . Под действием окислителей азотистая кислота переходит в азотную.
Например , хлор окисляет азотистую кислоту до азотной кислоты:
Кислород и пероксид водорода также окисляют азотистую кислоту:
Соединения марганца (VII) окисляют HNO2:
Источник
Азотистая кислота
Характеристики и физические свойства азотистой кислоты
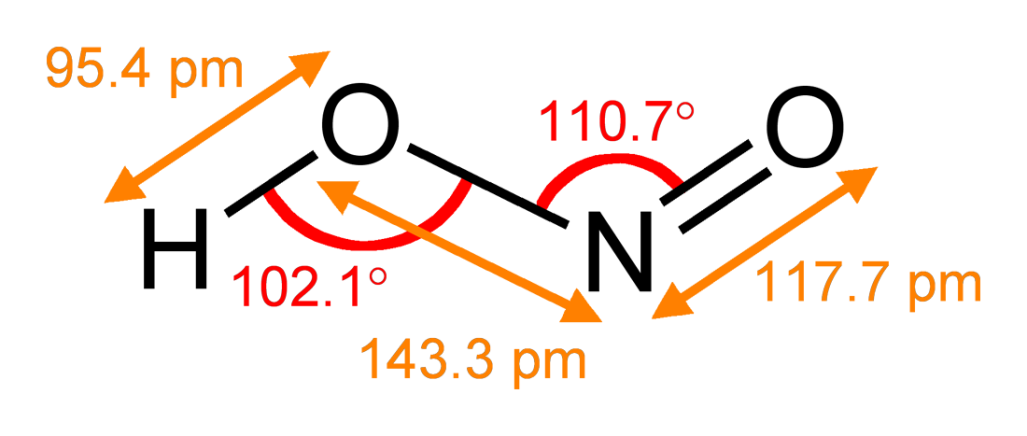
Она имеет две таутомерные формы: NO(OH) и N(H)O2(преобладает при комнатной температуре в растворе). Концентрированные растворы – голубые, разбавленные растворы – бесцветные. В форме NO(OH) проявляет слабые кислотные свойства, в форме N(H)O2 кислотой не является.
Рис. 1. Строение молекулы азотистой кислоты.
Таблица 1. Физические свойства азотистой кислоты.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Растворимость в воде, г/100мл
Получение азотистой кислоты
При действии разбавленной серной кислоты на раствор какого-нибудь нитрита происходит образование свободной азотистой кислоты:
Химические свойства азотистой кислоты
Азотистая кислота в водном растворе диссоциирует на ионы. Её соли носят название нитриты.
Азотистая кислота нейтрализуется щелочами (1), гидратом аммиака (2):
Реагирует с атомным водородом (3), кислородом (4), пероксидом водорода (5, 6):
Проявляет окислительно-восстановительные свойства (7 — 10):
Применение азотистой кислоты
Азотистая кислота нашла применение в органическом синтезе, в частности, для получения ароматических аминов и солей диазония.
Примеры решения задач
| Задание | Термодинамическая константа кислотности азотистой кислоты равна 6,2×10 -4 . Рассчитайте реальную константу в растворе с ионной силой 0,01. |
| Решение | В таблицах находим значения коэффициентов активности ионов H + и NO2 — при ионной силе 0,01: |
Коэффициент активности молекул азотной кислоты равен единице.
K = 6,2×10 -4 / (0,89) 2 = 7,8×10 -4 .
| Задание | Вычислите рН и рОН раствора азотистой кислоты, если концентрация ионов водорода H + в растворе равна 10 -7 М. Укажите реакцию среды. |
| Решение | Известно, что водородный показатель вычисляется по формуле |
Найдем рН раствора азотистой кислоты:
pH = -lg(10 -7 ) = 7,00.
Для расчета показателя основности раствора используют следующую формулу:
pOH = 14 – 7,00 = 7,00.
Среда раствора – нейтральная.
| Понравился сайт? Расскажи друзьям! |