- Урок№9. Простые и сложные вещества.
- Как разделить неделимое? Элементарная частица
- 15 самых интригующих фактов об атомах
- 1. Состав атомов
- 2. Ядро содержит почти всю массу
- 3. Электроны чрезвычайно малы
- 4. Атом может иметь электрический заряд
- 5. Что удерживает протоны и нейтроны вместе?
- 6. 94 Атома естественного происхождения на Земле
- 7. Каждый атом уникален
- 8. Самый большой и самый маленький атом
- 9. Самый тяжелый и легкий атом
- 10. Возможно ли преобразовать один элемент в другой?
- 11. Атомы в человеческом теле
- 12. Сколько атомов существует во Вселенной?
- 13. Радиоактивные атомы
- 14. Видя атомы
- 15. Квантовая природа атомных свойств
Урок№9. Простые и сложные вещества.
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ
Железо Fe , медь Cu , алюминий Al , ртуть Hg , золото Au , серебро Ag и другие
Уголь С, сера S , фосфор P , йод I 2 , кислород O 2 , водород H 2 и другие.
1. Твёрдое агрегатное состояние (исключение – ртуть)
2. Металлический блеск
3. Хорошие проводники тепла и электричества.
4. Пластичные и ковкие.
1. Твёрдые (Уголь С, сера S , фосфор P , йод I 2 ), жидкие (бром Br 2 ) и газообразные (кислород O 2 , водород H 2 ).
2. Металлическим блеском не обладают (исключение йод)
3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ.
» jsaction=»rcuQ6b:WYd;»>
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент” . Что общего и чем эти понятия различаются?
Химический элемент – это атомы одного и того же вида . Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества , состоящие из атомов одного элемента (H 2 , O 2 , Cl 2 , P 4 , Na, Cu, Au), и сложные вещества , состоящие из атомов разных элементов (H 2 O, NH 3 , OF 2 , H 2 SO 4 , MgCl 2 , K 2 SO 4 ).
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
На 2019 год в периодической таблице – 118 химических элементов, которые образуют около 500 простых веществ.
Самородное золото — простое вещество
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией . Например, элемент кислород O имеет две аллотропные формы — кислород O 2 и озон O 3 с различным числом атомов в молекулах. Аллотропные формы элемента углерод C — алмаз и графит — отличаются строение их кристаллов. Существуют и другие причины аллотропии.
Сложные вещества часто называют химическими соединениями , например, оксид ртути(II) HgO (получается путем соединения атомов простых веществ — ртути Hg и кислорода O 2 ), бромид натрия (получается путем соединения атомов простых веществ — натрия Na и брома Br 2 ).
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
4. Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная характеристика смесей и химических
Источник
Как разделить неделимое? Элементарная частица
Довольно долго физики считали атом фундаментальной частицей. Но выдвинутая в 1911 г. Резерфордом гипотеза о планетарном строении атома подтолкнула науку к развитию ядерной физики. И вот неделимый атом уже состоит из ядра и электронов. Сегодня физике известно о десятках элементарных частиц, но посмотрев в школьные или университетские учебники вы узнаете только о четырёх: протоне, нейтроне, электроне и фотоне.
Атом намного сложнее, чем предполагали ранее. Ядро атома, если это не водород, состоит из набора протонов и нейтронов. Однако они отличаются лишь зарядом и небольшим различием массы, что позволило отнести их к одному классу нуклонов. В 1970 г. на ускорителе построенном в Стенфорде установили, что нуклоны это сложные (вот это поворот) составные частицы. Нуклоны состоят из трёх кварков, кварк-антикварка и глюонов. Три кварка — это основа ядра, у каждого кварка свои характеристики заряда, отсюда и следует заряд протона. В протоне один d-кварк (с зарядом -1/3) и два u-кварка (с зарядом +2/3). В сумме заряд протона получается равным единице. Нейтрон имеет два d и один u-кварк (в сумме 0). Фокус в том, что протон с нейтроном могут обмениваются друг с другом характеристиками. Для этого они испускают пи-мезоном (кварк-антикварк). Нейтрон становится протоном, а протон — нейтроном. Магия.
Вы явно слышали про ЦЕРН и Большой адронный коллайдер — один из самых дорогих экспериментов в истории. Главной целью для вкладывания денег в столь масштабную идею — это экспериментально рассмотреть стандартную модель, а в последствии найти её отклонения. Стандартная модель описывает три из четырёх фундаментальных взаимодействия: сильное, слабое и электромагнетизм. Сильное взаимодействие наблюдается в ядрах атомов. Слабое определяет механизм бета-распада. Электромагнетизм определяет взаимодействие заряженных объектов. Завершение стандартной модели связано с открытием бозона Хиггса, ведь без него все частицы не имели бы массы. Без бозона Хиггса не было понятно и отсутствие массы у фотона и глюона, но присутствие её у переносчиков слабого взаимодействия.
Теперь же дело за объединением стандартной модели и гравитации, описанной в общей теории относительности Эйнштейном, введении в физику антиматерии, а в последствии и переходу к «новой физике». БАК с этой задачей не справился, поэтому для этого понадобятся коллайдер побольше.
100 киллометровый ускоритель стоимостью 9 миллиардов евро, ухх. Ротенберг при виде таких цифр уже тёр бы ладошки. Однако задачи, поставленные перед будущим коллайдером, являются приоритетными для всего научного сообщества.
Знание об устройстве вещества это не единственное, что может дать нам изучение элементарных частиц. Все процессы во Вселенной протекают под их диктовку.
Наиболее стабильные частицы, называемые нейтрино, испускаются звёздами в результате термоядерного синтеза. Нейтрино сложно зафиксировать, но информация заложенная в этих частицах может дать представление о термоядерных реакциях на Солнце, что приближает людей к доступной энергии. Реликтовые нейтрино объяснят о ходе эволюции Вселенной и её формировании. Поскольку нейтрино чрезвычайно сложно поймать, то и эксперименты связанные с ним дело также весьма затратное.
Наука не всегда предсказуема, поэтому о результатах будущих исследований можно лишь гадать.
Источник
15 самых интригующих фактов об атомах
Все во Вселенной — от ядра Земли до самых дальних галактик — состоит из атомов. Это фундаментальная единица элемента.
К настоящему времени было идентифицировано 118 элементов (все они перечислены в периодической таблице).
Слово «атом», означающее «неделимый», происходит от древнегреческого слова «ἄτομος». Древнегреческие философы считали, что атом невозможно разделить на что-то меньшее. Однако ученые доказали этот факт неправильно в начале 20 века, когда они открыли субатомные частицы (электроны, протоны, нейтроны).
Ниже мы перечислили некоторые из наиболее интригующих фактов об атомах, которые только сделают вас умнее. Так что давайте начнем с самого короткого и простого.
1. Состав атомов
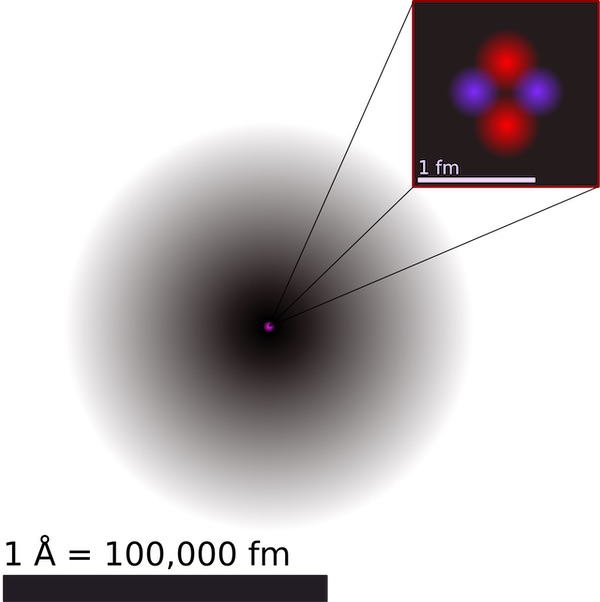
Каждый атом содержит одно ядро [в центре] и один или несколько электронов. Ядро обычно состоит из равного числа протонов и нейтронов, вместе называемых нуклонами.
2. Ядро содержит почти всю массу
Ядро, расположенное в центре атома, составляет более 99,9 % его массы, но занимает лишь одну триллионную его общего объема. Таким образом, большая часть пространства внутри атома пуста.
3. Электроны чрезвычайно малы
Электрон является наиболее активным компонентом атома, но он почти ничего не вносит в массу атома. Например, в атоме водорода масса электрона составляет всего 0,0005 массы ядра.
4. Атом может иметь электрический заряд
Электроны несут отрицательный заряд, протоны несут положительный заряд, а нейтроны не имеют электрического заряда. Атом электрически нейтрален, если он имеет одинаковое количество электронов и протонов.
Однако, если атом имеет меньше или больше протонов, чем электронов, он имеет общий положительный или отрицательный заряд (известный как Ион).
5. Что удерживает протоны и нейтроны вместе?
Ядерная сила удерживает протоны и нейтроны вместе в ядре атома. Электроны притягиваются к протонам другой силой, называемой электромагнитной силой, которая слабее ядерной силы.
Эта ядерная сила примерно в 1038 раз сильнее гравитационной, но действует только в очень малых масштабах.
6. 94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя некоторые встречаются в незначительных количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
7. Каждый атом уникален
Каждый атом содержит определенное количество протонов в ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра содержат 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные характеристики зависят от количества электронов в атоме.
8. Самый большой и самый маленький атом
Самым большим элементом (по размеру) является Франций, но поскольку он крайне нестабилен, предпочтение отдается Цезию. У него большая валентная оболочка и относительно менее эффективный заряд ядра.
Наименьший элемент — гелий, первый в группе благородных газов в периодической таблице. Его атомный радиус примерно в 9 раз меньше диаметра цезия.
Иллюстрация атома гелия | Предоставлено: Викимедиа.
9. Самый тяжелый и легкий атом
Оганессон — самый тяжелый элемент (по атомной массе), открытый в 2002 году. Это первый благородный газ, который удивительно химически активен и проявляет очень необычные физические и химические свойства.
Оганессон, однако, является самым тяжелым синтетическим химическим элементом. Самым тяжелым природным элементом является Уран с атомным весом 238,029.
Элемент, который имеет самый легкий атом-это водород. У него есть только один протон, обращающийся вокруг одного электрона. Его самый распространенный изотоп, известный как Протий, состоит из одного протона и нулевых нейтронов.
10. Возможно ли преобразовать один элемент в другой?
В некоторых экстремальных условиях электромагнитная сила (которая отталкивает электроны и протоны) преодолевает сильную ядерную силу, выбрасывая нуклоны из атомного ядра и оставляя после себя совершенно другой элемент. Это именно то, что происходит при делении ядер.
Однако этот процесс [распада] является дорогостоящим и опасным. Ученые пока не смогли безопасно генерировать энергию с помощью ядерного деления.
11. Атомы в человеческом теле
Тело человека весом 70 кг состоит из 7 × 10 27 атомов. Три атома (водород, кислород и углерод) составляют до 99 процентов от общего количества.
Что еще интереснее, 98 процентов этих атомов обновляются каждый год, даже не подозревая об этом. Самая быстро меняющаяся молекула — это вода: почти 50 процентов молекул воды в организме заменяются каждые 8 дней.
Более того, человеческий волос — 100 нанометров в поперечнике — состоит из миллиона атомов углерода.
12. Сколько атомов существует во Вселенной?
Наблюдаемая вселенная огромна: она охватывает приблизительно 93 миллиарда световых лет. Согласно теоретической оценке, в нашей вселенной насчитывается от 10 78 до 10 82 атомов.
Это не какой-то выдуманный номер. Расчеты основаны на достоверных данных (что мы знаем о вселенной). Однако между этими оценками существует огромная разница, что говорит о значительной степени ошибки. Более точные цифры будут доступны, когда мы узнаем больше о космосе.
13. Радиоактивные атомы
В нестабильном атоме силы неуравновешенны. В этом случае атомное ядро содержит избыток либо протонов, либо нейтронов. Атом пытается достичь стабильного состояния, выбрасывая свои дополнительные частицы или высвобождая энергию в других формах. Элементы, содержащие такие нестабильные ядра, называются радиоактивными.
Фермий, например, является радиоактивным элементом: его самый стабильный изотоп (Fm-257) имеет период полураспада 100,5 суток.
14. Видя атомы
Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом.
Сканирующий туннельный микроскоп захватывает атомы кремния на поверхности кристаллического карбида кремния
Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах.
15. Квантовая природа атомных свойств
Поскольку атомы чрезвычайно малы по размеру, они проявляют квантовые свойства, поэтому предсказание их поведения с применением классической физики всегда приведет к неверным результатам.
Когда электрон прыгает с одного энергетического уровня (орбиты) на другой, он не перемещается в пространстве между ними. Вместо этого он исчезает с одной орбиты, а затем сразу же появляется на другой орбите.
Чтобы лучше описать и оценить их поведение, несколько атомных моделей включили в себя законы квантовой физики.
Источник